|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ОБЩИЕ АСПЕКТЫ РЕГУЛЯЦИИ РЕЦЕПТОРОВ
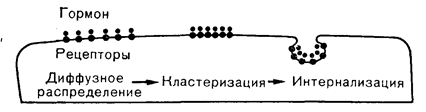
Многие рецепторы пептидных гормонов регулируются гомологичным гормоном, а иногда и другими гормонами. Повышение концентрации гормона обычно приводит к уменьшению числа соответствующих рецепторов, что впервые было показано в отношении инсулиновых рецепторов печени и культивируемых лимфоцитов [19]. Такая «снижающая регуляция» инсулиновых рецепторов встречается при ожирении у человека и при генетическом или индуцированном ожирении у грызунов и отражает, по-видимому, влияние избытка инсулина в крови на число своих рецепторов. По всей вероятности, эта потеря рецепторов является общим результатом повышения уровня инсулина в крови, сопровождающего инсулинрезистентные состояния. Обратный эффект, т. е. увеличение числа инсулиновых рецепторов в условиях сниженной секреции инсулина, наблюдали в печени хомяков и крыс с диабетом. Другими примерами «снижающей регуляции» рецепторов гомологичными гормонами служат взаимодействие СТГ, тиротропин-рилизинг гормона (ТРГ), катехоламинов, гонадотропинов и глюкагона со своими рецепторами. Рецепторы некоторых пептидных гормонов, таких, как пролактин и ангиотензин II, могут и увеличиваться в числе после воздействия повышенных концентраций гормона, но в таких случаях правилом является все же потеря рецепторов клеточной поверхностью. Некоторые рецепторы, особенно инсулиновые, при воздействии повышенных концентраций лиганда проявляют отрицательную кооперативность. Если это встречается и в физиологических условиях, то данный феномен мог бы служить еще одной формой регуляции рецепторов, при которой частичная насыщенность их приводит к снижению сродства остальных связывающих мест с острым уменьшением чувствительности клеток-мишеней при увеличении концентрации инсулина. Важным фактором регуляции рецепторов является неполная обратимость реакции связывания, т. е. неполная диссоциация комплекса, образующегося в начальной фазе взаимодействия гормона с рецептором. При анализе гормонрецепторного взаимодействия традиционно применяют методы, основанные на допущении обратимости образования комплекса, но данные кинетических исследований часто свидетельствуют о том, что гормонрецепторный комплекс, быстро диссоциируя вначале, затем распадается гораздо медленнее и неполностью. Это указывает на появление таких конформационных изменений рецептора после начального взаимодействия с гормоном, которые обусловливают более прочное связывание лиганда, что можно представить следующим уравнением: Г+ Р «Г•Р ® Г•Р. Одна из форм связывания с более высоким сродством обусловливается взаимодействием занятых рецепторов с компонентами аденилатциклазной системы, причем гуаниловые нуклеотиды могут обеспечивать обратимость этого связывания. Такое состояние повышенного сродства наблюдали после связывания лиганда с рецепторами катехоламинов, глюкагона, простагландина Е, дофамина и мускариновых соединений [20]. Другая форма прочного связывания, которое становится все менее обратимым, характерна для рецепторов инсулина, ФРЭ, пролактина и ЛГ и отражает, по-видимому, предварительный этап по отношению к процессу интернализации гормонрецепторного комплекса. В любом случае длительная занятость недиссоциирующим лигандом всегда является потенциальной причиной функциональной потери рецепторов и должна учитываться при исследовании их регуляции. Помимо уменьшения числа связывающих мест, длительная занятость рецептора лигандом повышает вероятность разрушения или каких-либо иных процессов изменения и разрушения гормонрецепторных комплексов. К таким процессам могло бы относиться проникновение этих комплексов в толщу клеточной мембраны или «сбрасывание» их с клеточной поверхности, но современные данные свидетельствуют в пользу эндоцитоза и последующего лизосомного разрушения интернализованных гормонрецепторных комплексов. Процессы роста клеток, движения и распознавания координируются супрамолекулярным комплексом поверхностных рецепторов и субмембранных фибриллярных структур, с помощью которых изменения (поверхностная модуляция) конформации, подвижности и распределения рецепторов приводят к изменениям сопряженных цитоплазматических компонентов. Эти структурные взаимодействия, по всей вероятности, определяют образование конгломератов (кластеризация, возникновение «пятен» и «нашлепок») рецепторов под действием перекрестно-связываемых агентов, таких, как двухвалентные антитела и мультивалентные лектины. Моновалентные лиганды, такие, как гормоны, также могут вызывать перераспределение рецепторов на клеточной мембране с кластеризацией мест связывания, образующих конгломераты на поверхности клеток. Такая кластеризация является, вероятно, важным фактором последующей интернализации гормонрепепторных комплексов, но может быть и существенным моментом острой фазы гормонального эффекта (рис. 4—6). Так, двухвалентные антитела к рецепторам инсулина в изолированных адипоцитах могут как связываться с рецептором, так и оказывать инсулиноподобное действие, тогда как моновалентные фрагменты антител Fab связываются с рецептором, но не вызывают биологической реакции. Добавление анти-F (аb`)2-антисыворотки перекрестно связывает рецептор Fab и восстанавливает инсулиноподобное действие антитела [21]. Эти эффекты указывают на то, что перекрестное связывание или микроагрегация рецепторов представляет собой важный этап инсулиноподобных влияний антирецепторных антител и, вероятно, также действия самого инсулина. Такое представление согласуется с данными о мобильности инсулиновых рецепторов и их способности образовывать кластеры на клеточной мембране, а также об инсулиноподобных эффектах некоторых лектинов.
Рис. 4—6. Распределение гормонрецепторных комплексов в мембране клетки-мишени при действии пептидного гормона.
Дата добавления: 2015-02-05 | Просмотры: 908 | Нарушение авторских прав |