|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
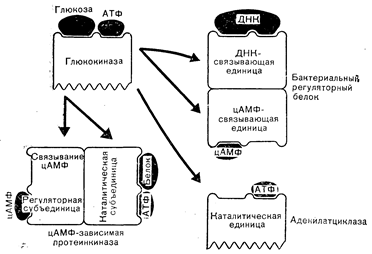
ПРОИСХОЖДЕНИЕ РЕГУЛЯТОРНЫХ БЕЛКОВБелки, принимающие участие в регуляции метаболизма, сами могут служить лигандами (например, пептидные гормоны), т. е. взаимодействовать с другими белками, такими, как гормональные рецепторы, оказывая регуляторное действие. Другие регуляторные белки такие, как рецепторы гормонов или регуляторная субъединица протеинкиназы (фермент, активируемый цАМФ), обладают активностями, контролируемыми связыванием регуляторных лигандов (т. е. гормонов и цАМФ соответственно) (см. главу 4). Для того чтобы активности белков этого класса могли специфически регулироваться лигандами, такие молекулы прежде всего должны обладать участками, специфически (и, как правило, с высоким сродством) связывающими лиганд, что придает молекулам способность отличать лиганд от других химических соединений. Кроме того, белок должен обладать такой структурой, чтобы в результате связывания лиганда его конформация могла меняться, т. е. обеспечивать возможность оказания регуляторного действия. Например, у млекопитающих специфическое связывание цАМФ с регуляторной субъединицей отдельных протеинкиназ приводит к уменьшению сродства связи этой субъединицы с каталитической субъединицей фермента (см. главу 4). Это обусловливает диссоциацию обеих белковых субъединиц фермента. Каталитическая субъединица, освободившись из-под ингибиторного действия регуляторной субъединицы, активируется и катализирует фосфорилирование белков. Фосфорилирование изменяет свойства определенных белков, что сказывается на процессах, находящихся под контролем цАМФ. Взаимодействие стероидных гормонов со своими рецепторами вызывает в последних такие конформационные изменения, которые придают им способность связываться с клеточным ядром (см. главу 4). Это взаимодействие изменяет и другие свойства рецепторов, важные для опосредования эффекта стероидных гормонов на транскрипцию определенных видов мРНК. Для того чтобы обладать столь специализированными и высокоспецифическими функциями, белки в результате эволюции генов, определяющих их аминокислотную последовательность, должны были приобрести ту структуру, которую они имеют в настоящее время. В некоторых случаях в процессе принимают участие и другие гены, кодирующие синтез продуктов, модифицирующих сами регуляторные белки (например, путем гликозилирования). Поскольку эволюция генов, по-видимому, происходила за счет таких механизмов, как мутация предсуществующих генов и рекомбинация участков различных генов (о чем говорилось), это наложило определенные ограничения на эволюцию белка. С эволюционной точки зрения, вероятно, было бы проще видоизменить присутствующие структуры, чем создавать совершенно новые гены. В связи с этим существование некоторой гомологии в аминокислотных последовательностях различных белков может и не быть неожиданностью, так как их гены могли возникнуть вследствие эволюции общих предшественников. Поскольку, как отмечалось выше, участки белков, приспособленные для связывания регуляторных лигандов, таких, как цАМФ и стероиды или их аналоги, уже должны были существовать ко времени появления этих лигандов, легко представить себе, как модификация генов таких белков может привести к синтезу других белков, сохраняющих высокую специфичность связывания регуляторного лиганда. На рис. 2—2 приведена одна из гипотетических схем эволюции примитивной глюкотрансферазы в три существующие типа регуляторных белков: бактериальный цАМФ-связывающий белок (CAP или CRP), регулирующий транскрипцию нескольких генов, кодирующих ферменты, которые принимают участие в метаболизме лактозы [4], а также цАМФ-связывающий белок млекопитающих, который регулирует активность цАМФ-зависимой протеинкиназы, опосредующей действие цАМФ у человека (см. главу 4), и аденилатциклазу (см. главу 4). Применительно к бактериальному белку и киназе АТФ-связывающие участки примитивной глюкокиназы эволюционировали в направлении приобретения большей специфичности связывания цАМФ. Бактериальный белок приобрел также дополнительную полинуклеотид (ДНК)-связывающую способность. Эволюция киназы предполагает приобретение глюкофосфотрансферазной способности фосфорилировать белки. Наконец, из глюкокиназы путем замены АДФ-генерирующей функции на цАМФ-генерирующую могла бы образоваться и аденилатциклаза. Эти заключения не могут не быть сугубо гипотетическими; тем не менее они показывают, как могла осуществляться молекулярная эволюция перечисленных регуляторных белков.
Рис. 2—2. Предположительное происхождение цАМФ-зависимой протеинкиназы, аденилатциклазы и бактериального цАМФ-связывающего регуляторного белка (Baxter, MacLeod [4]).
Хотя многие детали в картине эволюции белков отсутствуют, имеющиеся в настоящее время сведения о структуре белков и генов дают некоторые основания для анализа вопроса о том, произошли ли гены некоторых полипептидных гормонов из общего гена-предшественника [5]. Отдельные полипептидные гормоны можно сгруппировать по структурному сходству. Нет ничего удивительного в том, что гормоны, относящиеся к одной группе, могут обладать и сходством вызываемых ими физиологических эффектов, а также сходным механизмом действия. Так, гормон роста (СТГ), пролактин и хорионический соматомаммотропин (плацентарный лактоген) характеризуются высокой степенью гомологии аминокислотной последовательности. Гликопротеидные гормоны — тиротропный гормон (ТТГ), хорионический гонадотропин человека (ХГЧ), фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны — состоят из двух субъединиц, каждый, одна из которых (А-цепь) идентична или почти идентична у всех гормонов данной группы [4]. Аминокислотная последовательность субъединиц В в различных гормонах, хотя и не идентична, но имеет структурную гомологию. Вероятно, именно эти различия В-цепей имеют решающее значение для придания специфичности взаимодействию каждого гормона с его тканью-мишенью. Инсулин обнаруживает некоторые структурные аналоги и обладает общей биологической активностью с другими факторами роста, такими, как соматомедин и неподавляемая инсулиноподобная активность (НИПА) [6]. Что касается группы гормонов, к которой принадлежит гормон роста, то нуклеотидная последовательность мРНК, кодирующих их синтез, частично выяснена [5]. Для каждой аминокислоты необходимы три нуклеотида в ДНК (и, следовательно, в транскрибируемой с нее мРНК). Хотя данному триплету нуклеотидов; (кодон) соответствует именно данная аминокислота, для одной и той же аминокислоты могут существовать несколько кодонов. Такая «вырожденность» генетического кода обусловливает возможность большей или меньшей гомологии нуклеотидных последовательностей двух данных генов, определяющих структуру двух гормонов, чем имеется в белках. Так, если два белка обладают случайной гомологией аминокислотной последовательности, то последовательности нуклеиновых кислот могли бы обнаруживать большие различия. Однако в отношении генов, кодирующих синтез гормонов группы соматотропина, это не так; гомология последовательности нуклеиновых кислот выше, чем гомология аминокислотной последовательности [5]. Гормон роста человека и хорионический соматомаммотропин, которые имеют 87% гомологию аминокислотных последовательностей, в своих мРНК имеют 93% гомологию последовательностей нуклеиновых кислот. Гормоны роста человека и крысы обладают 70% гомологией аминокислотных последовательностей, а их мРНК обнаруживают 75% гомологию последовательности нуклеиновых кислот. В некоторых участках мРНК гормона роста крысы и хорионического соматомаммотропина человека (мРНК двух разных гормонов у двух биологических видов) гомология составляет 85% (рис. 2—3). Таким образом, лишь минимальные изменения оснований в ДНК обусловливают различия гормонов. Следовательно, эти данные подтверждают заключение о том, что гены таких гормонов образовались в ходе эволюции из общего предшественника. С позиций изложенных представлений о символах и вызываемых ими реакциях существенно, что каждый из трех гормонов данной группы обладает влиянием на рост (см. далее). Гормон роста представляет собой фактор, определяющий линейный рост. Пролактин играет важную роль в процессах лактации и тем самым обеспечивает рост новорожденного. Хорионический соматомаммотропин, хотя его физиологическое значение точно не установлено, может оказывать существенное влияние на внутриутробный рост, направляя поступающие в организм матери пищевые вещества на рост плода [7].
Рис. 2—3. Гомология аминокислотных (АК) последовательностей в гормоне роста крысы (ГРК) и хорионическом соматомаммотропине человека (плацентарный лактоген человека, ПЛЧ) и последовательностей нуклеиновых кислот в матричных РНК, кодирующих синтез этих двух гормонов. Названия аминокислот даны в сокращении, равно как и названия нуклеиновых кислот. Показана область, соответствующая аминокислотной последовательности 134—149. Негомологичные нуклеиновые и аминокислоты подчеркнуты (Baxter и сотр. [5]). У — уридин, Ц — цитозин, А — аденозин, Г — гуанозин.
Дата добавления: 2015-02-05 | Просмотры: 1123 | Нарушение авторских прав |