|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
РЕЦЕПТОРЫ ПЕПТИДНЫХ ГОРМОНОВ ОПРЕДЕЛЕНИЯ И ОБЩИЕ ЗАМЕЧАНИЯПептидные гормоны и молекулы трансмиттеров оказывают свое действие на клетки-мишени, связываясь прежде всего со специфическими, обладающими высоким сродством, рецепторными участками на плазматической мембране. Существование таких рецепторов обнаружено прямыми исследованиями по связыванию радиоактивных лигандов в огромном числе клеток-мишеней пептидных гормонов и нейротрансмиттеров. В некоторых тканях насыщенность специфических связывающих мест меченым гормоном коррелирует с активацией характерных для клеток-мишеней реакций, что указывает на биологическую значимость таких мест в качестве рецепторов гормонов. В других тканях пептидные рецепторы идентифицированы условно только по высокому сродству и специфичности связывания биологически активных форм гормональных гомологов. Применение конкурентных антагонистов (если они существуют), блокирующих как связывание гормона, так и последующую реакцию клетки-мишени, позволило получить дополнительные доказательства биологической значимости нескольких гормональных рецепторов. Некоторые рецепторные места, например для ацетилхолина и катехоламинов, охарактеризованы с помощью меченых антагонистов. Относительно низкое сродство ацетилхолиновых рецепторов к холинергическим лигандам или низкая концентрация специфических b-адренергических мест на клетках-мишенях создают трудности для характеристики этих рецепторов путем исследований с применением меченых агонистов.
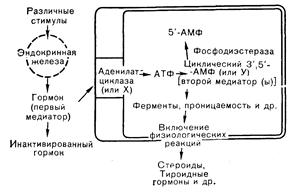
Рис. 4—2. Концепция, предложенная Sutherland, согласно которой гормону отводят роль первого медиатора, а цАМФ (или другим веществам) — второго (внутриклеточного) медиатора, с помощью которого осуществляется действие пептидных гормонов (Sutherland, Robison [4] в модификации).
Мнение о клеточной мембране как о месте действия пептидных гормонов сформировалось на основании наблюдений Sutherland, согласно которым взаимодействие катехоламинов с плазматической мембраной эритроцитов голубя приводит к активации аденилатциклазы [4]. После этого было показано, что многие пептидные гормоны связываются с рецепторами плазматической мембраны и влияют на локализованную в ней активность, такие, как аденилатциклаза или механизмы ионного транспорта (рис. 4—2). О поверхностной локализации рецепторов пептидных гормонов свидетельствует и тот факт, что кратковременное воздействие гормона вызывает длительную реакцию клеток-мишеней, которую можно отнести за счет связанного гормона, а также способность специфических антисывороток быстро прекращать действие пептидных гормонов in vitro. Известно также, что ферменты или другие агенты, влияющие на мембранные белки и липиды, модифицируют или ликвидируют способность пептидных гормонов стимулировать аденилатциклазу. Наиболее веские доказательства локализации рецепторов пептидных гормонов на плазматической мембране были получены в авторадиографических исследованиях и прямых опытах по связыванию меченых биологически активных гормонов с препаратами мембран или интактными клетками. Эти подходы позволили точно выяснить локализацию и параметры связывания клеточных рецепторных участков, а также их функциональную связь с реакциями клетки-мишени. Способность пептидных гормонов взаимодействовать с клетками-мишенями (или наоборот) должна зависеть от присутствия специфических участков связывания на плазматической мембране (рецепторов), которые извлекают несущие информацию молекулы из внеклеточной жидкости. Так, «осведомленность» клеток пучковой зоны коры надпочечников в отношении гипофизарных регулирующих влияний определяется концентрацией и профилем секреции АКТГ, поступающего к надпочечным железам. Чрезвычайно низкие концентрации (около 10~10 M) гипофизарных гормонов в крови при миллионнократном избытке других белков требуют, чтобы рецепторы клеток-мишеней обладали как высокой специфичностью (позволяющей узнавать гормон), так и высоким сродством к гормону (позволяющим связывать его при низкой концентрации). Хорошо изученный класс рецепторов для «традиционных» пептидных гормонов (таких, как тропные пептиды гипофиза и гормоны желудочно-кишечного тракта) пополнился аналогичными участками для местных и дистантных трансмиттерных молекул (таких, как ацетилхолин, катехоламины и простагландины), а позднее и для группы, состоящей примерно из 20 нейропептидов (как ранее известных, так и недавно обнаруженных), которые регулируют, по-видимому, функцию периферической и центральной нервной системы. Это огромное число «пептидных» гормонов характеризуется высоким зарядом и относительной гидрофильностью, отсутствием значительного связывания с белками плазмы и способностью связываться со специфическими распознающими участками на открытой области рецепторных молекул. встроенных в плазматическую мембрану клеток-мишеней. Считают, что другая специализированная область внутренней, ассоциированной с мембраной, части рецепторов пептидных гормонов взаимодействует с внутримембранной частью эффекторных молекул или ферментов, таких, как аденилатциклаза, чей каталитический домен доступен с внутренней, цитоплазматической, поверхности клеточной мембраны. Хотя в настоящее время известно, что многие пептидные гормоны после связывания с поверхностными рецепторами все же проникают в клетку, первоначальное взаимодействие с наружной поверхностью плазматической мембраны является необходимым условием стимуляции реакций клеток-мишеней, поскольку внутриклеточное введение пептидных гормонов не вызывает характерных реакций таких клеток. За связыванием гормона с поверхностным рецептором наступает активация одной или более мембранных эффекторных систем, определяющая изменения в механизмах транспорта и распределения ионов, а также активацию цитоплазматических процессов, которые регулируют функцию клетки-мишени. Многие из этих этапов активации включают, по-видимому, фосфорилирование мембранных или цитоплазматических белков, что приводит к изменению ферментативных функций, ответственных за транспорт пли метаболизм молекул, играющих важную роль в клеточной активности. Главным мембранным ферментом, регулируемым пептидными гормонами, является аденилатциклаза, катализирующая образование цАМФ, необходимого для процессов фосфорилирования, возникающих при стимуляции клетки-мишени. К другим мембранным ферментам, на активность которых влияет гормон-рецепторное взаимодействие, относятся ферменты, участвующие в кругообороте инозитола, метилтрансферазы, принимающие участие в метилировании фосфолипидов, а также фосфолипазы, ответственные за деацилирование мембранных фосфолипидов. Последний процесс служит источником образования предшественников (таких, как арахидоновая кислота) простагландинов, тромбоксанов, простациклинов и других активных метаболитов. Наблюдались также гормональные влияния на Na+, К+-зависимую АТФазу, связанную с мембраной протеинкиназу и катехол-О-метилтрансферазу. Таким образом, на уровне плазматической мембраны гормоны индуцируют множество процессов, участвующих в интегрированных реакциях клеток-мишеней на активацию рецепторов гомологичным лигандом. Дата добавления: 2015-02-05 | Просмотры: 1014 | Нарушение авторских прав |