 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Нейропептиды
'>тн нейротранемнттсры имеются но всех отделах нервной системы. Нейропептиды часто высвобождаются вместе с другими нейротрансмиттерамн. Известно много их видов. Они действуют, как обычные нейротрансмиттеры, или же выполняют роль нейромодуляторов (например, в болевой рецепции; см. главы 21 и 22). ГЛАВА 10. Структура скелетной мышцы
Поперечный срез мышечного волокна
Волокна, пронизанные 6 тонкими филаментамн. окружающими толстый филамект Триада А/1-соединения:
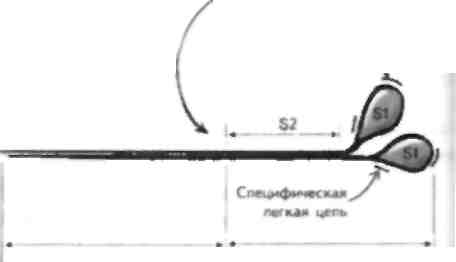
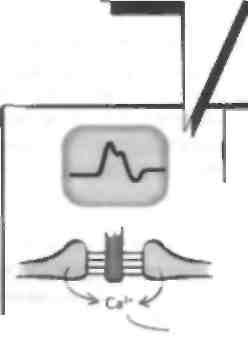
терминальными цистернами Одна из петель филаментной спирали Скелетная мышца отвечает за преобразование электрического импул!.са, который прибывает к нервно-мышечному соединению (II МС"), в механическую силу посредством сокращения. Возникновение потенциала действия приводит к высвобождению ацетилхолина (Лцх), который активирует никотиновый АЦХ-рсцептор (Лцх1') на постеннаптической мышце, что вспою очередь вызывает деполяризацию мышечного волокна (см. главу 7). Это приводит к притоку кальпия в мышечное волокно, а затем к мышечному сокращению. Структура скелетной мышцы Скелетная мышца состоит из группы мышечных волокон — длинных многоядерных клеток. Эти во- цокна содержа! миофнбриллы, которые В СВОЮ ОЧе | редь состоят из толстых и тонких филаментов, до] некотором cieiieiiii прплающих Minimi- полосатый вне...... ий вид. Миофнбриллы окружает сарколемма,! которая ннвагинирует в миофнбриллы в виде поперечных, или T-тубул. Эта структура отделена от саркоплазматического ретикулума (СР). который покрывает миофнбриллы и принимает участие в хранении пну ipiiK ie-ючных taiiacon ка н.ция. С'арко |смма ЯВ лястся сложной структурой, и нарушения структуры некоторых ее мембранных компонентов, как было установлено недавно, лежат в основе развития некоторых форм наследственных миодистрофий. Толстый филамент состоит из миозина и лежит в цент lie саркомера. Миозин состоит из двух цепей, ко- торые представлены легким (Л ММ) и шжсмыч (ТММ) меромиозшюм. ТММ-порция содержит субфрагмен-ты S1 и S2. Субфрагмент S1 состоит из двух головок и двух связанных с этими головками цепей. Легкая цепь находится на конце головки субфрагмента S1, она называется несиецифической и отвечает за разложение АТФ в завершение толчка, приводящего к формированию перекрестного мостика. Вторая легкая цепь называется специфической, она прикрепляется к головке субфрагмента S1 в том месте, где та выступает в сторону актина, и принимает участие в процессе движения головки миозина. Благодаря свойствам ЛММ миозиновые филаменты упаковываются спонтанно так, что головки S1 выстоят в направлении ак-тиновыхфиламентов. Таким образом, головка S1 формирует главную часть перекрестного мостика с актином. Тонкие филаменты состоят из F-актина, тропомио-зива и тропонина, которые в свою очередь содержат 3 субъединицы (тропонип I, С и Т). Эти 3 компонента тропонинового комплекса выполняют различные функции, но в целом регулируют мышечное сокращение, удерживая тропомиозин в положении, которое физически блокирует головку S1 миозина отсвязывания с актином. Деполяризация мышцы при-зодитк притоку кальция, который связывается с тро-ПОНИНОМ, И копформациопиым изменениям тонко-то филамента, так что тропомиозин сдвигает место связывания миозина и актина. Так, тропомиозин и тропонип регулирую! мышечное сокращение при помощи блока. В некоторых мышцах животных рефляция взаимодействия актина и миозина происходит при помощи миозинассоциированпых легких ценен. В точке перекрытия этих двух наборов филамсн-тов находится триадиая структура Т-тубулы, которая связана с двумя терминальными цистернами СР с помощью отростков. Нарушения структурных белков скелетной мышцы при миодистрофиях Существует много первичных заболеваний mi,................ 1, при которых в результате генетических мутация ионных каналов нарушается возбудимость мышц (см. главу 5), а также возникает их воспаление (см. главу 54). Кроме того, известны нарушения структурных белков самой мышцы. Эти нарушения лежат в основе развития некоторых наследственных миодистрофий, из которых наиболее изученными являются миоднетрофия Дюшенна (МДД) и конечностно-поясные миодистрофий (КПМД). МДД - это Х-сцепленное заболевание, при котором отмечается делеция гена, кодирующего структурный белок дистрофии, при этом известна более легкая форма 5аболевания — миодистрофия Бек-кера, при которой количество этого белка уменьшено. МДД проявляется в раннем детском возрасте нарушениями ходьбы и атрофией проксимальной мускулатуры конечностей с псевдогипертрофия -ми икроножных мышц. По мере прогрессирования болезни инвалидность утяжеляется. Развиваются кардиомиопатия и другие нарушения, приводящие к смерти пациентов обычно на 3-м десятилетии жизни. Характерно повышение содержания креатинфосфокиназы (маркер миолиза) у ЭТИХ больных, поскольку в отсутствие дистрофина происходи! некроз мышечных волокон. Этот белок залегает под сарколеммой как скелетной, так и гладкой или сердечной мышцы и обеспечивает стабильность и гибкосн, мышечной мембраны. При отсутствии его мембрана легко разрывается, что приво-д1П к прнтск) большого количества ионов кальция и некрозу мышечных волокон в результате активации протеаз. КПМД в противоположность МДД могут начинаться в любом возрасте и сопровождаться слабостью проксимальных мыши с повышением содержания креатинфосфокиназы. Эта болезнь наследуется по различным типам, недавно показано, что при аутосомно-рсцессивном тис наследования отмечаются нарушения структуры тли ко протеинов. связанных с дистрофином, адхалина и саркоглика-нового комплекса. 'Оти белки связываю! внутриклеточный дистрофии с компонентами внеклеточной жидкости и важны для поддержания целостности сарколеммы. ГЛАВА 11. Сокращение скелетной мышцы
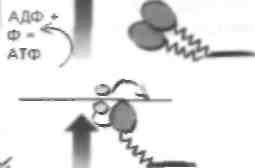
Тонкий филамент Эта часть молекулы миозина может растягиваться и развивать напряжение. которое преобразуется
* движение филамента Mfc Третья с г ад и я: генерация напряжения н разрыв мостика Для разрыва мостика требуется
Актиновый филамент подтягивается к центру пучка А с помощью связывания и ротации
\з+ «d fAj ■ Актин Т - Тропомиозии-тропониновый
Возникновение потенциала действия в НМС прикопит к притоку кальция и высвобождению везикул Лцх. Он связывается с никотиновыми ЛцхР на мышечном волокне, что вызывает' его деполяризацию и приток кальция из сакроилазматического рстаку-лума (СР) в мышцу. Это приводит к удалению комплекса калыдийсвязывающего белка тропомиозина и i|khkhimm:i hi iiK'iiiiiii oenoiiiioi'o компонента ТОННОГО филамента. Удаление блока иозволяс! миозину основному компоненту толстого филамента — связаться с актином посредством перекрестного мостика. Волокна перемещаются навстречу друг другу. Перекрестный мостик между двумя волокнами устраняется, и в завершение этого толчка происходит гидролиз АТФ. Никл формирования перекрестного мостика и его устранения может повторяться. В целом этот процесс объясняется гипотезой мышечного сокращения но механизму скольжения филаментов. Последовательность событий при сокращении мышцы такова: • Первая стадия. В состоянии покоя тропонино-вый комплекс удерживает тропомиозии в таком положении, чтобы миозин не связывался с актином (блок). • Вторая стадия. Возникновение потенциала действия в II М(приводи! к инициа постен наитического потенциала действия, который распространяется по специальной инвагинации мышечной мембраны, называемой поперечной, или Т-тубулой. Эта Т-тубула проводит потенциал действия к мышце, и все мышечные волокна активируются. Она прилежит к терминальной цистерне СР, называемой триадой, т.е. Т-тубула залегает между двумя терминальными цистернами СР (мышечный эквивалент эндоплазматического ретикулума), содержаще- го высокие концентрации ионов кальция. Т-ту-булы связаны с СР отростками, которые являются частью ионного канала для кальция. Возникновение потенциала действия к триаде приводит к высвобождению кальция из терминальных цистерн посредством механического слияния. Потенциал действия открывает общий кальциевый канал между Т-тубулами и СР, что позволяет кальцию войти, согласно электрохимическому градиенту, в миофибриллы. Затем кальций связывается с тропониновым комплексом, это приводит к перестройке тропомиози-на таким образом, что головка миозина становится способной связаться с актином, формируя перекрестный мостик. • Третья стадия. После связывания актина и миозина сокращению перекрестного мостика предшествует пауза. Актин подтягивается за миозином, что приводит к сокращению мышцы. После этого толчка перекрестный мостик отделяет миозин от актина с помошью гидролиза АТФ, что является также кальцийзависи-мым процессом. Затем весь цикл может повторяться. Процесс формирования перекрестного мостика и движения филаментов называется мышечным сокращением по механизму скольжения филаментов. Два филамента перемещаются параллельно друг другу, когла никл повторяется. Из терминальных цистерн СР высвобождается кальций, обеспечивающий процесс формирования перекрестного мостика и его устранения, который затем удаляется обратно в эту структуру с помощью кальциевого насоса. Дата добавления: 2015-02-06 | Просмотры: 1141 | Нарушение авторских прав |
 Поперечная (Т) тубула.
Поперечная (Т) тубула.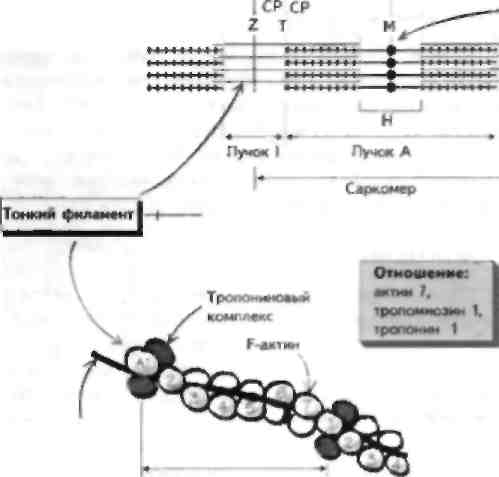 T-тубула между двумя
T-тубула между двумя

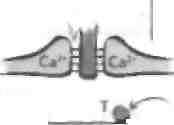

 АТФ
АТФ