|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Опухоли печени 1 страница
12.8.1. Доброкачественные опухоли К данной группе заболеваний относят опухоли эпителиального (гепато-мы и холангиогепатомы), мезенхимального (гемангиомы, лимфангиомы, фибромы и т. п.) происхождения и смешанные опухоли (гамартомы). Из них наиболее часто встречаются гемангиомы. Гемангиомы могут быть одиночными и множественными (10 %), сочетаться с гемангиомами других органов, чаще имеют кавернозную структуру. По происхождению их относят к врожденным заболеваниям. Описаны семейные случаи болезни, женщины страдают в 5—7 раз чаще мужчин. При микроскопическом исследовании обнаруживают богатую сеть сосудистых
лакун с тонкими соединительнотканными перегородками. В редких случаях ге-мангиомы могут достигать значительных размеров, занимая правую или левую долю печени.
Клиническая картина и диагностика. Гемангиомы небольших размеров (менее 5—8 см в диаметре) обычно бессимптомны. Заболевание обычно проявляется на четвертом-пятом десятилетии жизни при достижении опухолью значительных размеров. Для всех доброкачественных опухолей типичны тупые ноющие боли в правом подреберье, реже — симптомы сдавления внутренних органов (желудка, двенадцатиперстной кишки). У ряда больных появляются обгура-ционная желтуха и признаки портальной гипертензии за счет сдавления увеличивающейся в объеме опухолью магистральных желчных протоков и внутрипеченочных ветвей воротной вены (рис. 12.5). При объективном исследовании больных с крупными гемангиомами и другими опухолями выявляют гепатомегалию, значительно реже можно про-пальпировать и опухоль, спадающуюся при пальпации, иногда над зоной проекции гемангиомы выслушивают систолический шум. При гигантских геман-гиомах может развиться сердечная недостаточность, обусловленная массивным сбросом крови через артериовенозные анастомозы данной опухоли. Среди инструментальных способов исследования наиболее информативны компьютерная томография, при которой обнаруживается богатая жидкостью многокамерная опухоль; целиакография; ультразвуковое исследование; лапароскопия. Возможно развитие таких осложнений, как разрыв гемангиомы с про-фузным (зачастую смертельным) внутрибрюшным кровотечением; тромбоз сосудов, питающих опухоль, с последующим некрозом (реже абсцедирова-нием) опухоли; редко — малигнизация. Лечение. При небольших (менее 5 см) гемангиомах хирургическое лечение не показано, необходимо динамическое наблюдение. Крупные гемангиомы, угрожающие развитием осложнений, целесообразно удалять — применяют резекцию печени, объем которой определяется величиной гемангиомы, или так называемую околоопухолевую резекцию (по сути энуклеацию гемангиомы). Гепатоаденома (развивающаяся из гепатоцитов) и холангиогепатома (развивающаяся из эпителия желчных протоков) встречаются редко, протекают, как правило, бессимптомно. Клинические проявления болезни возникают лишь при опухоли больших размеров, при кровотечении или при перекруте опухоли, расположенной на ножке, в связи с некрозом узла. Основные способы диагностики — ультразвуковое исследование и компьютерная томография. Гепатомы иногда малигнизируются, поэтому целесообразно их удалять (энуклеация, клиновидная резекция печени). Холангиогепатомы не склонны к малигнизации; при небольших размерах опухоли и отсутствии клинических проявлений их удаление не обязательно. Другие доброкачественные опухоли печени мезенхимального и смешанного происхождения встречаются исключительно редко.
Рак печени. Первичный рак печени является относительно редким заболеванием в странах Европы и Северной Америки, в то время как в странах Юго-Восточной Азии, Центральной и Южной Африки он встречается в десятки и сотни раз чаще, занимая в некоторых регионах первое место в структуре всех онкологических заболеваний. 13 России первичный рак печени наиболее часто наблюдается в некоторых областях Западной Сибири (Тюменская, Омская) и Дальнего Востока (Приморский край). По данным ВОЗ, ежегодно от рака печени погибает около 750 000 человек. В последние десятилетия отмечена отчетливая тенденция к увеличению заболеваемости. В абсолютном большинстве случаев рак развивается на фоне предшествующих хронических заболеваний печени (цирроз, гемохроматоз, амебиаз, шистосоматоз, описторхоз), наиболее частая причина — цирроз печени, выявляемый у 60—70 % больных с первичным раком печени. В нашей стране частой причиной рака печени, кроме цирроза, являются паразитарные заболевания печени (описторхоз) в эндемичных районах. Патологоанатомическая картина. Макроскопически рак имеет вид плотного белесоватого узла, при этом более чем у IS % больных выявляют дополнительные раковые узлы больших или меньших размеров в предлежащих отделах печени и даже в другой доле (метастазирование рака в паренхиму печени). При милиарной форме определяют множественные мелкие раковые узлы, поражающие правую и левую доли печени. Гистологически различают гепатоцеллюлярный рак, развивающийся из гепатоцитов, и холангиоцеллюлярный рак, развивающийся из эпителия внутрипеченочных желчных протоков. Гепатоцеллюлярный рак наблюдается в 4 раза чаще, чем холангиоцеллюлярный. Клиническая картина и диагностика. На ранних стадиях клинические проявления заболевания отсутствуют или весьма скудны, преобладают общие симптомы онкологического заболевания: слабость, похудание, снижение работоспособности, утомляемость, анорексия, психическая депрессия. В более поздних стадиях больные отмечают тупые боли в правом подреберье, гипертермию. У 30 % из них выявляют гепатомегалию, реже — опухолевый узел или плотный бугристый нижний край печени. К поздним симптомам относят асцит и обтурационную желтуху, возникающие за счет сдав-ления опухолью внутрипеченочных ветвей воротной вены и магистральных желчных протоков. Быстрое прогрессирование симптомов болезни, ухудшение общего состояния пациентов с циррозом печени указывают на развитие цирроза—рака печени. Большинство инструментальных методов исследования выявляют косвенные признаки ракового процесса, характерные для объемного образования. Морфологическое подтверждение диагноза можно получить при лапароскопии с прицельной биопсией опухолевого узла, а также при пункции опухоли под контролем ультразвукового исследования или компьютерной томографии. У больных гепатоцеллюлярным раком, кроме того, в крови определяют фетопротеин (эмбриональный белок) в довольно высокой концентрации. Осложнения. Наиболее часто возникают разрыв опухолевого узла с кровотечением в брюшную полость, распад опухоли с ее инфицироваием и абсцедированием, механическая желтуха, гнойный холангит. Желтуха и асцит, выявляемые почти у половины больных, свидетельствуют о поздней стадии заболевания, когда шансы на успех от лечения минимальны. Лечение. Радикальная операция выполнима лишь у 15—20 % больных. В зависимости от размеров опухоли и ее локализации проводят сегментэк-томию, лобэктомию или гемигепатэктомию. Летальность при этих операциях — 10—20 %. Целесообразно сочетать резекцию печени с последующей химиотерапией. Наилучшего эффекта добиваются при введении химиотера-певтических препаратов в печеночную артерию или пупочную вену. Пятилетняя выживаемость составляет около 10%. В последние годы в хирургическом лечении рака печени используют гепатэктомию с последующей трансплантацией печени. Правда, отдаленные результаты при пересадке печени у больных с первичным раком этого органа весьма скромные. Прогноз. Обычно прогноз заболевания неблагоприятный. Лишь у незначительной части больных удается достичь излечения или сколько-нибудь значительного продления жизни. Саркома, меланома встречаются исключительно редко и не имеют специфической клинической картины. Способы инструментальной диагностики такие же, как и при первичном раке печени. Вторичные опухоли печени являются метастазами злокачественных опухолей, локализующихся в других органах: желудке, поджелудочной железе, толстой кишке, легких и т. п. Более чем у половины больных раком органов пищеварительного тракта на вскрытии обнаруживают метастазы в печень. Среди клинических проявлений заболевания ведущее место занимают симптомы первичного ракового процесса в том или ином органе грудной или брюшной полости. Данные физикального обследования и инструментальных методов исследования такие же, как и при первичном раке печени. При множественных метастазах в печень выполнение радикального оперативного вмешательства по поводу первичной опухоли нецелесообразно. Тем не менее при солитарных метастазах рекомендуется удалять первичную опухоль, произведя резекцию печени. Это позволяет продлить жизнь пациентам, особенно при метастазировании опухолей толстой кишки. В этих случаях пятилетняя выживаемость после комбинированных операций достигает 20-25 %. 12.9. Синдром портальной гипертензии Как уже было отмечено выше, воротная вена формируется путем слияния верхней брыжеечной, нижней брыжеечной, селезеночной и левой желудочной вен. В паренхиме печени, а именно в синусоидных капиллярах, происходит смешивание артериальной крови из системы собственной печеночной артерии и портальной крови. К мембранам синусоидных капилляров предлежат гепатоциты. Именно здесь происходит основной обмен веществ между притекающей кровью и печеночными клетками. Из синусоидов по центральным венам кровь оттекает в печеночные вены и далее в нижнюю полую вену. Степень кровенаполнения печени и кровоток по синусоидным капиллярам регулируются входными и выходными сфинктерами. Первые из них расположены у места впадения артсриол и портальных венул в синусоиды, вторые — в месте впадения синусоидных капилляров в центральные вены и зоне перехода центральных иен в междольковые. Их координированное сокращение позволяет адаптировать внутрипеченочный кровоток к функциональной активности органов пищеварительной системы. Дополнительным регуляторным фактором является сокращение мышечной оболочки внутрипеченочных арте-риол. Гемодинамика в печени зависит прежде всего от градиента давления в артериальной, портальной системе и системе печеночных и полой вен. В норме давление в собственной печеночной артерии составляет около 120 мм рт.ст., в воротной вене — 5—10 мм рт.ст., в печеночных венах и нижней полой вене 2—5 мм рт.ст. Именно столь выраженная разность в кровяном давлении и обеспечивает печеночную перфузию. Средняя линейная скорость кровотока з воротной вене составляет около 15 см/с. При некоторых видах синдрома портальной гипер-гензии она существенно уменьшается. Выделяют три основные зоны, где имеются анастомозы между портальной и канальной:истемами (портокавальные анастомозы). 1. Область верхней трети желудка и абдоминального отдела пищевода. В норме от желудка кровь через левую желудочную и короткие желудочные вены оттекает в воротную вену, от абдоминального отдела пищевода через непарную и полунепарную вены — в верхнюю полую вену. 2. Зона дистальной части прямой кишки. От ее проксимальных отделов по верхней прямо 3. Область передней брюшной стенки. По пупочной вене (если ее проходимость сохранена) При значительном повышении давления в воротной вене и ее притоках происходит расширение указанных портокавальных анастомозов, что в известной мере и обусловливает клиническую картину заболевания. Портальная гипертензия является синдромом, характеризующимся рядом специфических проявлений и возникающим при некоторых врожденных и приобретенных заболеваниях внутренних органов, которые приводят к нарушению оттока крови из воротной вены и ее ветвей. Этиология и патогенез. В зависимости от уровня, на котором образуется препятствие (блок) для оттока крови по системе воротной вены, различают четыре формы портальной гипертензии: предпеченочную (допеченочную), внутрипеченочную, надпеченочную и смешанную. Предпеченочную (допеченочную) форму портальной гипертензии принято разделять на первичную, связанную с автономной (наиболее часто врожденной или постнатальной) патологией сосудов портальной системы, и вторичную, вызванную сдавлением этих сосудов извне. Среди врожденных причин синдрома наиболее частыми являются аплазия, гипоплазия, кавернозная трансформация и атрезия воротной вены. Обычно атрезия обусловлена распространением физиологического процесса постнатальной облитерации пупочной вены и венозного (аранциевого) протока на воротную вену. Приобретенный тромбоз воротной вены чаще всего возникает при острых воспалительных заболеваниях органов брюшной полости — остром деструктивном аппендиците, холецистите, гнойном холангите, панкреатите и др. Сдавление и вторичный тромбоз воротной и селезеночной вен могут вызывать кисты, крупные доброкачественные и злокачественные опухоли поджелудочной железы. Внутрипеченочная форма (до 80—90 % всех случаев портальной гипертензии) наиболее часто обусловлена циррозом печени той или иной этиологии. Значительно реже причинами развития внутрипеченочной портальной гипертензии являются злокачественные новообразования печени, шистосоматоз, эхинококкоз и врожденный фиброз печени. Надпеченочная форма встречается редко. Она может быть обусловлена болезнью Киари или синдромом Бадда—Киари. Болезнь Киари — эндофлебит печеночных вен с последующим их тромбозом, синдром Бадда—Киари — сдавление, или окклюзия, нижней полой вены на уровне или выше впадения в нее печеночных вен. Синдром может быть обусловлен наличием соединительнотканных мембран в просвете полой вены или ее сдавлением извне опухолями, кистами, рубцами и т. п. Значительно реже выраженное повышение давления в печеночных венах развивается при конст-риктивном перикардите, недостаточности правого предсердно-желудочко-вого клапана с декомпенсацией кровообращения. В этих случаях при длительном течении заболевания развивается так называемый сердечный цирроз печени с последующим присоединением внутрипеченочного блока портального кровообращения. Смешанная форма портальной гипертензии обычно развивается при сочетании внутрипеченочного и допеченочного блоков портального кровообращения (тромбоз воротной вены на фоне цирроза печени), что су- щественно ограничивает возможности ее оперативной коррекции и ухудшает прогноз болезни. Особый вид портальной гипертензии без наличия препятствия для оттока крови из воротной ьены возникает при увеличении гепатопетальной циркуляции крови при существовании артериовенозного свища на любом уровне воротной вены или ее притоков. Чаще всего свищ локализуется на уровне селезеночных сосудов и формируется в результате деструкции стенки аневризмы селезеночной артерии и прилежащей к ней селезеночной вены. Патогенез портальной гипертензии весьма сложен и до конца еще не изучен, причем при разных формах синдрома он имеет свои особенности. При внутрипеченочной форме выраженное изменение морфологического строения печени вызывает значительную перестройку ее ангиоархитекто-ники, что приводит к повышению сопротивления оттоку крови из воротной вены. При этом формируются прямые портопеченочные анастомозы, обеспечивающие частичный сброс крови из воротной вены и печеночной артерии в систему печеночных вен. Это приводит к ишемии печеночной паренхимы и нарушению метаболизма в гепатоцитах, нарушению дезинтоксика-ционной функции печени. Клинически это может проявляться энцефалопатией. За счет повышения давления в системе воротной вены начинают функционировать естественные портокавальные анастомозы. Клинически значимыми являются анастомозы в области проксимального отдела желудка и дистального отдела пищевода, где возникает варикозное расширение вен и откуда наиболее часто наблюдается кровотечение при их разрыве. Значительно реже наблюдается расширение геморроидальных и подкожных вен в области передней брюшной стенки. В связи со спазмом и значительным сопротивлением кровотоку по системе печеночной артерии возникает перераспределение его в системе чревного ствола, что приводит к увеличению объемного кровотока по селезеночной артерии. В сочетании с затруднением оттока крови по селезеночной вене это влечет за собой развитие спленомегалии, а при гиперплазии ретику-лоэндотелиальной ткани — гиперспленизма (уменьшение числа эритроцитов, лейкоцитов и тромбоцитов в крови). В развитии асцита при внутрипеченочной форме синдрома принимает участие ряд факторов: повышение лимфообразования в печени (вследствие внутрипеченочного венозного стаза), снижение онкотического давления крови за счет гипоальбуминемии, нарушения водно-электролитного баланса, замедление инактивации альдо-стерона и антидиуретического гормона в функционально неполноценной печени. При предпеченочной (допеченочной) форме синдрома отмечают уменьшение портального кровоснабжения печени, расширение селезеночной артерии, значительное повышение давления в селезеночной вене и селезенке, что и является причиной развития спленомегалии, а у некоторых больных и гиперспленизма. Указанные гемодинамические сдвиги приводят к формированию портопортальных анастомозов. При этом кровоток из портальной системы в печень осуществляется по истинным добавочным воротным венам или сосудам печеночно-двенадцатиперстной связки и малого сальника. Давление во внутрипеченочных ветвях воротной вены не повышается, грубые нарушения функции печени не возникают, в связи с чем асцит наблюдается исключительно редко. Патогенез надпеченочной формы портальной гипертензии определяется повышением давления в печеночных венах, что и является основной причиной застоя крови в печени и повышения давления в воротной вене и ее
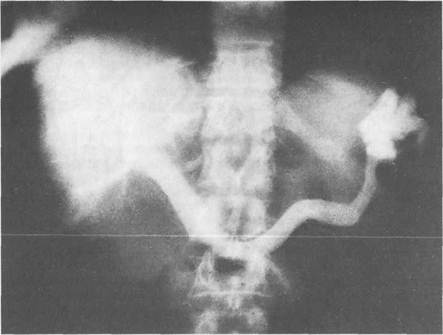
В патогенезе смешанной формы портальной гипертензии принимают участие те же факторы, что и при внутрипеченочной и надпеченочной формах, причем ведущая роль принадлежит факторам, обусловленным циррозом печени. Клиническая картина и диагностика. Клинические проявления различных форм портальной гипертензии связаны прежде всего с тем заболеванием, которое послужило причиной повышения давления в воротной вене. При предпеченочной форме синдрома заболевание возникает чаще в детском возрасте, протекает относительно благоприятно. Наиболее частыми его проявлениями бывают кровотечения из расширенных вен пищевода, спленомегалия, гиперспленизм. В случае внутрипеченочной формы портальной гипертензии ведущими признаками заболевания являются симптомы цирроза (постнекротический, алкогольный и т. п.), активность процесса, степень компенсации нарушенных функций печени. Характерны диспепсические явления (боли в эпигаст-ральной области, отсутствие аппетита, тошнота, метеоризм), внепеченочные знаки ("сосудистые звездочки", "печеночные ладони" и т. п.). Портальная ги-пертензия проявляется у этих пациентов спленомегалией, реже — гиперспле-низмом, расширением вен пищевода, кардии желудка, передней брюшной стенки в виде "головы медузы", асцитом. Грозным осложнением является кровотечение из варикозно-расширенных вен пищевода и желудка. При этом возникает срыгивание или рвота неизмененной кровью без каких-либо предшествующих болевых ощущений. При массивном кровотечении, затекании крови в желудок могут возникнуть рвота "кофейной гущей", мелена; развивается тахикардия, падает артериальное давление. Летальность при впервые возникшем кровотечении из варикозно-расширенных вен пищевода при циррозе печени высока — 30—50 % и более. Повторные кровотечения, асцит, желтуха (за счет поражения паренхимы печени) являются признаками запущенной стадии цирроза печени и оставляют мало шансов на успех лекарственного или хирургического лечения. Надпеченочная форма синдрома портальной гипертензии чаще обусловлена болезнью Киари или синдромом Бадда—Киари. При острой форме развития болезни Киари внезапно возникают довольно сильные боли в эпи-гастрии, правом подреберье, быстро нарастают гепатомегалия, гипертермия, асцит. Больные погибают от профузного кровотечения из варикозно-расширенных вен пищевода или от печеночно-почечной недостаточности. При хронической форме болезни постепенно нарастают гепатомегалия и спленомегалия, развивается коллатеральная венозная сосудистая сеть на передней брюшной и грудной стенках, нарастают асцит, истощение, нарушается белковый обмен (гипоальбуминемия). Анамнез и объективные данные клинического исследования с учетом преобладающей частоты внутрипеченочной формы блока позволяют поставить в большинстве случаев правильный предварительный диагноз. Среди инструментальных исследований первую очередь применяют рентгенологическое исследование пищевода и желудка для выявления варикозного расширения вен в дистальной части пищевода (рис. 12.6). О наличии его свидетельствуют множественые округлые или овальные дефекты наполнения при контрастировании пищевода. Более полную информацию о состоянии вен пищевода дает эндоскопическое исследование. Важное значение в определении уровня препятствия для оттока крови из воротной вены имеют
инструментальные методы исследования (целиакография — артериальная и венозная фазы, кавография, спленопортография). При внутри-печеночном блоке ценная информация об активности процесса может быть получена при оценке функционального состояния печени по данным биохимического исследования крови. Особое внимание обращают на уровень трансаминаз. Спленопортографию и сплено-манометрию выполняют в рентгеновском кабинете под контролем рентгенотелевизионного экрана. Под местной анестезией пунктируют селезенку, ориентируясь на ее перкуторно определяемые границы и тень на рентгеновском экране.
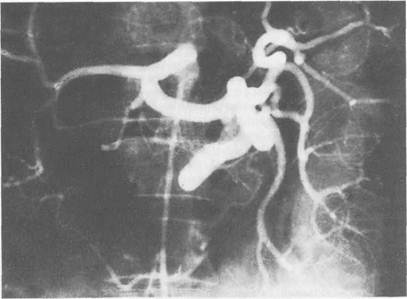
К игле, введенной в ее ткань, присоединяют аппарат Вальдмана и измеряют давление в сосудах селезенки. При портальной гипертензии давление обычно превышает 250 мм вод. ст., иногда достигая 500—600 мм вод. ст. и более (норма 110—120 мм). После измерения давления через иглу вводят контрастное вещество: триомбраст для инъекций (веро-графин и т. п.) и производят серию рентгенограмм. Характерными симптомами портальной гипертензии при спленопортографии (рис. 12.7) являются значительное расширение воротной вены и ее притоков, бедность внутрипеченочного сосудистого рисунка. У больных с внутрипеченочным блоком выявляют зону окклюзии воротной или селезеночной вены. Для диагностики надпеченочной формы синдрома портальной гипертензии применяют кавографию (введение контраста в нижнюю полую вену через вены бедра по Сельдингеру). Кавография позволяет определить уровень препятствия для оттока крови из печеночных вен, место сужения или окклюзии нижней полой вены. Возможны также селективная катетеризация печеночных вен и их контрастирование с выполнением серии рентгеновских снимков. При целиакографии (рис. 12.8) удается отдифференцировать внутри- и предпеченочную формы синдрома. Обычно при первой форме отмечаются расширение и извитость селезеночной артерии, сужение печеночной артерии, обеднение внутрипеченочного сосудистого рисунка. В венозную фазу видны селезеночная и воротная вены. Лечение. Необходимо проведение комплексного лечения как заболевания, вызвавшего портальную гипертензию, так и самой портальной гипертензии. При предпенсионной форме больные подлежат оперативному лечению, особенно при рецидивирующих кровотечениях из вен пищевода. Для снижения давления в воротной вене применяют один из вариантов прямого
Рис. 12.7. Портальная гипертензия. Видна расширенная, изогнутая под углом воротная пена (один из признаков портальной гипертензии). Спленопортограмма.
Рис. 12.8. Портальная гипертензия, внутрипеченочная форма. Расширение селезеночной артерии и значительное сужение печеночной артерии и се ветвей (артериальная фаза). Целиако- грамма.
Рис. 12.9. Виды портокавальных анастомозов. о — прямой портокавальный по типу конец в бок; б — прямой портокавальный по типу бок в бок; в — ме-зентерико-кавальный; г — спленоренальмый (центральный); д — спленоренальный (дистальный). портокавального, мезентерико-кавального или спленоренального анастомоза (рис. 12.9). Если наложение сосудистого анастомоза невозможно, то применяют оменторенопексию — подшивание большого сальника к печени, диафрагме и почке после предварительной ее декапсуляции. Операция рассчитана на формирование в последующем межорганных анастомозов между сосудами портальной (сальник) и кавальной (почка) систем. В последние годы операцию применяют редко. При выраженной спленомегалии, особенно при гиперспленизме, производят спленэктомию. При внутрипеченочном блоке и циррозе печени, осложненном портальной гипертензией, хирургическое лечение возможно лишь при отсутствии активного процесса в печени и симптомов печеночной недостаточности. При выборе метода операции учитывают возраст, общее состояние пациента, наличие сопутствующих заболеваний, степень компенсации нарушенных функций печени, величину портального давления, выраженность ги-перспленизма и т. п. Создание прямых портокавальных сосудистых анастомозов (спленоренальный, мезентерико-кавальный, собственно портокавальный) направлено на быстрое снижение портального давления вследствие сброса крови в систему нижней полой вены. Прямые портокавальные анастомозы часто становятся причиной тяжелой энцефалопатии в связи с гипераммониемией, поэтому их стали применять реже, отдавая предпочтение спленоренальному анастомозу. В последние годы для создания внутрипеченочного портокавального анастомоза используют мини-инвазивную технику. Для этой цели через нижнюю полую вену проводят тонкий специальный катетер в одну из печеночных вен и, продвигая его по ходу вены, проникают в рядом расположенную внутрипеченочную ветвь портальной вены. Убедившись в правильности расположения катетера, раздувают на нем баллончик для расширения отверстия в печени и в соустье между ветвями печеночной и воротной вен. В расширенный таким образом канал вводят металлический стент, по которому портальная кровь будет сбрасываться в печеночную и далее полую вену. Опыт применения этого метода недостаточно велик для оценки его эффективности. Оментопексия (оменторенопексия и оментогепатопексия), перемещение селезенки в грудную полость или в забрюшинное пространство рассчитаны на создание в будущем органных анастомозов, которые будут служить шунтом для сброса портальной крови. В настоящее время эти операции применяют редко, так как они не приводят к значительному снижению портального давления. Спленэктомия не имеет самостоятельного значения в лечении портальной гипертензии, ее применяют при выраженном гиперсплени-ческом синдроме и, как правило, дополняют наложением сосудистого спле-норенального анастомоза. У ряда больных вполне удовлетворительные результаты дают сочетание спленэктомии с оментореноплексией (после де-капсуляции почки), перевязкой вен в области кардии и абдоминального отдела пищевода с целью прекращения оттока крови из вен желудка в расширенные вены пищевода. Лечение синдрома Бадда—Киари и болезни Киари представляет значительные трудности. Лишь у небольшой части больных удается выполнить то или иное оперативное вмешательство (чреспредсердное разрушение мембраны в просвете полой вены, обходное кавопредсердное шунтирование). При повторных кровотечениях из вен пищевода обычно создают спленоре-нальный анастомоз. Дата добавления: 2015-01-18 | Просмотры: 1059 | Нарушение авторских прав |


 12.8.2. Злокачественные опухоли
12.8.2. Злокачественные опухоли притоках. В результате развивается цирроз печени с присоединением гемо-динамических сдвигов, характерных для внутрипеченочной формы синдрома.
притоках. В результате развивается цирроз печени с присоединением гемо-динамических сдвигов, характерных для внутрипеченочной формы синдрома.