|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Аномальные лиганды и аномальные формы гемоглобинаОкись углерода (СО), цианиды, азотная кислота и аммиак moitt связываться с гемоглобином в местах соединения с кислородом. Они вытесняют кислород и смещают кривую диссоциации влево. Угарный газ отличается особенной активностью: его сродство к гемоглобину в 200-300раз выше, чем у кислорода. СО связывается с гемоглобином, образуя карбоксигемоглобин, что снижает кислородную емкость гемоглобина и нарушает освобождение кислорода в тканях. При окислении железа тема до трехвалентной формы образуется метгемоглобин. В редких случаях нитраты, нитриты, сульфаниламиды и другие лекарственные средства могут вызывать сильную метгемоглобинемию. Метгемоглобин неспособен связывать кислород, до тех пор пока он не будет восстановлен с помощью фермента метгемо-глобинредуктазы; кроме того, метгемоглобин смещает кривую диссоциации оксигемоглобина влево. Метгемоглобинемия, как и отравление угарным газом, снижает кислородную емкость крови и нарушает высвобождение кислорода в тканях. Метилено-вый синий и аскорбиновая кислота способствуют восстановлению метгемоглобина в гемоглобин. Аномальные формы гемоглобина возникают в результате изменений в составе белковых субъединиц. Каждый вариант имеет собственные характеристики связывания с кислородом. Наиболее распространенные аномальные формы гемоглобина включают фе-тальный гемоглобин, гемоглобин A2, гемоглобин при серповидно-клеточной анемии (гл. 29). Содержание кислорода в крови Общее содержание кислорода в крови равно сумме физически растворенного и связанного с гемоглобином кислорода. Связывание кислорода с гемоглобином никогда не достигает теоретического максимума, поэтому считают, что 1 г гемоглобина может связать приблизительно 1,31 мл кислорода. Содержание кислорода в крови (С, от англ, content — содержание) выражается следующим уравнением: Содержание кислорода (в 100 мл крови) = = [(0,003 мл О2/ЮО мл крови/мм рт. ст.) х PO2] + + (SO2X HbX 1,31 мл/1 OO мл крови), где Hb — концентрация гемоглобина (г/100 мл крови), a SO2 — насыщение гемоглобина кислородом (S, от англ, saturation — насыщенеие) при данном PO2.
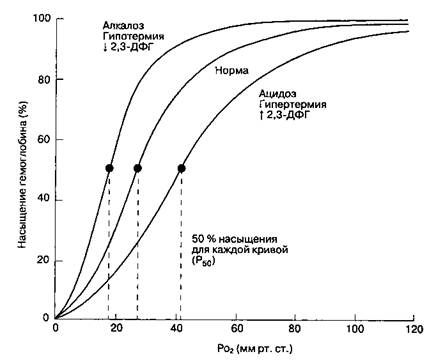
Рис. 22-23. Сдвиги кривой диссоциации оксигемоглобина при изменениях рН, температуры тела и концентрации 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах Используя эту формулу и величину Hb, равную 15 г/100 мл, можно рассчитать содержание O2 в артериальной pi смешанной венозной крови, а также артериовенозную разницу по кислороду (при SaO2 - 97,5 % и SvO2 = 75 %): CaO2-(O1OOSx 100)+ (0,975 х 15 х 1,31)= = 19,5 мл О2/100 мл крови; CvO2-(0,003 х 40)+ (0,75 х 15 х 1,31) = - 14,8 мл О2/100 мл крови; (CaO2 - CvO2) - 4,7 мл О2/1OO мл крови. Дата добавления: 2015-02-06 | Просмотры: 1140 | Нарушение авторских прав |