|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ПОНЯТИЕ О ВЗАИМНОМ ВЛИЯНИИ АТОМОВ В МОЛЕКУЛЕ И ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Согласно теории А. М. Бутлерова свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга. В результате взаимного влияния атомов и электронов связей в молекулах происходит перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Замена в соединении атома одного элемента атомом другого элемента или группой атомов приводит не только к изменению распределения электронной плотности в новой связи, но и вызывает соответствующие изменения электронных плотностей нескольких соседних связей. Различают электроноакцепторные (притягивающие электроны - эффект "-") и электронодонорные (посылающие электроны — эффект "+") заместители. При рассмотрении электронных смещений необходимо четко различать электронные эффекты в насыщенных системах связей ив сопряженных системах (разд. 2.1.3). Электронные эффекты в насыщенных системах. Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех σ-молекулярных орбиталей (σ-связей) и приводит к возникновению частичных зарядов (δ) на соседних атомах. Такой электронный эффект заместителя называется индуктивным (I -эффект). Индуктивный эффект - влияние заместителя на электронную плотность молекулы путем смещения электронов σ -связей. Направление индуктивного эффекта заместителя принято качественно оценивать путем сравнения с атомом водорода, индуктивный эффект которого условно принят за 0. Электроноакцепторные заместители (X), уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (-I). Электронодонорные заместители (Y), увеличивающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I).
Электроноакцепторными заместителями (- I) являются: —F, —С1, —Вг, —I, —ОН, —OR, —NH2, —NR2, —N+R3,
Электронодонорными заместителями (+ I) являются алкильные группы (—СН3, —С2Н5, —С(СН3)3), анионные группы —О-, —S-, атомы металлов. Они способствуют повышению электронной плотности в цепи и появлению частичных отрицательных зарядов (δ–) на соседних атомах. Графически действие индуктивного эффекта изображают стрелкой, совпадающей с положением черточки связи и направленной острием в сторону более электроотрицательного атома. Индуктивный эффект из-за слабой поляризуемости σ-связей быстро затухает по углеродной цепи: δ' > δ > δ'". Электронные эффекты в сопряженных системах. В отличие от насыщенных систем, в которых электронное влияние заместителя (индуктивный эффект) передается по σ-связям, в сопряженных системах в передаче электронного влияния участвуют электроны π-молекулярных орбиталей (π-электроны) делокализованных связей. При этом заместитель сам является участником сопряженной системы. Такой вид передачи электронного эффекта называется мезомерным (М-эффект) или эффектом сопряжения. Мезомерный эффект - влияние заместителя на электронную плотность молекулы путем смещения π -электронов кратных связей или неподеленных электронных пар гетероатомов. Смещение подвижных электронов в результате мезомерного эффекта графически обозначается изогнутыми стрелками, начало которых показывает, какие π- или ρ-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются. В отличие от индуктивного, мезомерный эффект не затухает в пределах всей сопряженной системы, так как π - и р- электроны более подвижны, чем σ-электроны. Заместители, способные к отдаче своей пары электронов в общую сопряженную систему, являются электронодонорными и проявляют положительный мезомерный эффект. +М-Эффект характерен для заместителей, содержащих гетероатомы с не- поделенной парой электронов или целым отрицательным зарядом:
Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (-М):
Большинство функциональных групп проявляет и индуктивные, и мезомерные эффекты, действие которых может быть как однонаправленным, так и разнонаправленным. Поэтому при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие индуктивного и мезомерного эффектов (табл. 6). Таблица 6 Электронные эффекты заместителей
С помощью табл. 6 можно прогнозировать характер изменения электронной плотности на реакционном центре молекулы, вызванного заместителем. Особое значение явление делокализации электронной плотности имеет для сопряженных систем. Сопряжение - это образование единого электронного облака в результате взаимодействия негибридизованных Различают два типа сопряженных систем (и сопряжений). 1.
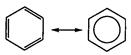
делокализация электронов в молекуле бензола происходит с участием шести атомов углерода:
Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль. 2. p,
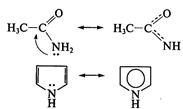
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива.
Дата добавления: 2015-02-06 | Просмотры: 4003 | Нарушение авторских прав |
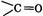



 -орбиталей в молекулах с чередующимися двойными и одинарными связями.
-орбиталей в молекулах с чередующимися двойными и одинарными связями.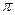 ,
,