|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
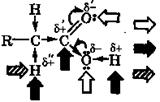
ХИМИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХДля карбоновых кислот и их производных характерна разнообразная реакционная способность, обусловленная присутствием в молекулах карбоксильной группы. В карбоксильной группе имеются полярные ковалентные связи: между ее углеродным и кислородным атомами (С=О, С—О), а также связь О—Н. При этом связь С=О длиннее, чем в кетонах, а связь С—О короче, чем в спиртах, что обусловлено взаимодействием неподеленной пары кислородного атома гидроксильной группы с л-электронами карбонильной группы, т. е. электронодопорным эффектом сопряжения (+М). В результате этого эффекта увеличивается полярность связи О—Н и снижается частичный положительный заряд 6+ на карбонильном углеродном атоме по сравнению с другими карбонильными соединениями (альдегидами и кетонами). Соответственно и связанный с карбоксильной группой С—Н-кислотный центр является более слабым, чем аналогичный центр в альдегидах и кетонах:
– нуклеофильный центр (атакуется электрофилом) – электрофильный центр (атакуется нуклеофилом)
– подвижный атом водорода (атакуется свободным радикалом)
В отличие от альдегидов и кетонов, для которых характерны реакции нуклеофильного присоединения по кратной связи карбонильной группы, карбоновые кислоты и их производные обычно вступают в реакции нуклеофильного замещения по их элек-трофильным центрам, часто сопровождаемые кислотно-основными и окислительно-восстановительными превращениями. Атом водорода, связанный с α-углеродным атомом цепи, также чувствителен к атаке свободными радикалами, что может приводить к гомолитическому разрыву разных связей и даже вызывать реакции декарбоксилирования или декарбонилирования (отщепления СО2 или СО соответственно).
Дата добавления: 2015-02-06 | Просмотры: 1247 | Нарушение авторских прав |