 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Биологические функции нуклеиновых кислотБиологические функции ДНК и РНК полностью определяются только совокупностью первичной, вторичной и третичной структур. Нуклеиновые кислоты - информационные биополимеры, осуществляющие хранение и передачу генетической информации во всех живых организмах, а также участвующие в биосинтезе белков. ДНК является носителем генетической информации, которая записана через определенную последовательность расположения в цепи четырех гетероциклических оснований. Первый этап реализации генетической информации заключается в том, что на конкретных участках одной из нитей молекулы ДНК происходит синтез молекул РНК. Биосинтез РНК, называемый транскрипцией, обычно происходит в результате комплементарного копирования ДНК-матрицы с помощью РНК-полимеразы. Синтезированная РНК содержит точную копию конкретного участка ДНК. В результате транскрипции образуются четыре различных вида РНК: рибосомальная рРНК, матричная мРНК (информационная), транспортная тРНК и малые ядерные РНК, роль которых разнообразна, но до конца еще не выяснена. Каждая из синтезированных РНК играет строго определенную роль на втором этапе реализации генетической информации - трансляции. Реализация генетической информации с помощью нуклеиновых кислот происходит по схеме:
транскрипция рРНК трансляция ДНК мРНК Белок тРНК малые РНК
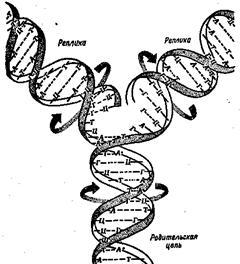
Рибосомальная РНК входит совместно с белками в состав рибосом. Матричная РНК, объединяясь с рибосомами, образует полирибосому, в которой с помощью ферментов и транспортных РНК, поставляющих определенные аминокислоты, происходит трансляция - синтез белков в соответствии с информацией, записанной на мРНК. Информация о последовательности аминокислот в молекуле белка считывается с последовательности гетероциклических оснований в мРНК. Конкретная группа из трех гетероциклических оснований в молекуле нуклеиновой кислоты, которая соответствует отдельной аминокислоте, называется кодоном. Совокупность кодонов составляет генетический код. Генетический код един для всего живого: у любого вида организмов каждая из α-аминокислот кодируется одним и тем же кодоном или одними и теми же кодонами. (Несколько кодонов могут кодировать одну и ту же аминокислоту, но один и тот же кодон не способен кодировать разные аминокислоты.) Комплементарность цепей составляет химическую основу еще одной важнейшей функции ДНК – хранения и передачи наследственных признаков. При делении клеток двойная спираль ДНК раскручивается и разделяется на 2 цепи. На каждой отдельной цепи, как на матрице, происходит биосинтез новой цепи ДНК с учетом принципа комплементарности. Вновь образовавшаяся цепь не идентична, но комплементарна исходной матрице. В результате образуются 2 новые двойные спирали ДНК, каждая из которых включает одну старую и одну вновь синтезированную цепи. Этот процесс называется репликацией молекулы ДНК (рис 18).
Рис. 18. ______ Она лежит в основе обеспечения дочерних клеток молекулами ДНК, полностью идентичными с ДНК родительских клеток. Сохранность нуклеотидной последовательности и точность ее транскрипции являются залогом безошибочной передачи генетической информации. Однако нуклеотидная последовательность ДНК под воздействием различных факторов может подвергаться изменениям, которые называются мутациями. Наиболее распространенный вид мутации – замещение какой-либо пары оснований на другую. Одной из причин такого замещения может явиться сдвиг таутомерного равновесия. Например, тимин в лактамной форме не может образовывать водородные связи с пуриповым основанием гуанином. Если же тимин будет иметь лактимную форму, то у него появляется такая возможность. Это приводит к замене обычной пары Т-А на пару Т-Г. Аналогичная картина наблюдается, когда сдвиг в сторону лактимной формы происходит у гуанина. Тогда гуанин образует водородные связи с необычным для него основанием тимином. Замена «нормальных» пар оснований передается при транскрипции генетического кода с ДНК на мРНК и приводит в итоге к изменению аминокислотной последовательности в синтезируемом белке. При накоплении мутации число ошибок в биосинтезе белка возрастает. Другой причиной возникновения мутации служит воздействие химических факторов, а также различных видов излучений. Например, если на аденозин подействовать азотистой кислотой, то в результате известной реакции дезаминирования аминогруппа в адениновом основании превратится в гидроксильную группу. Результатом этой реакции будет превращение аденозина в другой нуклеозид – инозин, содержащий гипоксантин. Это может привести к замене в ДНК комплементарной пары оснований, т.к. адениловый нуклеотид комплементарен тимину, а образовавшийся инозин может образовывать комплементарную пару только с цитозином. Мутации под воздействием различных химических соединений, называемых мутагенными веществами имеют большое значение для управлениия наследственностью с целью ее улучшения. Результаты этих исследований нашли применение в селекции сельскохозяйственных культур, создании штаммов микроорганизмов, производящих антибиотики, витамины, кормовые дрожжи. Большое значение нуклеотидов не ограничивается тем, что они являются строительным материалом для нуклеиновых кислот. Им отведена еще одна важная роль в организме – они служат коферментами и участвуют в обмене веществ. Коферментами, например, являются НАД- и ФАД – производные аденозинфосфата, а коэнзим А – производное аденозиндифосфата Во всех тканях организма в свободном состоянии содержатся не только монофосфаты, но и ди- трифосфаты нуклеозидов. Особенно широко известны аденинсодержащие нуклеотиды – аденозин-5'-фосфат (АМФ), аденозин -5'-дифосфат (АДФ), аденозин -5'-трифосфат (АТФ). Все эти нуклеотиды способны обратимо превращаться друг в друга путем наращивания или отщепления фосфатных групп:
В этих соединениях фосфатные группы в физиологических условиях почти полностью ионизированы, поэтому их часто записывают в виде анионов АТФ4-, АДФ3-. Главная особенность этих нуклеотидов состоит в том, что их полифосфатные группы содержат одну или две ангидридные группы
В настоящее время химики осуществляют многообразные трансформации нуклеотидов, для чего в молекулы моносахаридов вводятся дополнительные функциональные группы, как это имеет место, к примеру, с молекулой азидотимидина (препарат против СПИДа), или вместо фуранозного цикла используется нециклический радикал, напоминающий по строению моносахаридный остаток. Таким веществом является мощный антивирусный препарат - ацикловир.
Азидотимидин Ацикловир
Контрольные вопросы
1. Какие таутомерные формы возможны для урацила и какая из 2. Приведите структурную формулу молекулы АТФ. Укажите сложноэфирную и N-гликозидную связи в молекуле. 3. Напишите структурную формулу уридина. Укажите N-гликозидную связь. В какой форме моносахарид входит в состав нуклеозида? 4. Напишите структурную формулу тимидина. Укажите N-гликозидную связь. В какой форме моносахарид входит в состав нуклеозида. 5. Напишите уравнение реакции цитозина с азотистой кислотой. Объясните мутагенность азотистой кислоты. Покажите комплементарное взаимодействие цитозина и продукта его взаимодействия с азотистой кислотой с соответствующими нуклеиновыми основаниями. 6. Напишите уравнение реакции глицина с АТФ. Назовите продукты реакции и образовавшуюся функциональную связь. 7. Напишите структурные формулы нуклеотидов: 5-дезоксиадениловой кислоты, гуанозин-5-монофосфата. Укажите сложноэфирную и N-гликозидную связи в молекулах. Напишите уравнения кислотного и щелочного гидролиза данных нуклеотидов. 8. Какие связи обусловливают первичную и вторичную структуру нуклеиновых кислот?
Лабораторная работа. Гидролиз нуклеиновых кислот.
Цель работы. Научиться осуществлять гидролиз биоорганических фракций, содержащих нуклеопротеины, а также идентифицировать компоненты нуклеопротеинов в гидролизате фракций. Приборы и оборудование. Пробирка для гидролиза; обратный холодильник; пробирки лабораторные; штатив. Реактивы. Раствор аммиака концентрированный; раствор NaOH (1 моль/л); раствор CuSO4 (10%); раствор AgNO3 (10%); раствор молибдата аммония; растворы серной и азотной кислот (1 моль/л). Сущность работы. Изучение химического состава нуклеопротеинов удобно проводить на дрожжевых клетках. При непродолжительном гидролизе дрожжевой массы или выделенных из нее нуклеопротеинов последние (нуклеопротеины) распадаются на полипептиды, пуриновые и пиримидиновые основания, рибозу и дезоксирибозу, фосфорную кислоту. Продукты гидролиза могут быть обнаружены специфическими для каждого вещества реакциями. Ход работы. Опыт 1. Гидролиз фракции, содержащей нуклеопротеины. В пробирку для гидролиза (широкую длинную, снабженную пробкой с обратным холодильником) помещают 0,5 г пекарских дрожжей, добавляют 10 мл 1 М раствора серной кислоты. Пробирку закрывают пробкой с обратным холодильником. Содержимое пробирки кипятят над асбестовой сеткой в течение 60 мин. Затем содержимое пробирки охлаждают до комнатной температуры и фильтруют через бумажный фильтр. Опыт № 2. Качественные реакции на компоненты нуклеопротеинов в гидролизате фракции. 1. В пробирку помещают 0,5 мл фильтрата гидролизата и проводят биуретовую реакцию. О результатах наблюдений делают отметку в табл.
Качественные реакции на компоненты нуклеопротеинов
2. В пробирку помещают 0,5 мл фильтрата гидролизата, добавляют 2 капли концентрированного раствора аммиака, 0,5 мл 10 % раствора нитрата серебра. Через 5 мин наблюдают образование рыхлого бурого осадка. Эта реакция доказывает наличие в растворе пуриновых оснований. 3. В пробирку помещают 0,5 мл фильтрата гидролизата, добавляют 10 капель 1 М раствора гидроксида натрия и 6 капель 10 %раствора сульфата меди (П). Наблюдают появление мути. Содержимое пробирки нагревают до кипения. В табл. __ делают отметку о результатах наблюдений. 4. В пробирку помещают 0,5 мл фильтрата гидролизата, добавляют 2 мл насыщенного раствора молибдата аммония и 1 мл концентрированного раствора азотной кислоты. Содержимое пробирки перемешивают и кипятят 3 — 5 мин. Наблюдают появление лимонно-желтой окраски. Эта реакция доказывает наличие в растворе фосфорной кислоты. Оформление протокола. В лабораторном журнале должны быть приведены: 1) название работы; 2) цель работы; 3) приборы и оборудование; 4) реактивы; 5) сущность работы; 6) экспериментальные данные (табл. 5.8); 7) выводы.
ГЛАВА 11. ОМЫЛЯЕМЫЕ И НЕОМЫЛЯЕМЫЕ ЛИПИДЫ. СТЕРОИДЫ И СТЕРОИДНЫЕ ГОРМОНЫ. Вопросы к занятию. 1. Липиды, классификация липидов. 2. Основные представители фосфолипидов – фосфатидилэтаноламин (кефалин), фосфатидилхолин (лецитин). Серинфосфатиды и инозитолфосфатиды. 3. Терпены. Моно- и бициклические терпены. Пинен и камфара. 4. Основные группы стероидов: А) стерины – холестерин и витамины группы Д. Б) желчные кислоты В) стероидные гормоны
Дата добавления: 2015-02-06 | Просмотры: 1752 | Нарушение авторских прав |
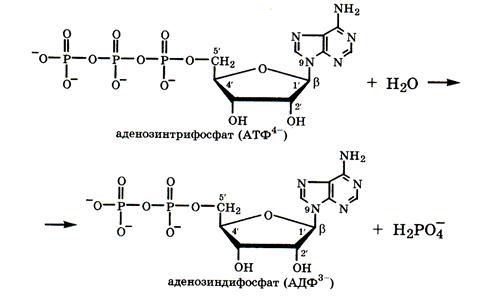
 . При гидролизе такой группы разрывается связь, называемая макроэргической, и выделяется около 33 кДж/моль. Именно с этим связана роль АТФ в клетке как поставщика химической энергии для биохимических и физиологических процессов.
. При гидролизе такой группы разрывается связь, называемая макроэргической, и выделяется около 33 кДж/моль. Именно с этим связана роль АТФ в клетке как поставщика химической энергии для биохимических и физиологических процессов.