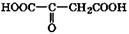|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Некоторые биогенные оксокарбоновые кислоты и их биологическая роль
Оксокарбоновые кислоты в организме образуются при окислении соответствующих гидроксикарбоновых кислот путем их дегидрирования с помощью дегидрогеназ с окисленной формой кофермента НАД+:
Оксокарбоновые кислоты сильнее, чем соответствующие гидроксикарбоновые кислоты. Поэтому в биосредах организма (рН ≈ 7) они обычно находятся в виде анионов. Оксокарбоновые кислоты проявляют свойства, характерные и для кислот, и для карбонильных соединений. Специфические свойства этих кислот обусловлены взаимным влиянием карбонильной (>С=О) и карбоксильной (—СООН) групп. Наличие в их молекулах двух и более подобных электроотрицательных групп приводит к большей склонности этих соединений к реакциям окислительно-восстановительной дисмутации, как внутри-, так и межмолекулярным. В результате дисмутации происходит расщепление и образование различных связей, включая межуглеродные.
Реакции с расщеплением связи С — С. В растворе H2SO4 пировиноградная кислота подвергается внутримолекулярной дисмутации с расщеплением связи С—С: в разбавленной H2SO4 происходит декарбоксилирование, а в концентрированной — декарбонилирование:
Эти реакции наглядно демонстрируют различные окислительно-восстановительные свойства одних и тех же углеродных атомов в молекуле пировиноградной кислоты в зависимости от условий протекания реакции. По-видимому, в разбавленной H2SO4 в реакцию вступает ассоциат пировиноградной кислоты с Н3О+, а в концентрированной - катион этой оксокислоты.
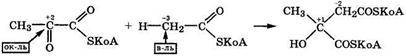
В организме пировиноградная кислота также декарбоксилируется, но при этом протекает межмолекулярная дисмутация в ансамбле ферментов, содержащем декарбоксилазу и коферменты НАД+ и HSKoA:
Аналогичная реакция окислительного декарбоксилирования превращает α-оксоглутарат в сукцинилкофермент А в цикле Кребса (разд. 19.4.3). В отличие от α-оксокарбоновых кислот, декарбоксилирование β-оксокарбоновых кислот протекает легче. Так, ацетоуксусная кислота даже при комнатной температуре и в отсутствие H2SO4 самопроизвольно декарбоксилируется, превращаясь в ацетон:
В то же время в тиоэфирах β-оксокарбоновых кислот с коферментом А под действием тиолазы и кофермента А происходит внутримолекулярная дисмутация, но расщепляется связь Сβ—Сα, так как восстановителем в этом случае выступает углеродный атом карбонильной, а не карбоксильной группы:
Этой реакцией заканчивается каждый цикл β-окисления жирных кислот (разд. 19.4.2). Реакции с образованием связи С — С. Оксокарбоновые кислоты легко вступают в реакцию конденсации альдольного типа. При этом возникновение связи С—С происходит за счет присоединения (реакция AN) С-нуклеофила и протона (электрофила) по кратной связи карбонильной группы с образованием гидроксипроизводного дикарбоновой кислоты с разветвленным углеродным скелетом:
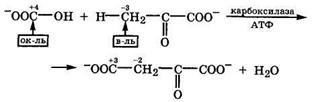
Как видно, это реакция межмолекулярной окислительно-восстановительной дисмутации, в которой углеродный атом карбонильной группы выступает окислителем. Подобная реакция протекает в цикле Кребса на стадии конденсации оксалоацетата с ацетилкоферментом А (разд. 19.4.3). Образование связи С—С также происходит при карбоксилировании оксокарбоновых кислот. Так, в митохондриях гидрокарбонат-анион взаимодействует с пируватом при участии карбоксилазы и АТФ с образованием оксалоацетата и отщеплением воды:
При этом происходит удлинение углеродной цепи. Рассмотренные реакции свидетельствуют о том, что в оксокислотах углеродный атом карбонильной группы проявляет двойственность, выступая и восстановителем, и окислителем. Однако окислительные свойства для него более характерны, особенно в реакциях присоединения по карбонильной группе. Поэтому для оксокарбоновых кислот характерны реакции восстановления. Реакция восстановления. Карбонильная группа оксокарбоновых кислот легко восстанавливается при реакциях гидрирования и трансаминирования. Гидрирование. Пировиноградная кислота, возникающая в мышцах, при недостатке кислорода под действием гидрогеназы с коферментом в восстановленной форме гидрируется с образованием молочной кислоты:
Вследствие накопления молочной кислоты в работающих мышцах возникает характерная боль, которая проходит при отдыхе за счет накопления кислорода и окисления молочной кислоты обратно в пировиноградную. Подобное гидрирование оксокарбоновых кислот происходит при синтезе жирных кислот в организме (разд. 19.4.1). Трансаминирование. Основным методом биосинтеза α-аминокислот из α-оксокислот является реакция трансаминирования, сопровождаемая межмолекулярной окислительно-восстановительной дисмутацией, при которой углеродный атом карбонильной группы выступает окислителем. Под действием трансаминазы с коферментом пиридоксальфосфатом α-оксокислота реагирует с α-аминокислотой, превращаясь в новую α-аминокислоту:
Трансаминирование в организме - обратимый процесс, за счет которого осуществляется взаимообмен оксо- и аминогрупп в биосубстратах (разд. 21.2.4). Кето-енольная таутомерия. В оксокарбоновых кислотах и их производных значительно повышена протонная подвижность водородного атома, связанного с α-углеродным атомом относительно карбонильной группы. Это способствует переносу протона на кислородный атом соседней карбонильной группы с возникновением енольной формы, находящейся в равновесии с кетонной формой, т. е. прототропной таутомерии кето-енольного типа. Как уже говорилось, кето-енольная таутомерия сопровождается окислительно-восстановительной дисмутацией, при которой в кетотаутомере углеродный атом карбонильной группы выступает окислителем, а α-углеродный атом - восстановителем. В енольной форме эти углеродные атомы выполняют противоположные функции. Оксокарбоновые кислоты в биологических средах (рН ≈ 7) находятся в виде анионов, поэтому кето-енольную таутомерию этих кислот в организме следует рассматривать на их анионах. И в этом случае кето-енольная таутомерия является сложным равновесием, включающим не только кетонный и енольный таутомеры анионов, но и их общий амбидентный анион, отрицательный заряд которого на единицу больше, чем у самих таутомеров. В соответствии с законами термодинамики таутомерное равновесие всегда смещено в сторону таутомера с более слабыми кислотными свойствами, а в присутствии сильного основания - в сторону амбидентного аниона. Следовательно, чем сильнее различаются по кислотности таутомеры, тем больше преобладает таутомер со слабыми кислотными свойствами. Так, для пирувата равновесие сильно (> 95 %) сдвинуто в сторону кетотаутомера:
Напротив, для оксалоацетата енольный таутомер становится преобладающим (>80 %), поскольку он является устойчивым внутримолекулярным хелатом, образованным за счет водородной связи:
Наличие у соединения таутомерии значительно расширяет и повышает его реакционную способность. Такое соединение способно не только вступать в реакции, характерные для каждого таутомера, но и проявлять еще двойственную реакционную способность, характерную для их общего амбидентного аниона. При этом таутомерная система прежде всего вступает в те реакции, которые протекают быстрее (кинетический фактор) и приводят к более устойчивым продуктам (термодинамический фактор). Поскольку все компоненты таутомерной системы находятся в равновесии, то убыль реагирующего компонента сразу восполняется за счет других компонентов. Поэтому таутомерная система реагирует как одно целое. В организме время установления равновесия в таутомерной системе уменьшается с помощью ферментов-таутомераз, что обеспечивает необходимую скорость жизненно важных биохимических реакций. Перечисленные особенности реакционной способности таутомерных систем позволяют понять разнообразие химических свойств анионов оксокарбоновых кислот в условиях организма. Анионы оксокарбоновых кислот и их производных легко ацилируются и алкилируются. При этом реакция может протекать и по углеродным, и по кислородным центрам, что широко используется при синтезе лекарственных препаратов. Комплексообразование. Оксокарбоновые кислоты являются активными ди- и полидентатными лигандами и поэтому образуют устойчивые хелаты с ионами-комплексообразователями:
Качественная реакция с раствором FeCl3 на оксокарбоновые кислоты (возникновение интенсивной красно-фиолетовой окраски) основана на образовании комплексов их енольными таутомерами. Вероятно, как и в случае фенола, ионы Fe3+ за счет окислительных свойств способствуют внутрикомплексному образованию радикалов (разд. 17.2) и возникновению комплексов с переносом заряда. На реакциях комплексообразования основано и применение оксокарбоновых кислот и их производных в качестве лекарственных препаратов для вывода ионов металлов-токсикантов из организма.
Дата добавления: 2015-02-06 | Просмотры: 1173 | Нарушение авторских прав |