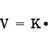|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ И ИХ КОМПОНЕНТОВ
Любая химическая реакция включает разрыв (расщепление) связей между атомами и образование новых связей. В органической химии принято выделять два типа реагирующих частиц: субстрат — вещество, в котором происходит разрыв старых и образование новых связей с участием атома углерода, и реагент — вещество, под действием которого происходят изменения в субстрате. (Принято говорить об атакующем воздействии реагента на субстрат.) Например, в реакции Реакции с участием органических соединений подчиняются тем же законам, что и реакции в неорганической химии, хотя и имеют некоторые специфические особенности. Во-первых, разрыв связей может происходить по-разному с образованием различных промежуточных соединений. Во-вторых, изменению в ходе реакции подвергается, как правило, не вся молекула субстрата, а ее небольшая часть, включающая функциональную группу, кратную связь и т.п., называемая реакционным центром молекулы. Появление реакционных центров обусловлено неравномерным распределением электронной плотности в молекуле. В неорганической химии в реакциях обычно участвуют ионы, поэтому они протекают очень быстро, а иногда — мгновенно. В реакциях органической химии обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают значительно медленнее, чем ионные, и для их успешного осуществления часто необходимы жесткие условия: повышенная температура, повышенное давление и катализаторы. В отличие от неорганических, органические реакции редко приводят к высокому выходу продукта (более 80 %), так как обычно протекает не одна, а несколько реакций. Поэтому в органической химии используются не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические соотношения между участниками, но указываются условия проведения реакции. Например, реакция этилена с водой, протекающая при повышенной температуре, повышенном давлении и в присутствии кислотного катализатора, записывается так:
В ходе большинства биохимических реакций изменению подвергается не вся молекула органического соединения, как это обычно бывает с неорганическими веществами, а только ее часть, которая называется реакционным центром. Реакционные центры в зависимости от природы и структуры имеют разную степень сродства к атакующим частицам, и их можно подразделять в зависимости от типа органической реакции. Реакции в органической химии принято классифицировать по механизму их протекания и по конечному результату химического превращения. По механизму протекания реакции делятся на гетеролитические (электпрофилъно-нуклеофилъные) и гомолитические (свободнорадикальные). Поскольку названия «электрофильно-нуклеофильные» или «свободнорадикальные» указывают на характер реагирующих частиц, то они используются в учебнике для харатеристики механизма реакции.
Электрофильно-нуклеофильные реакции сопровождаются гетеролизом полярной ковалентной связи между фрагментами (Аδ+ — Вδ–), причем так, что ее общая электронная пара сильно смещается к одному фрагменту молекулы где А и В обозначают атомы или группы атомов, связанные полярной ковалентной связью. При полном гетеролизе связь разрывается с образованием катиона А+ - сильного электрофила — и аниона В– - сильного нуклеофила. Процесс гетеролиза ковалентной связи можно рассматривать как расщепление этой связи по донорно-акцепторному механизму. Гетеролиз ковалентной связи происходит и в молекуле субстрата, и в молекуле реагента. Результатом электрофильно-нуклеофильной реакции является взаимодействие между фрагментами реагента и субстрата, проявляющими противоположные свойства. Электрофилами называются частицы или фрагменты молекул, содержащие свободную, доступную орбиталь и имеющие недостаток электронной плотности, которые в результате реакции образуют связь с новым нуклеофилом, акцептируя у него оба электрона на свою вакантную орбиталь. Электрофилами являются положительно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электронной паре нуклеофила: Н-электрофил: протон (Н+); С-электрофилы: карбкатионы (R3С О-электрофилы: S-электрофилы: N-электрофилы: Галогены, атомы которых несут частичный положительный заряд: Галδ+—Галδ-. В электрофильно-нуклеофильных реакциях электрофил выступает акцептором электронной пары нуклеофила. К электрофилам также относятся все кислоты (доноры протона) при кислотно-основном взаимодействии, все окислители (акцепторы электронов) при окислительно-восстановительном взаимодействии и все комплексоообразователи (акцепторы электронов) в реакциях комплексообразования. Нуклеофилами называются частицы или фрагменты молекул, содержащие подвижную электронную пару, которые в результате реакции образуют связь с новым электрофилом, отдавая ему эту электронную пару. Нуклеофилами являются отрицательно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электрофилу: С-нуклеофилы: карбанионы (R3Сө), металлоорганические соединения (R3C δ-—М δ+), ненасыщенные соединения (R2C=CR2, RC=CR); N-нуклеофилы: О-нуклеофилы: H2Ö, R— Ö—R', HÖ-, RÖ δ- —M δ+; S-нуклеофилы: H2 Галогенид-анионы: F-, Cl-, Br-, I-. В электрофильно-нуклеофильных реакциях нуклеофил выступает донором электронной пары. К нуклеофилам также относятся все основания при кислотно-основном взаимодействии, все восстановители при окислительно-восстановительном взаимодействии и все лиганды в реакциях комплексообразования. Таким образом, используемые в органической химии понятия электрофил и нуклеофил имеют более широкий смысл, чем понятия кислота и основание, окислитель и восстановитель, комплексообразователь и лиганд, используемые в неорганической химии. Однако суть электрофильно-нуклеофильных реакций, подобно кислотно-основным, окислительно-восстановительным и реакциям комплексообразования, также заключается в донорно-ак-цепторном взаимодействии компонентов с противоположными свойствами. Электрофильно-нуклеофильные свойства органических соединений проявляются прежде всего в их способности вступать в реакции: кислотно-основные, окислительно-восстановительные и комплексообразования. Органические соединения вступают также и в другие электрофильно-нуклеофильные реакции, которые нельзя отнести к вышеуказанным. В основном именно для этих реакций в данном учебнике будет использоваться термин «электрофильно-нуклеофильная реакция». Электрофилы и нуклеофилы характеризуются различной поляризуемостью и качественно подразделяются на жесткие (низкая поляризуемость) и мягкие (высокая поляризуемость). Жесткие электрофилы имеют сравнительно большой положительный заряд, а их свободная орбиталь, на которую перейдет электронная пара нуклеофила, имеет низкий уровень энергии. Жесткими электрофилами являются: Н+, Na+, К+, Mg2+, Ca2+, Mn2+, Al3+, A1C13, BF3, R Жесткие нуклеофилы хорошо удерживают свою электронную пару, поскольку ее орбиталь расположена близко к ядрам атомов и имеет низкий уровень энергии. Донорными атомами в жестких нуклеофилах могут быть кислород, азот, хлор, фтор. Жесткими нуклеофилами являются: Н2О, ОН-, ROH, RO-, ROR, RCOO-, NH3, RNH2, RNH-, Cl-, F-. Жесткие нуклеофилы трудно окисляются. Мягкие электрофилы содержат акцепторные атомы большого размера с невысокой электроотрицательностью и с малым положительным зарядом. Их свободная орбиталь, принимающая электронную пару нуклеофила, имеет высокий уровень энергии. Мягкими электрофилами являются: Hg2+, Cu+, Ag+, —I δ+, -Br δ+ Мягкие нуклеофилы плохо удерживают свою электронную пару, поскольку ее орбиталь удалена от ядер атомов и имеет высокий уровень энергии. Донорными атомами в мягких нуклеофилах выступают атомы серы, иода и углерода. Мягкими нуклеофилами являются: RS-, RSR, RSH, I-, RC=CR, R2C=CR2 Мягкие нуклеофилы довольно легко окисляются. Существуют электрофилы и нуклеофилы, которые занимают промежуточное положение. Электрофилы: Cu2+, Fe2+, Zn2+, R3C+, C6H Нуклеофилы: Br~, C6H5 В соответствии с принципом Пирсона более стабильная связь образуется при взаимодействии жесткого электрофила с жестким нуклеофилом или мягкого электрофила с мягким нуклеофилом. На основе этого принципа можно качественно оценить реакционную способность при взаимодействии нуклеофилов и электрофилов различного типа.
Основные типы органических реакций
В органической химии электрофильно-нуклеофильные реакции принято называть по характеру частицы, которой реагент атакует субстрат. Этот выбор можно объяснить тем, что реагент обычно является более простой молекулой, в которой проще определить состав электрофильного и нуклеофильного фрагмента и их активность, а следовательно, и характер атакующей частицы.
Нуклеофильной называется реакция, при которой реагент атакует субстрат своим нуклеофилом; она обозначается индексом N (nucleophlle).
В нуклеофильных реакциях реагент принято называть нуклеофилом. В органической химии нуклеофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный положительный заряд. Электрофильной называется реакция, при которой реагент атакует субстрат своим электрофилом; она обозначается индексом Е (electrophile).
В электрофильных реакциях реагент принято называть электрофилом. В органической химии электрофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный отрицательный заряд. В действительности механизм и результат любой электрофильно-нуклеофильной реакции определяется не только свойствами реагента, но и свойствами субстрата, образующихся продуктов реакции, растворителя и условиями ее проведения. Поэтому разделение электрофильно-нуклеофильных реакций на нуклеофильные и электрофильные только по свойствам реагента носит условный характер. Кроме того, как видно из приведенных схем, в этих реакциях всегда взаимодействуют между собой электрофилы и нуклеофилы, содержащиеся в субстрате и реагенте. Во многих реакциях лишь условно один компонент может считаться субстратом, а другой – реагентом. Свободнорадикальные реакции. Гомолитический распад характерен для неполярной или малополярной связи. Он сопровождается образованием свободных радикалов — частиц с неспаренным электроном. Гомолиз ковалентной связи можно рассматривать как расщепление этой связи по обменному механизму. Для осуществления гомолиза связи необходима энергия (теплота, свет), достаточная для того, чтобы разорвать эту связь. Наличие неспаренного электрона является причиной малой стабильности свободных радикалов (время жизни в большинстве случаев составляет доли секунды) и высокой реакционной способности в свободнорадикальных реакциях. Присутствие в системе свободного радикала (R۰) может приводить к образованию новых радикалов вследствие его взаимодействия с имеющимися молекулами: R۰ + А – В → R – A + ۰В Свободнорадикальные реакции сопровождаются взаимодействием свободных радикалов с молекулами или между собой с образованием новых свободных радикалов (зарождение или развитие цепи) или только молекул (обрыв цепи). Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи. Эти реакции прекращаются при исчезновении в системе свободных радикалов. Свободнорадикальные реакции обозначаются индексом R (radical). Радикальные частицы в зависимости от их сродства к электрону могут и принимать электроны (т. е. быть окислителями), и отдавать электроны (т. е. быть восстановителями). При этом сродство радикала к электрону определяется не только его свойствами, но и свойствами его партнера по реакции. Особенности процессов свободнорадикального окисления-восстановления, протекающих в организме, рассматриваются отдельно при описании свойств определенных классов органических соединений. В реакциях комплексообразования радикалами могут быть и комплексообразователь, и лиганды. В случае комплексов с переносом заряда радикалообразование может происходить внутри комплекса за счет внутримолекулярного окисления-восстановления между комплексообразователем и лигандом. Образование радикалов легче всего происходит при гомолизе неполярных простых связей между атомами одного и того же элемента: С12 → С1۰ + ۰С1 НО—ОН → НО۰ + ۰ОН R—О—О—R' → RO۰ + ۰OR' R—S—S—R' →RS۰ + ۰SR' При гомолизе малополярной связи С—Н образуются алкильные радикалы, в которых неспаренный электрон находится у атома углерода. Относительная устойчивость этих радикалов зависит от типа замещения атома углерода, несущего неспаренный электрон, и растет в ряду: •СН3 < •CH2R < •CHR2 < •CR3. Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала. Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет π-электронов соседних кратных связей. Это особенно наглядно наблюдается в аллильном и бензильном радикалах:
аллильный радикал бензильный радикал
В ходе ознакомления с возможными механизмами реакций в молекулах субстрата и реагента следует различать реакционные центры по их характеру: нуклеофильные, электрофилъные и радикальные. По конечному результату химического превращения простейшие органические реакции классифицируются на реакции: замещения, присоединения, элиминирования (отщепления) и перегруппировки. Реакции замещения. Под замещением понимают замену атома или группы на другой атом или группу. В реакции замещения всегда образуются два различных продукта. Этот тип реакций обозначается символом S (substitution). К реакциям замещения относятся: галогенирование и нитрование алканов (разд. 16.1), этерификация и алкилирование карбоновых кислот (разд. 19.2.3), а также многочисленные реакции взаимодействия простых полярных молекул (Н2О, NH3, НГал) с эфирами, спиртами и галогенпроизводными. Реакции присоединения. Под присоединением понимают введение атомов или групп в молекулу непредельного соединения, сопровождаемое разрывом π-связей. При этом двойные связи превращаются в ординарные, а тройные связи - в двойные или ординарные. Этот тип реакций обозначается символом A (addition). Реакции элиминирования (отщепления). Под элиминированием понимают отщепление атомов или групп от органической молекулы с образованием кратной связи. Поэтому реакции элиминирования обратны реакциям присоединения. Этот тип реакции обозначается символом Е (elimination). Каждая из органических реакций замещения (S), присоединения (А) или элиминирования (Е) может быть электрофильной (Е), нуклеофильной (N) или радикальной (R). Таким образом, в органической химии выделяют девять типовых реакций, обозначаемых символами S, А или Е с индексами R, N или Е:
Приведенные типы органических реакций следует считать модельными, так как они не всегда реализуются в чистом виде. Так, например, замещение и элиминирование могут протекать одновременно:
Реакции перегруппировки. В процессе перегруппировки происходит перемещение (миграция) одних атомов или групп ют одного фрагмента молекулы к другому без изменения ее брутто-формулы. Перегруппировки органических соединений происходят обычно в присутствии катализатора и сопровождаются окислительно-восстановительной дисмутацией атомов углерода:
При дальнейшем знакомстве с конкретными классами органических соединений нами будут рассматриваться следующие их химические свойства: кислотно-основные, комплексообразующие, окислительно-восстановительные, электрофильно-нуклеофильные, а также способность к свободнорадикальному взаимодействию. Особое внимание будет уделено особенностям протекания рассматриваемых реакций в биологических системах. Типы реакций, характерные для различных классов углеводородов, механизм их протекания и биологическое значение процессов представлены в таблице 7.
Механизмы реакций в органической химии
Реакции радикального замещения - SR
1. SR -гомолитическое взаимодействие с участием неполярных связей тетрагонального углеродного атома (реакции свободно-радикального замещения). Субстраты: алканы, циклоалканы (С5-С6). По этому механизму протекают реакции галогенирования. Этапы: 1. Инициирование цепи:
2. Развитие цепи: В результате последовательных реакций в цепи могут образовываться: СН3Cl – хлористый метил CH2Cl2 – хлористый метилен CHCl3 – хлороформ
CCl4 – четыреххлористый углерод
Реакция региоселективна. Скорость SR: Третичные УВ > Вторичные УВ > Первичные УВ Данная зависимость связана со стабильностью образующихся радикалов и подвижностью атомов водорода под влиянием +I – эффекта.
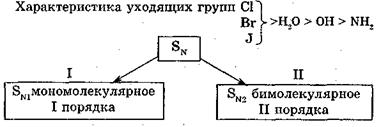
Реакции нуклеофилъного замещения у тетрагонального атома углерода (SN) Субстраты: спирты и галогенопроизводные Условия: водные растворы
I. Механизм SN1 — замещение нуклеофильное, мономолекулярное I порядка. Субстраты: третичные галогенопроизводные, у которых прямая атака нуклеофильными реагентами затруднена из-за наличия стерического эффекта заместителей.— пространственные затруднения. 1-я стадия - образование карбокатиона в результате медленной диссоциации суб страта:
2-я стадия: атака нуклеофильной частицей (НОН) протекает мгновенно: карбокатион третичный спирт
Скорость реакции:
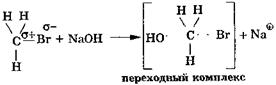
II. Механизм SN2 - бимолекулярное нуклеофильное замещение II порядка. Субстраты: первичные галогенопроизводные и первичные спирты, атака нуклеофильными реагентами субстрата не затруднена.
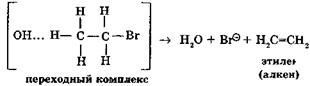
1-я стадия — нуклеофильный реагент атакует положительную часть молекулы с тыла (т. е. со стороны, противоположной галогену) с образованием промежуточного, переходного комплекса, в котором старые связи еще полностью не разорвались, а новые еще полностью не образовались: 2-я стадия: согласованно протекает разрыв старых (ковалентных) связей и образованиеновых:
Скорость в SN2 определяется по формуле: V=K-[CH3Br]·[NaOH], поэтому это реакция II порядка. Если изменить условия протекания этих реакций: вместо водных растворов взять безводные спиртовые растворы сильных щелочей, то с этими же субстратами пойдут конкурирующие реакции — реакции отщепления (элиминирования ) —Е1 и Е2. Реакции нуклеофильного замещения происходят только в том случае, если уходящая группа стабильнее вступающей. Хорошоуходящие группы — это такие группы, протонированные формы которых соответствуют сильным кислотам, например: Плохоуходящие группы — это такие группы, протонированные формы которых соответствуют слабым кислотам, например:
На последней (быстрой) стадии реакции происходит конкуренция за карбкатион между двумя частицами: галогенид-ионом (если в качестве кислоты использовали галогеноводородную кислоту) и молекулой воды, выступающей в роли акцептора протона. В первом случае происходит нуклеофильное замещение (
Реакции элиминирования (Е1 и Е2).
Механизм E1 ( отщепление молекулярное, I порядка).
Субстраты: третичные спирты, третичные галогенопроизводные. Условия: Катализатор - конц. H2SO4 1-я стадия — протонирование субстрата, преследует 2 цели:
(1) образование карбокатиона и (2) образование хорошей уходящей группы (НОН >ОН): третичный спирт карбокатион 2-я стадия — образовавшийся карбокатион не стабилен, поэтому стабилизация его происходит за счет выброса протона (H+):
В результате реакции третичные спирты, отщепляя воду [Е], превращаются в непредельные углеводороды — алкены.
Скорость реакции:
поэтому это отщепление I порядка (Е1) (реакции I порядка)
Б) Механизм Е2 ( отщепление бимолекулярное, второго порядка) Субстраты: первичные спирты, галогенопроизводные Условия — безводные, спиртовые растворы сильной щелочи. 1-я стадия — атака ОН-группой водорода, стоящего в β-положении с образованием переходного комплекса:
2-я стадия — далее реакция смещается в сторону образования молекулы Н2О, так как в окружающей среде нет Н2О (безводные, спиртовые растворы NaOH) (это кинетический контроль реакции), а с другой стороны идет образование Н2О как более термодинамически устойчивой частицы (термодинамический контроль реакции): а)
б) Na+ + Br- → Na Br Атаку ОН– группой водорода в β-положении (β-элиминирование) легко объяснить смещением реакции в сторону образования более термодинамически устойчивого кар-бокатиона, чем это имело бы место при α-элиминировании.
Дата добавления: 2015-02-06 | Просмотры: 2352 | Нарушение авторских прав |
 расщепляется связь С—Вr и образуется связь С—О; в качестве субстрата выступает
расщепляется связь С—Вr и образуется связь С—О; в качестве субстрата выступает  , в качестве реагента -
, в качестве реагента -  .
.

 Вδ–, превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов (Аδ+
Вδ–, превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов (Аδ+  ), превращая его в электрофил:
), превращая его в электрофил: ) или соединения с сильнополярной связью
) или соединения с сильнополярной связью 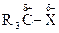 ,
, 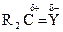 ,
, 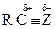
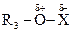 ;
; ;
; ,
,  ;
; H3, R
H3, R  , R—
, R—  =O
=O






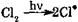




 , поэтому реакция I порядка
, поэтому реакция I порядка

 (протонированные формы: галогеноводородные кислоты HHal, ионы: гидроксония
(протонированные формы: галогеноводородные кислоты HHal, ионы: гидроксония 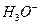 , алкилоксония
, алкилоксония 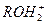 , аммония
, аммония  — сильные кислоты).
— сильные кислоты). и др. В этом случае для протекания реакции необходимо протонирование, т.е. кислотный катализ, что позволит перевести плохоуходящую группу в хорошоуходящую:
и др. В этом случае для протекания реакции необходимо протонирование, т.е. кислотный катализ, что позволит перевести плохоуходящую группу в хорошоуходящую: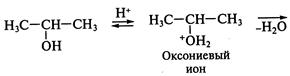

 ) гидроксила на галоген, а во втором — элиминирование (Е) — отщепление протона.
) гидроксила на галоген, а во втором — элиминирование (Е) — отщепление протона.