|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
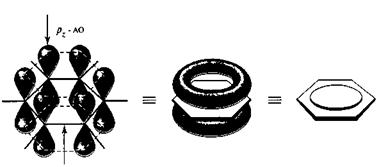
Системы с замкнутой цепью сопряженияСреди циклических сопряженных систем наибольший интерес представляет группа соединений, отличительной чертой которых является повышенная термодинамическая устойчивость по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичности. Кним, в первую очередь, относится способность таких формально ненасыщенных соединений вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры. Циклы этих систем по химическому строению могут быть только углеродными (арены и их производные) или содержать еще гетероатомы (гетероциклические соединения), и в них может осуществляться как π,π-, так и ρ,π- сопряжение. Арены и их производные. Особенности электронного строения ароматических углеводородов (аренов) наиболее наглядно проявляются в атомно-орбитальной модели бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ - связи (С – С и С- Н) лежат в одной плоскости. Шесть негибридизованных ρ-АО расположены перпендикулярно плос кости молекулы и параллельно друг другу (рис. 6.а). Каждая ρ-АО в равной степени может перекрываться с двумя соседними ρ-АО. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ- скелета и охватывает все атомы углерода цикла (рис. 6, б). π- электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком внутри цикла (рис. 6, в).
σ-скелет а) б) в) Рис. 6. Атомно-орбитальная модель бензола
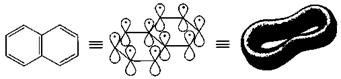
Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей. В общем случае, как установил на основании квантовомеханических расчетов немецкий физик Э. Хюккель, для образования таких стабильных молекул необходимо, чтобы плоская циклическая система содержала ( 4 п + 2) π-электронов, где п = 1, 2, 3 и т. д. (правило Хюккеля, 1931). С учетом этих данных можно конкретизировать понятие ароматичности. Соединение ароматично, если оно имеет плоский замкнутый цикл и сопряженную π-электронную систему, охватывающую все атомы цикла и содержащую (4 п + 2) π-электронов. Правило Хюккеля применимо к любым плоским конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. Поэтому такие соединения с конденсированными бензольными ядрами, как нафталин и другие (см. 6.3.2), отвечают критериям ароматичности (рис. 7).
нафталин 10 π-электронов (n = 2)
Рис. 7. Атомно-орбитальная модель нафталина
В настоящее время в связи с широким внедрением физико-химических методов появилась возможность экспериментально устанавливать наличие ароматического характера по способности соединения удерживать индуцированный кольцевой ток. Это осуществляют с помощью метода ядерно-магнитного резонанса
Гетероциклические ароматические соединения.
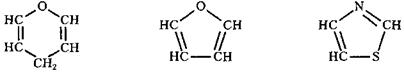
В ряду этих соединений встречаются оба вида сопряжения – π,π- и р,π-сопряжение. π,π-Сопряжение характерно для шестичленных гетероциклов с одним или несколькими гетероатомами. Простейшим их представителем является пиридин, содержащий в цикле один атом азота. Атом азота находится в состоянии sp2-гибридизации (две из трех sp2-гибридных орбиталей образуют σ-связи). Он поставляет в ароматический секстет один р -электрон. Неподеленная пара электронов на sp2- гибридной орбитали обусловливает свойства пиридина как основания. Атом азота с таким электронным строением принято называть пиридиновым (рис.). В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца. Поэтому системы с пиридиновым атомом азота называют π- недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. р,π-Сопряжение осуществляется в пятичленных гетероциклах с атомами азота, кислорода, серы. Довольно часто в составе биологически значимых соединений встречается гетероцикл с одним атомом азота — пиррол. В пирроле от атома азота в ароматический секстет включается находящаяся на негибридизованной р -орбитали пара электронов. Три электрона на sp2- гибридных орбиталях участвуют в образовании трех σ-связей. Атом азота в таком электронном состоянии получил название пиррольного (рис.). Шестиэлектронное облако в пирроле делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π - избыточную систему. В фуране, пиране и тиазоле ароматический секстет также включает неподеленную пару электронов негибридизованной р -АО кислорода и серы соответственно. В имидазоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару n -электронов, а пиридиновый — один р -электрон.
пиран фуран тиазол
В пиррольном и пиридиновом атомах азота электроны находятся на негибридизованных р --АО. Ароматическим характером обладает также пурин, представляющий собой конденсированную систему из двух гетероциклов — пиримидина и имидазола. Делокализованное электронное облако в пурине включает 10 π-электронов. Ароматичностью обладают также пиримидин,хинолин и индол.
пиридин пиримидин хинолин индол пурин
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биологических полимеров — нуклеиновых кислот.
Дата добавления: 2015-02-06 | Просмотры: 1995 | Нарушение авторских прав |