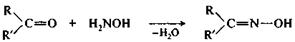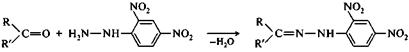|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Альдегиды и кетоны
Как соединения, склонные к образованию водородной связи, альдегиды и кетоны могут взаимодействовать с молекулами воды и поэтому хорошо в ней растворяются (особенно первые члены гомологического ряда).
Схематически распределение электронной плотности в альдегидах и кетонах с учетом передачи электронного влияния электронодефицитного атома углерода карбонильной группы по σ-связям представлено ниже (атом водорода может быть замещен на органический радикал, указанный в скобках).
Наличие в молекуле альдегида или кетона электрофильного центра — атома углерода карбонильной группы — предопределяет возможность нуклеофильной атаки. Местом электрофильной атаки служит основный (нуклеофильный) центр — атом кислорода карбонильной группы. Кроме того, в альдегидах и кетонах имеется слабый СН-кислотный центр, атом водорода которого обладает определенной протонной подвижностью и может, в частности, подвергаться атаке основанием. Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины эффективного положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина δ+ на нем в альдегидах и кетонах убывает в следующем ряду.
Уменьшение δ+ на карбонильном атоме углерода
——————————————————————————————→ – I
Увеличение пространственной затрудненности для нуклеофильной атаки
——————————————————————————————→
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода на более объемистые органические радикалы. Поэтому альдегиды более реакционноспособны, чем кетоны.
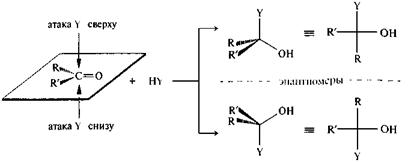
Общая схема реакций нуклеофильного присоединения AN к карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение электрофила к атому кислорода. альдегид (R = Н) переходное продукт или кетон состояние присоединения
Процесс напоминает бимолекулярное замещение SN2, но с тем отличием, что принимающий пару электронов атом кислорода не является здесь уходящей группой, а остается в молекуле субстрата. Карбонильный атом углерода имеет плоскую конфигурацию, поэтому нуклеофильная атака равновероятна с обеих сторон плоскости.
В тех случаях, когда карбонильный атом углерода является прохиральным центром и в результате реакции возникает хиральный атом углерода, энантиомеры образуются в равных количествах, т. е. получается рацемическая смесь. Следовательно, в обычных условиях, вне организма, эта реакция протекает нестереоселективно. По приведенному выше механизму осуществляется ряд важных реакций альдегидов и кетонов. Присоединение воды. Присоединение воды к карбонильной группе — гидратация — обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата. Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид — приблизительно наполовину, ацетон практически не гидратирован.
Положение равновесия реакции гидратации указанных соединений можно объяснить с учетом пространственного фактора. Так, образование гидрата ацетона невыгодно, поскольку при этом возрастает стерическое отталкивание между объемистыми заместителями за счет уменьшения угла между ними от -120 до -109,5°.
Трихлороуксусный альдегид (хлораль) гидратирован полностью. Наличие электроноакцепторной трихлорометильной группы настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии водоотнимающих веществ (H2SO4 и др.). хлораль хлоральгидрат
Другой стабильный гидрат — нингидрин — используется в качестве реактива для обнаружения α-аминокислот (см. 12.1.4). Присоединение спиртов. Спирты при взаимодействии с альдегидами легко образуют полуацетали. При обработке полуацеталей избытком спирта в кислой среде могут быть получены ацетали (реакция напоминает синтез простых эфиров из спиртов).
альдегид полуацеталь
полуацеталь ацеталь
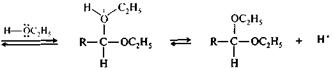
Роль кислотного катализа при превращении полуацеталя в ацеталь становится ясной из приведенной ниже схемы механизма реакции. Центральное место в схеме занимает образование карбокатиона (I), стабилизированного за счет участия пары электронов соседнего атома кислорода (+ М -эффект С2Н5О-группы). полуацеталь (I)
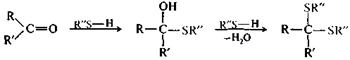
ацеталь Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксид-ион является более трудно уходящей группой, чем гидроксид-ион. Кетоны в аналогичных условиях кеталей не образуют. Следует отметить, что образование ацеталей часто используется в органическом синтезе как временная защита альдегидной группы. Присоединение тиолов. Тиолы активнее спиртов в реакциях с альдегидами и кетонами. Они образуют соответствующие тиоаналоги — полутиоацетали и дитиоацетали.
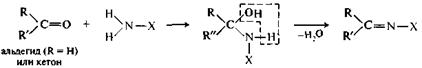
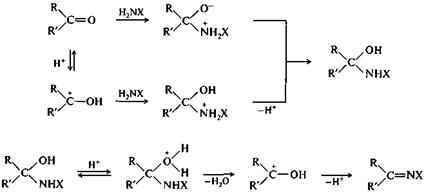
альдегид (R=H) полуацеталь дитиоацеталь или кетон Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общего вида NH2X реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. Поэтому данный процесс в целом классифицируют как реакцию присоединения—отщепления.
Амины и их производные реагируют с альдегидами и кетонами с образованием разнообразных соединений. В случае первичных аминов получаются имины (их называют также основаниями Шиффа). Имины — промежуточные продукты во многих ферментативных процессах, например биосинтезе α-аминокислот в организме (см. 12.1.4). Получение иминов протекает через стадию образования карбиноламинов, которые в некоторых случаях относительно устойчивы, например при взаимодействии формальдегида с α-аминокислотами (см. 12.1.4).
альдегид (R=H) первичный карбиноламин имин или кетон амин Имины являются промежуточными продуктами в общем способе получения аминов из альдегидов и кетонов путем восстановительного аминирования. Этот способ заключается в восстановлении смеси карбонильного соединения с аммиаком (или амином). Процесс протекает по схеме присоединения—отщепления с образованием имина, который затем восстанавливается в амин. Восстановительное аминирование осуществляется в организме в ходе синтеза α-аминокислот (см. 12.1.5).
альдегид (R=H) имин амин или кетон
При взаимодействии альдегидов и кетонов с гидроксиламином получаются оксимы, с производными гидразина — гидразоны. Эти реакции могут быть использованы для выделения альдегидов и кетонов из реакционной смеси и их идентификации, поскольку образующиеся производные, как правило, представляют собой кристаллические вещества с четкими температурами плавления.
альдегид (R=H) гидроксиламин оксим или кетон
альдегид (R=H) фенилгидразин фенилгидразон
или кетон альдегид (R=H) 2,4-динитрофенилгидразин 2,4-динитрофенилгидразон или кетон
Основания Шиффа и другие подобные соединения легко гидролизуются водными растворами минеральных кислот с образованием исходных продуктов. В большинстве случаев для реакций альдегидов и кетонов с азотистыми основаниями необходим кислотный катализ, ускоряющий дегидратацию продукта присоединения. Однако если слишком повысить кислотность среды, то реакция замедлится в результате превращения азотистого основания в нереакционноспособную сопряженную кислоту XNH3+. Поэтому оптимальным обычно является проведение процесса при рН, близком рКа этой сопряженной кислоты, т. е. в условиях, когда приблизительно половина азотистого основания остается в непротонированной форме. В случае низкоосновных азотистых оснований за счет кислотного катализа также происходит протонирование карбонильной группы субстрата, что повышает электрофильность карбонильного атома углерода и тем самым способствует его реакции с этими слабыми нуклеофилами.
Присоединение циановодородной кислоты. В присутствии следов щелочи циановодородная кислота присоединяется к альдегидам и кетонам с образованием α-гидроксинитрилов (циангидринов). альдегид (R=H) α-гидроксинитрил или кетон Эта реакция лежит в основе специфических методов получения α-гидрокси- иα-аминокислот.
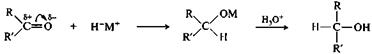
Присоединение гидридов металлов. Восстановление альдегидов и кетонов осуществляют с помощью комплексных гидридов металлов LiAlH4, KBH4. Реакция включает нуклеофильную атаку карбонильного атома углерода гидрид-ионом. При последующем гидролизе образовавшегося алкоголята получается первичный или вторичный спирт.
альдегид (R=H) комплексный первичный или или кетон гидрид металла вторичный спирт Дата добавления: 2015-02-06 | Просмотры: 1971 | Нарушение авторских прав |



 + I Н=0 + I R(R=Alk) + I -эффект двух R-групп
+ I Н=0 + I R(R=Alk) + I -эффект двух R-групп