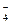|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Концепция жестких и мягких кислот и оснований (принцип ЖМКО)
Льюисовские кислоты и основания подразделяют на два типа: жесткие и мягкие. Такое деление часто называют принципом Пирсона, или принципом ЖМКО. Жесткие кислоты, более энергично, с образованием более прочных соединений реагируют с жесткими основаниями, а мягкие кислоты — с мягкими основаниями (принцип ЖМКО).
Классификация кислот и оснований по Пирсону
Понятия «жесткие» и «мягкие» кислоты и основания не равноценны понятиям сильные и слабые кислоты и основания. Это две независимые характеристики кислот и оснований. Суть принципа ЖМКО состоит в том, что жесткие кислоты преимущественно реагируют с жесткими основаниями, а мягкие кислоты - с мягкими основаниями. Это выражается в большей скорости реакции и в образовании более устойчивых соединений, так как взаимодействие между орбиталями с близкими энергиями эффективнее, чем между орбиталями, имеющими разную энергию. По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать электронную пару с образованием связи. Некоторые органические соединения обладают одновременно и кислотными и основными свойствами, т.е. являются амфотерными. Это обусловливает их межмолекулярную ассоциацию за счет водородных связей. Амфотерные соединения могут существовать в виде внутренних солей, как, например, α-аминокислоты и ароматические амино- сульфокислоты.
ГЛАВА 3. МЕХАНИЗМЫ РЕАКЦИЙ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Вопросы к занятию.
1. Классификация органических реакций. 2. Понятие о карбокатионе, свободном радикале, промежуточном комплексе. 3. Механизм реакции нуклефильного замещения SN1 и SN2. Реакции нуклефильного замещения у насыщенного атома углерода в ряду спиртов и галогеналкинов. 4. Механизм реакции электрофильного замещения на примере ароматических соединений (галогенирование, сульфирование, нитрование, алкилирование, ацилирование). 5. Механизм реакции электрофильного присоединения на примере реакции галогенирования (правило Марковникова), гидратации алкенов. 6. Реакции нуклеофильного присоединения и влияние заместителей на их протекание. 7. Реакции элиминирования (отщепления) на примере дегидратации, дегидрогалогенирования и их конкурентность реакциям нуклеофильного замещения.
Дата добавления: 2015-02-06 | Просмотры: 2925 | Нарушение авторских прав |
 , ClO
, ClO