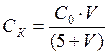|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Ход работыОпределяют порог коагуляции титрованием золя раствором электролита. В 6 пробирок одинакового диаметра наливают из пробирок по 5 мл приготовленного золя. Пробирки ставят в штатив. Сначала проводят коагуляцию золя электролитом с однозарядным ионом-коагулятором. Для этого берут в руки две пробирки с золем и прибавляют каплями из бюреток в одну – электролит, а в другую (контрольную) – воду. Пробирки встряхивают. Каждый раз сравнивая титруемый золь с контрольной пробиркой. Отмечают визуальные признаки коагуляции (потемнение или образование хлопьев) и фиксируют по бюретке отвечающий ей объём электролита. Опыт повторяют ещё два раза с оставшимися четырьмя пробирками. Затем аналогично проводят коагуляцию электролитами, содержащими двух- и трёхзарядные ионы-коагуляторы. Экспериментальные данные заносят в таблицу:
Пороги коагуляции вычисляют на основе экспериментальных данных по формуле:
где СК – порог коагуляции, моль/л; С0 – концентрация исходного электролита, моль/л; VK – объём электролита вызвавшего коагуляцию 5 мл золя, мл.
Итоговое занятие 1. Контрольные вопросы.
1. Теория строения органических соединений А.М. Бутлерова. 2. Электронное строение атома углерода и виды гибридизации. 3. Классификация и номенклатура органических соединений. 4. виды изомерии и органических соединений. Виды изомерии в органических молекулах. 5. Конформации молекул алифатического ряда: этана, бутана, этаноламина. Проекция Ньюмена. Энергетика образования конформеров. Конформации циклогексанового кольца. 6. Понятие о конфигурации молекул. Оптическая или зеркальная изомерия. Относительная и абсолютная конфигурации. Понятие о D и L изомерах. Формулы Фишера R- и S- системы. 7. Оптическая изомерия молочной и винной кислот. Энантиометрия и диастериометрия. 8. Понятие о сопряженных системах дивинила, бензола. Виды сопряжения. Понятие об ароматичности органических соединений (на примере бензола, пиридина, пиррола). Правило Хюккеля. 9. Электронные эффекты в молекулах: виды и механизмы передачи. 10. Классификация органических реакций по характеру субстрата и реагента. Электрофильные и нуклеофильные реагенты. 11. Гомологические реакции замещения у насыщенного атома углерода. Реакции SR на примере хлорирования метана. 12. Реакции нуклеофильного замещения у насыщенного атома углерода на примере галогенопроизводных. Механизмы SN1 и SN2. 13. Реакции электрофильного замещения /Se/ у ароматических соединений. Правило ориентации при замещении в ароматических производных. 14. Механизм реакции электрофильного присоединения /Ае/: галогенирование, гидрогалогенирование, гидратация, правило Марковникова. 15. Реакции нуклеофильного присоединения /АN/ по карбонильной группе. 16. Реакции отщепления Е (элиминирования). 17. Электронное строение карбонильной группы. Реакции присоединения НОН, HCN, R-OH, NaHSO3, H2 у альдегидов и кетонов. 18. Реакции присоединения-отщепления у альдегидов, кетонов. 19. Реакции окисления, полимеризации, альдольной конденсации, дисмутации карбонильных соединений. 20. Кислотность и основность органических соединений. Влияние заместителей на величину кислотности. 21. Электронное строение карбоксильной группы и карбоксилат-аниона. Сила кислот в гомологичном ряду монокарбоновых кислот. 22. Химические свойства монокарбоновых кислот. Механизм реакции этерификации. Жиры и мыла. 23. Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Сравнительная кислотность моно- и дикарбоновых кислот, химические свойства. Реакции замещения атома водорода в малоновом эфире. 24. Непредельные карбоновые кислоты – акриловая, кротоновая, фумаровая, малеиновая. Характерные свойства.
Итоговое занятие 2. Контрольные вопросы.
1. Оксикислоты. Номенклатура и изомерия оксикислот. Химические свойства: общие и специфические. 2. Важнейшие оксикислоты – гликолевая, молочная, винные кислоты, яблочная и лимонная. 3. Оксокислоты (альдегидо- и кетокислоты), Характерные химические свойства. 4. Важнейшие кетокислоты – пировиноградная, ацетоуксусная, щавелевоуксусная, a – кетоглутаровая кислоты, и их биологическая роль. Ацетоуксусный эфир и его кислотные свойства. 5. Фенокислоты, салициловая кислота и её производные, применение в медицине. Декарбоксилирование салициловой кислоты. 6. Аминоспирты. Химические свойства аминогруппы. Аминоспирты – этаноламин, холин, ацетилхолин. Строение, участие фосфолипидов и построение биологических мембран. 7. Аминокислоты, Строение, изомерия, номенклатура. Особенности строения природных аминокислот. Изоэлектрическая точка. 8. Аминокислоты. Химические свойства аминокислот – диссоциация, дегидратация, взаимодействие с HNO2, декарбоксилирование, дезаминрование, переаминирование. 9. Образование и строение пептидов. Понятие о первичной структуре белка. Вторичная и третичная структуры белков. 10. Качественные реакции на аминокислоты, пептиды, белки (цветные реакции). 11. Углеводы. Классификация и биологическая роль углеводов (с примерами). 12. Моносахариды. Строение. Стереоизомерия и таутометрия моносахаридов. 13. Моносахариды. Классификация и химические свойства. 14. Олигосахариды. Строение дисахаридов – мальтозы, лактозы, сахарозы. Восстанавливающие и не восстанавливающие дисахариды, химические свойства, биологическая роль. 15. Полисахариды. Крахмал, целлюлоза, гликоген. Строение и биологическая роль. 16. Понятие о гетероциклических соединениях. Их роль в биологии и медицине. Ароматическиий характер пяти- и шестичленных гетероциклов. 17. Пиразол, имидазол, тиазол. Строение и свойства. Производные азолов (пиразолон-5, антипирин, гистидин, гистамин). 18. Пиррол. Строение и свойства. Производные пиррола. Биологическая роль. Участие пиррольного ядра в построении протопорфинов. 19. Индол. Строение и свойства. Производные индола (триптофан, серотонин). Биологическая роль. 20. Шестичленные гетероциклы – пиридин, пиримидин. Строение и свойства. Производные пиридина (витамин РР), НАД+. 21. Хиполин. Строение и свойства. 22. Пиримидин. Строение и свойства. Производные пиримидина – урацил, цитозин, тимин, барбитуровая кислота, витамин В1. 23. Пурин. Строение и свойства. Производные пурина – ксантин, гипоксаптин, аденин, гуанин, мочевая кислота и её соли. 24. Нуклеотиды. Строение нуклеозидов – моно-, ди-, трифосфатов. Характер связи нуклеофильного основания с углеводным остатком. Гидролиз нуклеотидов. 25. Нуклеотидный состав ДНК и РНК. Биологическая роль. 26. Нуклеиновые кислоты. ДНК и РНК. Биологическая роль. 27. Липиды, их классификация и биологическая роль. 28. Терпены − как представители неомыляемых липидов. 29. Понятие о стероидах и стероидных гормонах. Итоговое занятие 3. Тема: «Физикохимия поверхностных систем. Физикохимия дисперсных систем».
Контрольные вопросы.
1. Поверхностная энергия. Поверхностное натяжение и её изотерма. Правило Траубе – Дюкло. Понятие об адсорбции. Уравнение Гиббса. Адсорбция на границе жидкость – газ, жидкость – жидкость. Уравнение Ленгмюра. Понятие о ПАВ и строение биомембран. Липосомы. Мицеллообразование в растворах. 2. Мономолекулярная и полимолекулярная адсорбции. Хемосорбция. Адсорбция на границе твердое тело – жидкость, твердое – газ. Уравнение Фрейндлиха. Адсорбция сильных электролитов. Иониты. Адсорбционная терапия. 3. Дисперсные системы, классификация. Природа коллоидного состояния. Получение и отчистка коллоидов. 4. Молекулярно-кинетические свойства коллоидных растворов (диффузия, броуновское движение, осмос). Оптические свойства (рассеяние света, цвет, ультрамикроскопия). 5. Механизм возникновения заряда в коллоидных частицах. Строение двойного электрического слоя. Мицелла, гранула, ядро. Электрический потенциал и влияние на него электролитов. 6. Электрокинетические явления (электрофорез, электроосмос). Уравнение Гельмгольца – Смолуховского. Применение электрофоретических методов в медицине. Потенциал протекания в седиментации. 7. Кинетическая и агрегатная устойчивость лиозолей. Факторы устойчивости. Коагуляция и определение её порога. Медленная и быстрая коагуляция. Правило Шульце – Гарди. 8. Теория коагуляции ДЛФО. Коагуляция смесями электролитов и взаимная коагуляция. Коллоидная защита. Пептизация. Применение в медицине этих явлений. 9. Понятие об аэрозолях. Особенности их оптических, молекулярно-кинетических и электрических свойств. Методы разрушения аэрозолей в медицине. Отрицательное воздействие аэрозолей на организм; силикоз, антракоз, аллергены, смог. 10. Свойства растворов ВМС. Особенности растворения ВМС. Форма макромолекул. Механизм набухания и влияние на процесс различных факторов. Аномальная вязкость растворов ВМС. Уравнение Штаудингера. 11. Осмотическое давление растворов, биополимеров. Уравнение Галлера. Полиэлектролиты. Изоэлектрическая точка. Онкотическое давление (плазмы крови). Устойчивость растворов биополимеров. Коацервация. Застудневание растворов ВМС. Свойства студней: синерезис, тиксотропия.
ЛИТЕРАТУРА ОСНОВНАЯ ЛИТЕРАТУРА
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА 1. В. И. Слесарев. Химия. Основы химии живого. С-Петербург, «Химиздат», 2000. 2. К.Н. Зеленин. Химия. С-Петербург, Химиздат, 1997. 3. Н.Л. Глинка. Задачи и упражнения по общей химии. Ленинград, «Химия», 1983. 4. А. И. Болдырев. Физическая и коллоидная химия. Москва, «Высшая школа», 1983. 5. К.А. Макаров, М.З. Штейнгарт. Сополимеры в стоматологии. М.; Медицина, 1982. 6. Профилактическая стоматология. М., Медицина, 2004. 7. Егоров А.С., Иванченко Н.М., Шацкая К.П. Химия внутри нас: Введение в бионеорганическую и биоорганическую химию. – Ростов н/Д: Феникс, 2004. – 192 с. 8. А.Э.Шарпенак, С.А.Косенко «Практикум по органической химии», 9. А.Я.Рево, В.В.Зеленкова «Малый практикум по органической химии», 10. Б.Н. Степаненко «Курс органической химии», 1979, стр. 354-364, 366- 11. «Руководство к лабораторным занятиям по биоорганической химии» 12. Т.Т. Березов, Б.Ф. Коровкин «Биологическая химия», 1982, раздел
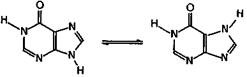
Следует обратить внимание, что в имидазольном кольце производных пурина в принципе возможна имин-иминная таутомерия (см. 24.3.1), например, для гипоксантина:
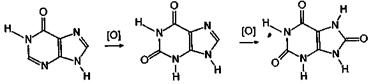
гипоксантин Действительно, такое равновесие имеет место. Превращение аденина в гипоксантин легко осуществляется ферментативным способом, поэтому гипоксантин обнаружен во многих тканях растений и животных. Как и аденин, гуанин в организме дезаминируется с образованием 2,6-диоксипурина, именуемого ксантином.
Ксантин представляет собой важное промежуточное звено азотистого обмена. Следует обратить внимание на то, что окисление гипоксантина приводит к ксантину, а из него, в свою очередь, при окислении возникает мочевая кислота.
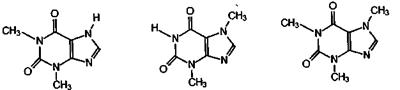
гипоксантин ксантин мочевая кислота Важными природными производными ксантина являются алкалоиды теофиллин, теобромин и кофеин, обнаруженные в чае, какао и кофе. Они представляют собой метильные гомологи ксантина, а именно, теофиллин - это 1,3-диметилксантин, теобромин представляет собой 3,7-диметилксантин, а кофеин - 1,3,7-триметилксантин.
1,3-диметилксантин 3,7-диметилксантин 1,3,7-триметилксантин теофиллин теобромин кофеин Искусственным путем теобромин и кофеин, оказывающие стимулирующее действие на центральную нервную систему, можно получить из ксантина.
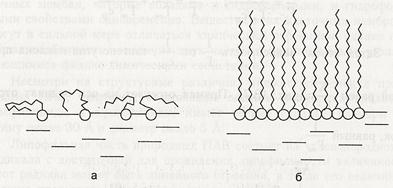
При малых концентрациях ПАВ углеводородные радикалы "лежат" на поверхности полярной жидкости, а полярные группировки погружены в нее(рис. а). При достижении предельной величины адсорбции Г∞ молекулы ПАВ образуют на поверхности мономолекулярный слой, в котором неполярные углеводородные радикалы располагаются перпендикулярно к поверхности ("частокол Ленгмюра", рис. б). В этом случае можно рассчитать площадь S, занимаемую одной молекулой, и длину молекулы l:
S = l __ и l= МГ ∞ NA∙Г∞ ρ где NА - число Авогадро, М и ρ - соответственно молекулярная масса и плотность адсорбтива. Следовательно, зная константу Г∞ из уравнения Ленгмюра, можно определять размеры молекул.
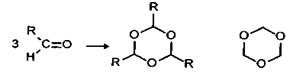
Молекулы ПАВ на поверхности воды: а - при малых концентрациях, б - в мономолекулярном слое. Полимеризация характерна только для простейших альдегидов и кетонов (формальдегид, ацетальдегид, ацетон). Формальдегид и ацетальдегид легко вступают в реакцию тримеризации:
R = H, CH 3 триоксиметилен Продукт тримеризации формальдегида - триоксиметилен - был открыт А. М. Бутлеровым. Триоксиметилен, так же как и тример ацетальдегида - паральдегид, деполимеризуется при нагревании. Формальдегид в водном растворе постепенно образует линейный полимер - параформ (п = 8-100):
Дата добавления: 2015-02-06 | Просмотры: 1660 | Нарушение авторских прав |