|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Сложные эфиры, имеющие приятный аромат
Гидролиз сложных эфиров. Реакция расщепления сложных эфиров на кислоту и спирт при действии воды происходит и в кислой, и в щелочной среде. Однако в присутствии щелочи реакция гидролиза (омыления) необратима, так как получается соль карбоновой кислоты, содержащая устойчивый ацилат-анион:
Реакция гидролиза сложных эфиров обратив реакции этерификации.
В отличие от обычных сложных эфиров, карбонильный атом углерода в тиоэфирах несет больший положительный заряд, что делает их более реакционноспособными. Вследствие этого связь С—S в ацилкоферменте А - макроэргическая. При гидролизе ацетилко-фермента А выделяется даже несколько большая энергия, чем при гидролизе АТФ (AG° = -32,9 и -30,5 кДж/моль соответственно): ацетилкофермент А уксусная кофермент А кислота Это обстоятельство способствует активности ацилкоферментов А в реакциях, протекающих в организме с их участием. Ацилирование спиртов сложными эфирами. Сложные эфиры взаимодействуют со спиртами с образованием нового сложного эфира. Эта реакция называется переэтерифи-кацией, а в биохимии ее называют реакцией трансацилирования. Реакция трансацилирования обычно катализируется кислотами, и в этих случаях она обратима
В организме реакция трансацилирования (переэтерификации) катализируется ферментами трансферазами, которые способствуют переносу ацилов от сложных эфиров на спирты, амины и другие субстраты. Источником ацилов обычно являются ацилкоферменты А, т. е. тиоэфиры карбоновых кислот. Одним из примеров реакции трансацилирования является синтез ацетилхолина с помощью ацетилкофермента А:
ацетилкофермент А холин
ацетилхолин кофермент А
Ацилирование аминов сложными эфирами. Сложные эфиры взаимодействуют с аммиаком или аминами (реакция аминолиза) с образованием амидов соответствующих карбоновых кислот:
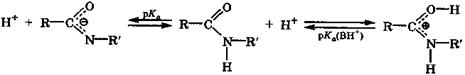
Кроме реакций нуклеофильного замещения (гидролиза и ацилирования) молекулы сложных эфиров вступают в реакции конденсации друг с другом с образованием связи С—С. В образовании новой связи участвуют углеродный атом карбонильной группы одной молекулы эфира и α-углеродный атом другой молекулы эфира. Эта реакция конденсации (С-ацилирования) сопровождается окислительно-восстановительными превращениями. Амиды Основность амидов [рКа(ВН+) = 0 ÷ -2] выше, чем сложных эфиров [рКа(ВН+) = -5 ÷ -6]. В то же время их основность значительно меньше основности аминов [рКа(ВН+) = 5 ÷ 10] ввиду иной гибридизации атомных орбиталей атома азота, способствующей сильному взаимодействию неподеленной электронной пары атома азота с двойной связью карбонильной группы (разд. 23.1). Если в молекуле амида имеется связь N—Н, то возможна его кислотная ионизация. Амиды являются слабыми NH-кислотами (рКа = = 13 ÷ 15), и их кислотность сравнима с кислотностью спиртов.
анион амида амид катион амида
Реакции нуклеофильного замещения. Амиды в присутствии щелочи или кислоты легко гидролизуются:
В кислой среде вследствие протонирования молекула амида активируется и может ацилировать спирты, образуя сложный эфир карбоновой кислоты и амин:
Реакции с электрофильными реагентами. Электрофильные реагенты атакуют в амидах кислородный атом карбонильной группы. Так, при нагревании амидов с сильными электрофилами (P2O5, РОС13) происходит внутримолекулярное отщепление молекулы воды с образованием нитрилов карбоновых кислот: ацетамид ацетонитрил
Отдельные представители амидов кислот.
Амиды угольной кислоты имеют очень большое значение. Как и все двухосновные кислоты угольная кислота дает неполный амид, называемый карбаминовой кислотой, и полный амид, называемый мочевиной H2N-C-NH2. ׀׀ О Мочевина в организме человека и млекопитающих животных является конечным продуктом азотистого обмена. Такие азотистые вещества, как белки и амирокислоты, претерпев в организме ряд превращений, в конце концов, выделятся с мочой в виде мочевины. В течение суток организм человека выделяет с мочой 20-30 г мочевины. В настоящее время в медицине применяют ряд ценных лекарственных веществ, в основе которых лежат амиды кислот, такие как бутамид, букарбан, хлорпропамид, глибенкламид и др., которые используются в качестве противодиабетических препаратов. Мочевина применяется как осмотический диуретик. Очень важное значение амиды имеют в стоматологической практике. Большинство стоматологических вмешательств сопровождается болевыми ощущениями большей или ме- ньшей интенсивности, поэтому анестезия – одна из наиболее актуальных прблем стоматологии. Учитывая высокую потребность в более совершенных местнообезболивающих препаратах, их разрабатывают ученые всех стран мира. Изучение полученных средств позволило заключить, что более длительно воздействуют местные анестетики группы амидов. В 1946 году шведскими учеными Lofgren и Lundquist был синтезирован местный анестетик, относящийся к группе амидов - ксилокаин (лидокаин ), который сразу же стал вытеснять новокаин. Спустя несколько лет были синтезированы меливакаин и в 1976 году – артикаин (ультракаин) – анестетик с уникальными свойствами. Ультракаин позволяет не только качественно и длительно обезболить стоматологическую процедуру, но и сократить количество посещений врача. Артикаин в 5 раз сильнее новокаина и в 2-3 раза сильнее популярных лидокаина и тримекаина. При некоторых видах анестезии длительность эффекта достигает 5-6 часов. Низкая токсичность ультракаина, безопасность и хорошая переносимость позволяет осуществлять длительные процедуры с его использованием. Нитрилы R—C=N. Нитрилы являются очень слабыми N-ocнованиями [рКа(ВН+) ≈ -10], поскольку их атом азота имеет sp-гибридизацию. Поэтому он более электроотрицателен и значительно сильнее удерживает свою неподеленную электронную пару, чем атом азота в других азотсодержащих соединениях. Нитрилы легко подвергаются гидратации в кислой или щелочной среде за счет нуклеофильного присоединения воды к сильнополярной тройной связи C=N с образованием амида соответствующей кислоты. Ацилирующего действия нитрилы не проявляют. Подобно другим производным карбоновых кислот нитрилы за счет α-водородного атома являются слабыми С—Н-кислотами, образующими карбанион на α-углеродном атоме. Такой карбанион легко присоединяется к карбонильным соединениям по реакции типа альдольной конденсации. Взаимные превращения производных карбоновых кислот. Рассмотренные производные карбоновых кислот склонны к взаимопревращениям за счет реакций нуклеофильного замещения у карбонильного углеродного атома. Это отражено на рис. 9. На схеме указаны типовые реагенты, при помощи которых из карбоновой кислоты могут быть получены ее производные. Реагенты, отмеченные кружком, позволяют получить соответствующие им ацилпроизводные из любых других, расположенных на схеме правее. Наиболее реакционноспособны галогенангидриды карбоновых кислот (ацилгалогениды), которые можно превратить в ангидриды, сложные эфиры или амиды обработкой их или солью кислоты, или спиртом, или аммиаком соответственно. Ангидриды кислот легко превращаются в сложные эфиры или амиды. В организме галогенангидриды или ангидриды карбоновых кислот не встречаются. Ацилкоферменты А по ацилирующей способности близки к ангидридам кислот. В организме они легко превращаются в сложные эфиры или амиды. Сложные эфиры действием аммиака или амина превращаются в амиды.
———————————————————————→ Возрастание реакционной способности в процессах гидролиза и ацилирования +δII << +δIII < +δI < +δIV < +δV< +δVI < +δVII
Рис. 9. Схема получения производных карбоновых кислот и их превращений
Дата добавления: 2015-02-06 | Просмотры: 1453 | Нарушение авторских прав |






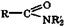 . В молекулах амидов имеет место сопряжение неподеленной электронной пары атома азота с π-системой двойной связи С=О (р, π-сопряжение). В результате связь С—N в амидах становится короче, чем в аминах, а длина связи С=О такая же, как в карбоновых кислотах, где имеет место аналогичное р, л-сопряжение. Благодаря сопряжению атомы амидной группировки находятся в одной плоскости и вращение по амидной связи С—N в значительной степени заторможено, так как эта связь имеет частично характер двойной связи.
. В молекулах амидов имеет место сопряжение неподеленной электронной пары атома азота с π-системой двойной связи С=О (р, π-сопряжение). В результате связь С—N в амидах становится короче, чем в аминах, а длина связи С=О такая же, как в карбоновых кислотах, где имеет место аналогичное р, л-сопряжение. Благодаря сопряжению атомы амидной группировки находятся в одной плоскости и вращение по амидной связи С—N в значительной степени заторможено, так как эта связь имеет частично характер двойной связи.