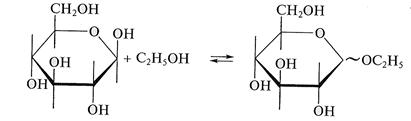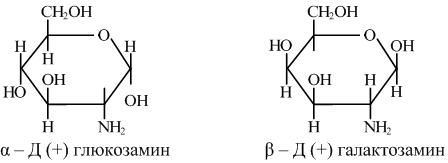|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Строение и свойства углеводовУглеводы входят в состав клеток и тканей растительных и животныхорганизмов. По массе углеводы составляют основную часть органического вещества на Земле. Углеводы в живой природе имеют большое значение как источники запасной энергии в метаболических процессах (в растениях - крахмал, в животных организмах - гликоген); структурные компоненты клеточных стенок растений (целлюлоза), бактерий (мурамин), грибов (хитин); составные элементы ряда жизненно важных веществ (нуклеиновые кислоты, коферменты, витамины). Некоторые углеводы и их производные являются лекарственными средствами. Углеводы составляют значительную долю пищи млекопитающих. Человек употребляет в сутки около 500 г углеводов. Представитель углеводов - глюкоза - содержится в растительных соках, плодах, фруктах и особенно в винограде. Она является обязательным компонентом крови и тканей животных и человека. Уровень содержания глюкозы в крови человека постоянен и находится в пределах 3,3-5,5 ммоль/л. Во всем объеме крови взрослого человека содержится 5 - 6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности. Пополнение содержания глюкозы в крови происходит за счет резервных углеводов (гликогена), запасаемых в печени и тканях. При некоторых патологических состояниях, например при заболевании сахарным диабетом, содержание глюкозы в крови повышается и избыток ее выводится с мочой. Источником углеводов для всех растений является фотосинтез. Животные организмы получают моносахариды из растительных источников, а затем используют их.
Классификация углеводов.
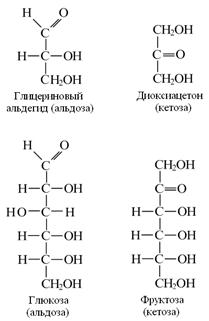
1. Моносахариды - это простейшие углеводы, которые не гидролизуются (глицериновый альдегид, рибоза, глюкоза). 2. Дисахариды подвергаются гидролизу и образуют два моносахарида (лактоза, сахароза, мальтоза). 3. Олигосахариды - сложные углеводы, при гидролизе дают от 2 до 10 молекул моносахаридов. 4. Полисахариды - высокомолекулярные углеводы, при гидролизе образуют сотни и тысячи молекул моносахаридов (крахмал, гликоген, гиалуроновая кислота, гепарин). Моносахариды являются полигетерофункциональными соединениями, в молекулах которых одновременно содержатся одна оксогруппа (альдегидная или кетонная) и несколько гидроксильных групп. Таким образом, с химической точки зрения моносахариды - это полигидроксиальдегиды или полигидроксикетоны. По характеру функциональных групп моносахариды делятся на альдозы и кетозы.
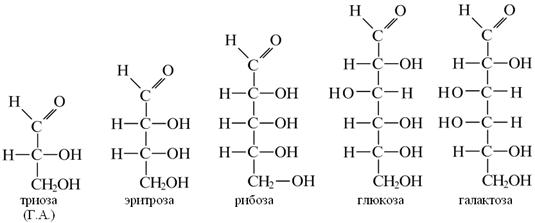
Поколичеству углеродных атомов моносахариды делятся на триозы, тетрозы, пентозы, гексозы, гептозы:
D и L - моносахариды. В молекулах моносахаридов обычно содержится несколько ассиметрических (хиральных) центров, что служит причиной существования большого числа стереоизомеров. Э.Фишер и русский химик М. Розанов приписывали условно конфигурации D и L - глицеральдегиду; как показали дальнейшие исследования, эти предположения совпали с истинными конфигурациями.
D(+) глицериновый альдегид L(-) глицериновый альдегид В соответствии с R, S - номенклатурой D - конфигурация соответствует R - глицеральдегиду, a L - S - глицеральдегиду. Моносахариды (монозы). Это гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды имеют молекулярную формулу Сn(Н20)n которая и послужила основой для названия данного класса соединений (углерод + вода). По своей структуре монозы относятся к полиоксиальдегидам, или альдозам (рис. 5.2), и полиоксикетонам, или кетозам. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов). В зависимости от строения карбонильной группы каждую из таких моноз обозначают альдотриоза, альдогексоза, кетогексоза и т.п. Оптическая изомерия моносахаридов. Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы — явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с п асимметрическими атомами углерода может существовать в виде 2n изомеров. В соединениях с одинаковыми асимметрическими атомами углерода число оптических изомеров уменьшается вследствие существования мезо- форм. Мезо-соединения оптически неактивны из-за «внутренней компенсации» знака вращения. Примером мезо- соединения является D-ксилит. Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют правовращающую D-форму (лат. dexter— правый), или (+)-форму, и левовращающую L-форму (лат. laevus — левый), или (-)-форму, — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами.
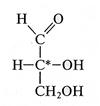
В качестве стандарта для определения принадлежности соединения стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде (асимметрический атом углерода обозначен звездочкой):
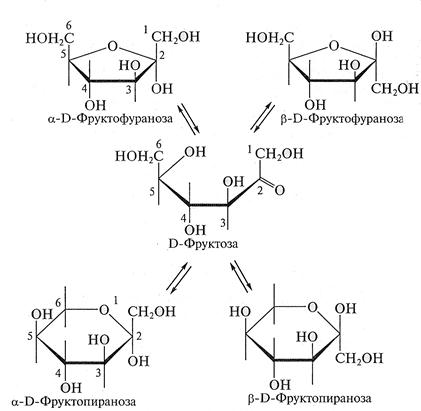
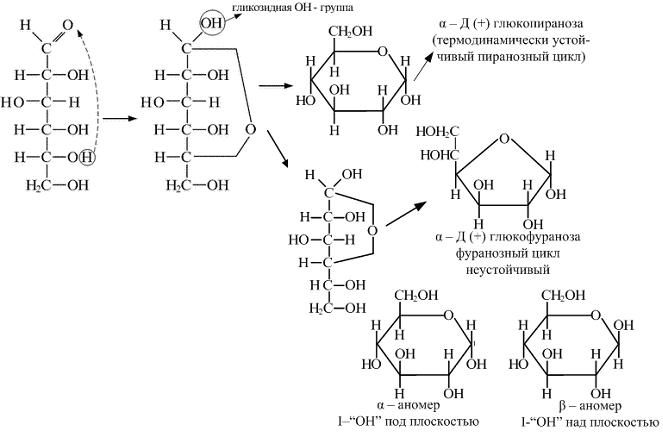
Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду. Цикло-оксо-таутомерия моносахаридов. В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических полуацеталей. Образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные). Таким образом, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси):
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса:
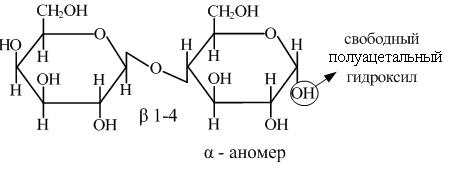
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны. В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1, в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа —ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют α-аномером, если не совпадает — β-аномером. Таким образом, α- и β-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм α ↔ β осуществляется только через открытую оксо-форму:
α-форма ↔ оксо-форма ↔ β-форма
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание α- или β-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как α-, так и β-D-глюкопираноз, содержит 36 % a-изомера и 64 % β-формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глюкозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме. Химические свойства моносахаридов. В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей. 1. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа. Моносахариды взаимодействуют со спиртами с образованием О-гликозидов. Так, при пропускании через раствор β-D-глюкозы в этаноле газообразного хлороводорода происходит образование смеси α- и β-аномеров — этил-α,β-D-глюкопиранозы:
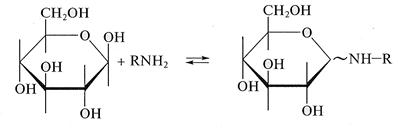
Молекула этанола выступает в данной реакции в роли нуклеофила. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов:
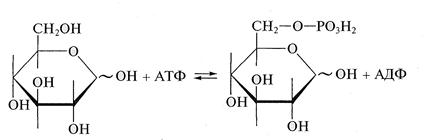
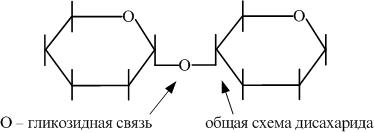
Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов— нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения. При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза. Биологически важный пример реакции данного типа — реакция фосфорилирования глюкозы — ферментативное взаимодействие глюкозы с аденозинтрифосфорной кислотой с образованием глюкозо-6-фосфата:
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты. 2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться: а) только карбонильная группа — «мягкое» окисление, например, бромной водой:
НО-СН2-(СНОН)n-СНО → НО-СН2-(СНОН)n— СООН Гликоновые кислоты б) карбонильная и первичная гидроксильная группа «жест кое» окисление, например, раствором HNO3:
НО-СН2- (СНОН)n- СНО → НООС-СН2-(СНОН)n-СООН Гликаровые кислоты
в) только первичная гидроксильная группа в мягких условиях при защите альдегидной группы:
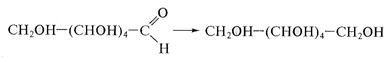
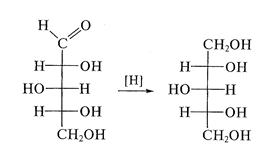
Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу. Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз (см. далее). Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме). Восстанавливающие моно- и дисахариды восстанавливают ионы меди(II), входящие в состав комплекса с винной кислотой (С4Н606; H2tart) — реактив Фелинга [Cu(tart)2]2- или в состав комплекса с лимонной кислотой (C6H807; H3cit) — реактив Бенедикта [Cu(cit)]-, до оксида меди(I) Cu2O, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов. 3. Моносахариды подвергаются химическому либо билогическому восстановлению. Восстановление моноз, как и всяких карбонильных соединений, приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты, называемые сахарными спиртами, или альдитами:
Помимо амальгамы натрия в водной (или водно-спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных полиола:
При восстановлении D-ксилозы образуется D-ксилит:
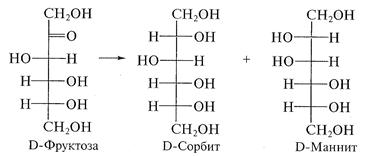
4. Реакция изомеризации (эпимеризации) всегда происходит по а-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается внутримолекулярным окислением — восстановлением (диспропорционированием) атомов углерода С, и С2. В ходе этой перегруппировки вследствие переноса протона, осуществляемого под влиянием гидроксильного иона, возникает промежуточное соединение - ендиол. Превращения ендиола могут привести к образованию как кетозы, так и двух альдоз. Таким образом, в результате реакции постепенно образуется равновесная смесь изомеров. Например, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы:
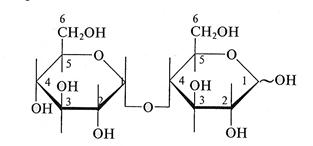
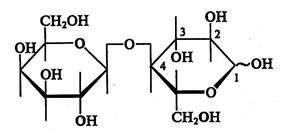
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза. Олиго- и полисахариды. Дисахариды (биозы) представляют собой продукт конденсации двух молекул моносахаридов, соединенных О-гликозидной связью. Например, структурную формулу мальтозы, которая является основным продуктом расщепления крахмала в полости рта под действием фермента слюны — β-амилазы, можно представить следующим образом:
Систематическое название (4-(α-D-глюкопиранозидо)-D-глюкопираноза) указывает на наличие гликозидной связи между имеющим α-конфигурацию атомом C1 одного остатка глюкозы и атомом С4 другого остатка. Мальтоза образуется в результате конденсации двух молекул a-D-глюкопиранозы с образованием гликозидной связи между атомом C1 α-аномера глюкозы и атомом С4 второй молекулы глюкозы. Такую связь называют а(1→4)-связью. Дисахариды, как любые гликозиды, способны к гидролитическому расщеплению в кислой среде. Наиболее биологически важными дисахаридами являются сахароза, мальтоза, лактоза и целлобиоза. Сахарозу (α-D-глюкопиранозидо-β-D-фруктофуранозид) называют также тростниковым сахаром; она содержится в тростнике, сахарной свекле, различных фруктах, ягодах и овощах. Систематическое название сахарозы отражает и конфигурацию обоих гликозидных (суффикс «озид» у названий обеих моноз) гидроксилов (α или β), и наличие связи C1 —C2:
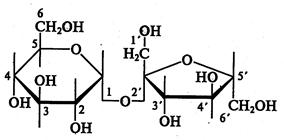
Лактоза (4-(β-D-галактопиранозидо)-D-глюкопираноза) имеет строение:
Целлобиоза (4-(β-D-глюкопиранозидо)-D-глюкопираноза) представляет собой основной структурный элемент целлюлозы; образуется при ферментативном гидролизе целлюлозы. Целлобиоза, как и лактоза, имеет 1,4-р-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе дает только D-глюкозу:
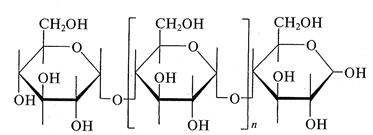
Продукты конденсации нескольких (от 2 до 12) молекул моносахаридов называют олигосахаридами; большего числа моносахаридов — полисахаридами. Если макромолекулы построены из остатков одного моносахарида, то такие полисахариды называют гомополисахаридами. Среди гомополисахаридов наиболее биологически важными являются поли-D-глюкопиранозы: амилоза, амилопектин, гликоген (дисахаридным фрагментом последних является мальтоза) и целлюлоза, структурным компонентом которой выступает дисахарид целлобиоза. Амилоза — это полимер неразветвленного строения (линейный полимер) молекулярной массой около 60 000; при нагревании растворяется в воде, образуя лиофильный коллоидный раствор; взаимодействует с йодом с образованием комплексного «соединения включения» синего цвета. Анализ методом светорассеяния и ультрацентрифугирования показал, что длина цепи молекулы амилозы часто достигает 6000 моносахаридных звеньев:
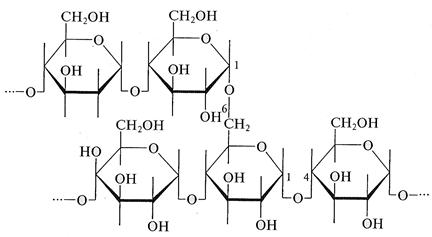
При ферментативном гидролизе β-амилазой, которая выделяется поджелудочной железой и содержится в слюне, амилоза расщепляется на глюкозу и мальтозу; гидролиз начинается с невосстанавливающего конца амилозы и осуществляется последовательным отщеплением молекул мальтозы. Амилопектин имеет разветвленную структуру и включает наряду с α(1→4)-связями и гликозидные α(1→6)-связи. За счет последних и образуются разветвления в структуре:
При растворении в воде амилопектин набухает, образуя связаннодисперсную систему — гель. С йодом амилопектин образует соединение красно-фиолетового цвета. Смесь амилозы (20 — 25%) и амилопектина (75 — 80%) представляет собой полисахарид природного происхождения — крахмал. Таким образом, природный крахмал не является индивидуальным веществом: он состоит их двух фракций, отличающихся по строению и вследствие этого обладающих различной растворимостью в теплой воде. Крахмал является основным резервным полисахаридом растений. Гликоген («животный крахмал») по структуре и свойствам похож на амилопектин, но имеет еще более разветвленную полимерную цепь и является резервным полисахаридом животных, запасаемым в печени и мускульной ткани. Гликоген является «двойником» крахмала в животном мире и играет роль депо питательных веществ и запасного углевода животных тканей. Одним из важнейших полисахаридов является целлюлоза. Она образует главную составную часть стенок растительных клеток. Целлюлоза представляет собой полимер, полностью состоящий из звеньев p-D-глюкопиранозы, которые связаны гликозидными Р(1→4)-связями. Целлюлоза — линейный полимер, цепи которой могут содержать более 10 000 звеньев:
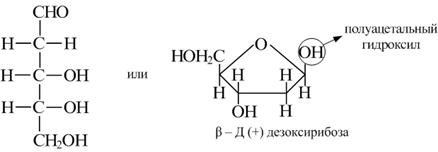
Чистая целлюлоза является белым волокнистым веществом, нерастворимым в воде, эфире или спирте. Такая устойчивость по отношению к растворителям объясняется уникальной структурой целлюлозы. Этот полисахарид состоит из остатков D-глюкозы, связанных только гликозидной β(1→4)-связью; молекулы целлюлозы нитевидные и не имеют разветвлений. Высокоупорядоченная структура, подтвержденная данными рентгеноструктурного анализа, обусловливает необычайную прочность и упругость целлюлозы, равно как и отсутствие растворимости в большинстве применяемых растворителей. Любопытно, что целлюлоза растворяется в реактиве, приготовленном смешиванием Сu(ОН)2 с концентрированным водным раствором аммиака (реактив Швейцера), а также в подкисленном растворе ZnCl2 при нагревании или в концентрированной серной кислоте, т. е. в тех средах, состав которых обусловливает возможность разрыва водородных связей в молекулах целлюлозы и образование новых связей с растворителем. Благодаря наличию свободных спиртовых гидроксильных групп целлюлоза способна реагировать со спиртами и кислотами с образованием эфиров. Целлюлоза выполняет функции структурного полисахарида, используемого организмом для построения остова клеточной ткани. ПРОИЗВОДНЫЕ МОНОСАХАРИДОВ (ДЕЗОКСИСАХАРА И АМИНОСАХАРА). В природе встречаются моносахариды, у которых одна гидроксильная группа заменяется чаще всего на Н или NH2 - группу. Важную роль играет 2 - дезоксирибоза, входящая в состав ДНК.
Аминосахара: при Сг - углеродном атоме ОН заменяется на NH2 - группу. Наиболее важными из них являются D(+) - глюкозамин и D(+) - галактозамин.
Циклические структуры моносахаридов Моносахариды могут существовать в циклической форме. Впервые предположение о циклическом строении глюкозы было высказано нашим соотечественником А.А. Колли (1870), а затем развито немецким ученым Б. Толленсом (1883). Пяти- и шестиуглеродные цепи углеводов могут иметь клешневидную конфигурацию и поэтому является возможным сближение двух функциональных групп - альдегидной (или кетонной) и гидроксильной у С4 или С5. За счет их внутримолекулярного взаимодействия по механизмунуклеофильного присоединения образуется циклический полуацеталь.
Формулы Хеуорса моносахаридов представляют их плоскими. Реальные формы имеют конформации аналогичные циклогексану - "кресла" и "лодки". (Нарисовать D - глюкозу в форме "кресла"). Реакции моносахаридов 1. Восстановление. 2. Окисление (до глюконовых и глюкаровых кислот) 3. Образование простых эфиров. 4. Образование сложных эфиров. 5. Образование озазонов. Написать данные реакции на примере глюкозы. ДИСАХАРИДЫ Дисахариды построены из двух простых сахаров, соединенных гликозидной связью.
Мальтоза - основной продукт гидролиза крахмала под действием фермента - слюнной амилазы. Одно из названий - "солодовый сахар". Систематическое название α - D(+) - глюкопиранозил - 1,4 - α — D(+) -глюкопираноза. Восстанавливающий дисахарид. Напишите структурную формулу мальтозы. Лактоза - содержание в молоке млекопитающих достигает 5%, поэтому одно из названий - "молочный сахар". Систематическое: β - D(+) -галактопиранозил - 1,4 - α - D(+) - глюкопираноза. Бывает 2 аномера лактозы – α и β
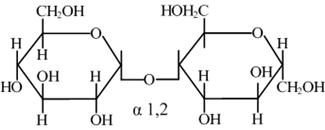
Сахароза - "свекловичный сахар". Невосстанавливающий углевод. Систематическое название: а - D(+) - глюкопиранозил - 1,2— β - D(+) -фруктофуранозид.
Полисахариды
Крахмал (С6Н10О5)n - представляет собой смесь двух гомополисахаридов, построенных из α- D(+) - глюкозы: амилозы (10-20%) и амилопектина (80-90%). В амилозе глюкопиранозные остатки связаны α - 1,4 - гликозидной связью. Цепь амилозы линейная, включает 200-1000 глюкозных остатков, молекулярная масса 40000-160000. Амилопектин имеет разветвленное строение. Моносахаридные звенья связаны α - 1,6 - гликозидной связью. Молекулярная масса амилопектина достигает 1-6 млн. Кислотный гидролиз крахмала дает только α - D - глюкозу. Составьте фрагмент молекулы крахмала. Гликоген (животный крахмал) в животных организмах является структурным и функциональным аналогом растительного крахмала. По строению он подобен амилопектину, но имеет еще большее разветвление цепей. Сильное разветвление молекулы способствует выполнению гликогеном энергетических функций, так как только при наличии большого числа концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы. Целлюлоза (клетчатка) - наиболее широко распространенный полисахарид растительного мира, имеет линейное строение. Мономером является β - D(+) -глюкоза. β - 1,4 - гликозидные связи не гидролизуются в организме человека. Дата добавления: 2015-02-06 | Просмотры: 2362 | Нарушение авторских прав |