 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Основание кислотаИз обратимости реакции следует, что каждая кислота (А—Н и В—Н), отдавая протон, превращается в основание (А- и: В) и, наоборот, каждое основание (: В и А-), присоединяя протон превращается в кислоту и (В—Н, и А—Н соответственно). Кислота А—Н и сопряженное основание А-, а также основание: В и сопряженная кислота В—Н, связанные процессами присоединения и отщепления протона, образуют кислотно-основные пары. Кислота и основание в кислотно-основной паре взаимосвязаны: чем сильнее (слабее) кислота, тем слабее (сильнее) сопряженое основание. Например, хлороводородная кислота НCl сильнее,чем циановодородная кислота HCN, и поэтому цианид-ион CN- будет более сильным основанием, чем хлорид-ион С1-. Кислоты Бренстеда. Кислотность обычно определяется по отношению к воде как к основанию. Количественно она оценивается константой равновесия (К) реакции, заключающейся в переносе протона от кислоты к основанию (протолитическая реакция):
CH3COOH + H2O <=> CH3COO- + H3O+ Уксусная Основание ацетат-ион ион гидроксония кислота (избыток) сопряженное (сопряженная
Константа равновесия этой реакции равна:
Концентрация воды постоянна, и произведение К-[ Н20] называют константой кислотности и обозначают Ка Таким образом, константа кислотности Ка определяется по следующему уравнению:
Чем больше величина Ка, тем сильнее кислота. Для уксусной кислоты Ка равна 1,75·10-5. Такие малые величины неудобны в практической работе, поэтому используют отрицательный логарифм —lg Ка= рКа (например, для уксусной кислоты рКя = 4,75). Очевидно, что чем меньше величина рКа, тем сильнее кислота. В зависимости от природы элемента, с которым связан протон, т.е. в зависимости от строения кислотного центра, бренстедовские кислоты делятся на четыре основные типа: О-Н -кислоты: карбоновые кислоты, фенолы, спирты; S-H - кислоты: тиолы; N-H -кислоты: амиды, амины, имиды; С-Н - кислоты: углеводороды и их производные.
Значение рКа некоторых кислот Бренстеда
Основания Бренcтеда Основания Бренcтеда для образования ковалентной связи с протоном должны содержать или электроны π-связи или свободную электронную пару, в качестве которой чаще всего используется n-электроны гетероатомов — О, N, S, галогенов и других элементов. Основания Бренcтеда делятся на две группы: π-основания и n-основания (ониевые). В π-основаниях, к которым относятся алкены, алкадиены, арены,центром основности, т.е. местом присоединения протона являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные связи не свободны. Ониевые основания (n-основания) классифицируются в зависимости от природы гетероатома, к неподеленной паре электронов которого присоединяется протон,т.е. в зависимости от центра основности: а) аммониевые (центр основности — б) оксониевые (центр основности — в) сульфониевые (центр основания — Следовательно: электрофильные реагенты, имеющие свободную орбиталь, можно рассматривать как кислоты, а нуклеофильные реагенты, имеющие избыток электронов, можно рассматривать как основания. Эти понятия сходные, но не идентичные. Различия: нуклеофильные регенты подают электроны на положительно заряженный углерод - карбокатион, а основания отдают электроны для связи с Н+ (протоном). Сильные основания не обязательно бывают хорошими нуклеофилами, и наоборот. Аналогичное рассуждение верно для электрофильных реагентов. Для характеристики органического соединения используют рКа (кислотность) и рКb (основность). Зависимость обратно-пропорциональная: чем слабее кислота, тем больше сила сопряженного с ней основания, и наоборот.
Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах Дата добавления: 2015-02-06 | Просмотры: 1560 | Нарушение авторских прав |
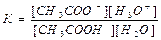
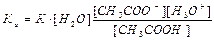





 <, =
<, =  —, =
—, =  H, простые эфиры r
H, простые эфиры r  , кетоны
, кетоны  , функциональные производные кислот
, функциональные производные кислот  (Х = ОR, NH2, галогены, например
(Х = ОR, NH2, галогены, например  );
); —) – тиоспирты R
—) – тиоспирты R