 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Реакции электрофильного присоединения, электрофильного замещенияЭлектрофильные реакции. Механизм электрофильных реакций заключается в атаке электрофила на нуклеофильный реакционный центр (N-центр). В качестве такого центра в молекуле субстрата чаще всего выступает кратная связь (sp- или Атакующая частица — электрофил — может образоваться в результате либо гетеролиза связи, например: Реакции электрофильного присоединения (АЕ). Различают два основных механизма реакций электрофильного присоединения. 1.
2. Карбкатионный механизм. Такой путь реакции реализуется при присоединении полярных частиц (HHal,
Реакция нестереоспецифична. При присоединении галогеноводородов их реакционная способность (и скорость реакции) снижается в ряду: HI, НВг, НС1, HF. Реакции гидратации (реакции присоединения воды) идут в условиях кислотного катализа. Кислоты образуют при ионизации ионы, обладающие довольно слабыми нуклеофильными свойствами:
Образование алкилоксониевого иона является лимитирующей стадией реакции. Кроме того, реакция может протекать по π - комплексному механизму, при котором на первой стадии образуется активированный комплекс:
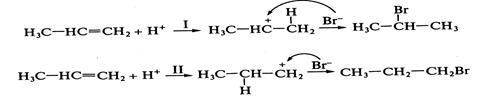
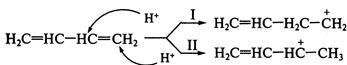
на который и направлена атака нуклеофила — молекулы воды. Рассмотрим два возможных пути присоединения бромоводорода к пропену:
На направление атаки электрофила 1.Перераспределение электронной плотности
Электрофил предпочтительно атакует атом углерода с повышенной электронной плотностью, т.е. реакция 2.Устойчивость образующихся карбкатионов. Образующийся в результате атаки по первому пути вторичный.карбкатион Следовательно, влияние обоих факторов приводит к образованию 2-бромпропана (первый путь). Кратко данный механизм определяется правилом В.В. Марковникова. При присоединении к несимметричным алкенам полярных реагентов типа НХ электрофильная частица протон (Н+ ) присоединяется к более гидрогенизированному атому углерода, а анион Х- - к менее гидрогенизированному атому углерода при двойной связи. На скорость реакции
Сопряжение увеличивает реакционную способность двойной углерод- углеродной связи в отношении электрофилов и соответственно повышает скорость реакций
Протонирование идет по второму пути, поскольку в этом случае образуется сопряженная система аллильного типа за счет взаимодействия электронодефицитного атома углерода с
Карбкатион аллильного типа является активным электрофильным алкилирующем агентом в живых организмах. Делокализация электронной плотности в результате образования сопряженной системы предопределяет два возможных направления атаки нуклеофилом:
Таким образом, в результате реакции образуется смесь продуктов 1,2-присоединения (второй путь) и 1,4-присоединения (первый путь), состав которой зависит от условий реакций. Соединения с тройной связью, содержащие атомы углерода в состоянии
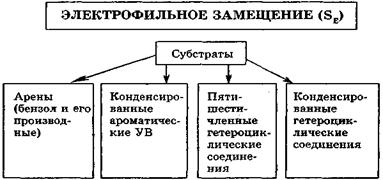
Реакции электрофильного замещения(SE). Для ароматических соединений бензольного рада, конденсированных и гетероциклических ароматических соединений характерны реакции электрофильного замещения.
Особенностью реакций SE является то, что атакующий реагент - электрофил - образуется на первой стадии реакции в присутствии кислот Льюиса (реакции галогенирования, алкилирования и ацилирования по Фриделю-Крафтсу) либо в условиях кислотного катализа (алкилирование алкенами и спиртами, нитрование), например:
Образовавшаяся электрофильная частица По этому механизму (SЕ) с выше перечисленными субстратами протекают реакции нитрования, сульфирования, алкилирования, галогенирования, ацилирования.
Механизм реакции SЕ на примере нитрования бензола: 1. Образование электрофильной частицы — иона нитрония (NO2+):
2. Образование π -комплекса:
бензол π -комплекс
3. Образование σ-комплекса
π - комплекс σ – комплекс
В σ -комплексе один углерод переходит в состояние sp3 гибридизации, ароматичность нарушается, комплекс неустойчив и стабилизация его происходит путем выброса Н+.
4. Образование нитробензола:
σ–комплекс мононитробензол
5. Н+ + НSO
Влияние заместителей на реакционную способность в ходе SE Однозамещенные бензола изомеров не имеют, но если в кольце появляются заместители, то симметрия кольца нарушена и с помощью квантово-механических расчетов удалось установить, что все заместители делятся на две группы:
Таким образом, как и в случае реакций
Дата добавления: 2015-02-06 | Просмотры: 1668 | Нарушение авторских прав |
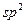 -гибридизованные атомы углерода), ароматическое (бензольное) ядро, поскольку в этих случаях имеется область повышенной
-гибридизованные атомы углерода), ароматическое (бензольное) ядро, поскольку в этих случаях имеется область повышенной  -электронной плотности.
-электронной плотности.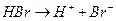 , либо поляризации ковалентной связи вблизи N-центра. В последнем случае образуется так называемый индуцированный (или наведенный) диполь:
, либо поляризации ковалентной связи вблизи N-центра. В последнем случае образуется так называемый индуцированный (или наведенный) диполь:  .
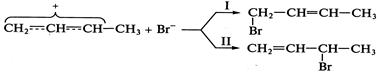
.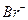 со стороны, противоположной
со стороны, противоположной 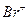 (так называемое антиприсоединение), что объясняется пространственными затруднениями из-за достаточно больших размеров атома брома (стадия II). Для реакции характерен кислотный катализ, в том числе катализ кислотами Льюиса:
(так называемое антиприсоединение), что объясняется пространственными затруднениями из-за достаточно больших размеров атома брома (стадия II). Для реакции характерен кислотный катализ, в том числе катализ кислотами Льюиса:
 и др.); лимитирующей стадией реакции является протонирование двойной связи (стадия I) с образованием карбкатиона, с последующей быстрой атакой нуклеофильной частицы (
и др.); лимитирующей стадией реакции является протонирование двойной связи (стадия I) с образованием карбкатиона, с последующей быстрой атакой нуклеофильной частицы (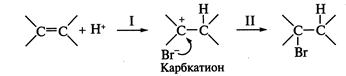
 . Образующийся при протонировании карбкатион атакуется нуклеофилом - молекулой воды — с образованием алкилоксониевого иона. Последний стабилизируется путем отщепления протона в результате гетеролиза связи О—Н, происходит «возврат катализатора», реакция обратима. Обратная реакция — катализируемая кислотами дегидратация спиртов:
. Образующийся при протонировании карбкатион атакуется нуклеофилом - молекулой воды — с образованием алкилоксониевого иона. Последний стабилизируется путем отщепления протона в результате гетеролиза связи О—Н, происходит «возврат катализатора», реакция обратима. Обратная реакция — катализируемая кислотами дегидратация спиртов: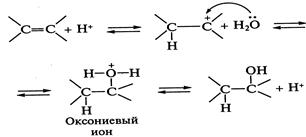
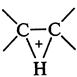
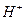 влияют прежде всего два фактора.
влияют прежде всего два фактора. ):
):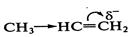
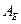 будет протекать по первому пути.
будет протекать по первому пути. является более устойчивым, чем первичный
является более устойчивым, чем первичный 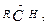 - продукт атаки электрофила по второму пути. Еще большей устойчивостью
- продукт атаки электрофила по второму пути. Еще большей устойчивостью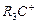 .
.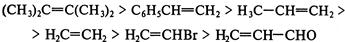
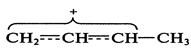
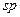 -гибридизации, в целом менее реакционноспособны в реакциях
-гибридизации, в целом менее реакционноспособны в реакциях 
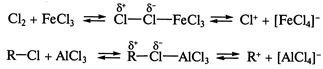
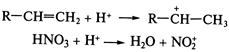
 атакует нуклеофильный центр - бензольное ядро. В результате атаки образуется неустойчивая структура (
атакует нуклеофильный центр - бензольное ядро. В результате атаки образуется неустойчивая структура ( -комплекс) с нарушенной системой кругового сопряжения. Эта стадия является лимитирующей (стадия I). Стабилизация структуры происходит путем отщепления протона от
-комплекс) с нарушенной системой кругового сопряжения. Эта стадия является лимитирующей (стадия I). Стабилизация структуры происходит путем отщепления протона от 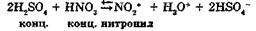
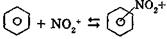

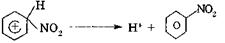
 → Н2SO4 (регенерация катализатора)
→ Н2SO4 (регенерация катализатора)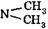 ,
–О–R; –NHR; Cl; Br; I. Заместители I рода
направляют вновь прибывающие группы в орто- и пара-положения
,
–О–R; –NHR; Cl; Br; I. Заместители I рода
направляют вновь прибывающие группы в орто- и пара-положения
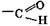 ,
, 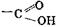 , –SO3H, –NО2; –С≡Н;
, –SO3H, –NО2; –С≡Н; 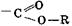 Заместители II рода направляют прибывающие группы в метаположение
Заместители II рода направляют прибывающие группы в метаположение
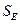 оказывает влияние структура субстрата, т. е. окружение реакционного центра. Так, электронодонорные заместители (+I-, +М-эффект) увеличивают электронную плотность в бензольном ядре, что приводит к росту реакционной способности субстрата; такие заместители ориентируют электрофил в реакциях
оказывает влияние структура субстрата, т. е. окружение реакционного центра. Так, электронодонорные заместители (+I-, +М-эффект) увеличивают электронную плотность в бензольном ядре, что приводит к росту реакционной способности субстрата; такие заместители ориентируют электрофил в реакциях