 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Профилактика тяжелых форм гестозовПрофилактические мероприятия целесообразно проводить на доклиническом этапе у пациенток группы риска развития гестозов, в которую входят беременные с экстрагенитальной патологией (нарушение жирового обмена, гипертоническая болезнь, патология почек, эндокринопатии, частые инфекции верхних дыхательных путей, сочетанная экстрагенитальная патология), наличием гестоза в предыдущие беременности, профессиональных вредностей и социальных факторов риска. Профилактические мероприятия по предупреждению гестозов в группе риска должны начинаться в I триместре с 8—9 нед. При этом применяются режим с соблюдением "bed rest", диета, комплекс витаминов, лечение экстрагенитальной патологии по показаниям. Рекомендуется соответствующая диета, энергетическая ценность которой не превышает 3000 ккал, с включением продуктов молочно-растительного и животного происхождения. Пищевые продукты применяются отварными, умеренно недосоленными, с исключением острых, жареных блюд, вызывающих чувство жажды. Количество жидкости составляет 1200—1300 мл/сут. Все беременные должны получать витамины в виде травяных витаминных сборов или в таблети-рованном виде. С 13—14 нед в профилактический комплекс необходимо дополнительно вводить травы, обладающие седативными свойствами (валериана, пустырник), нормализующие сосудистый тонус (боярышник) и функцию почек (почечный чай, березовые почки, толокнянка, лист брусники, спорыш, кукурузные рыльца). В указанный комплекс дополнительно по показаниям включают спазмолитики (эуфиллин, папаверин). Для исключения дефицита калия, кальция, магния используют лекарственные средства (аспаркам, па-нангин) или пищевые продукты (изюм, курага). С 15—16 нед беременным группы риска развития гестоза в профилактический комплекс следует дополнительно включать дезагреганты (трентал, агапурин, курантил, аспирин), антиоксиданты (витамин Е, глутаминовая кислота), мембраностабилизаторы (эссенциале-форте, липостабил, рутин). Продолжительность применения лекарственных препаратов составляет 3—4 нед. После применения дезагрегантов, мембраностабилизаторов в течение 3—4 нед при удовлетворительном состоянии беременных и нормальных темпах роста плода возможен перерыв в приеме препаратов на 1—2 нед. В указанный период для стабилизации состояния возможно использование фитосборов с повторным назначением дезагрегантов и мембраностабилизаторов. Если, несмотря на проведение профилактических мероприятий, у беременной появляются ранние симптомы гестоза, она должна быть госпитализирована в стационар. Профилактический комплекс, включающий фитосборы, дезагреганты и мембраностабилизаторы, должен обязательно назначаться после выписки из стационара в период ремиссии гестозов.
ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА Основой изосерологической несовместимости крови матери и плода является неоднородность у них антигенных факторов эритроцитов крови, чаще по системе резус, реже по системе АВО. Вследствие проникновения факторов крови плода, обладающих антигенными свойствами, в кровоток матери, у которой они отсутствуют, в ее организме вырабатываются аллоиммунные антитела, которые через плаценту проникают к плоду, и в его организме возникает реакция антиген—антитело. Подобная реакция приводит к агглютинации и гемолизу эритроцитов плода, анемии, образованию непрямого билирубина — к гемолитической болезни плода и новорожденного (ГБП и ГБН). При изосерологической несовместимости крови матери и плода заболевание может проявляться как во время беременности (ГБП), так и после рождения ребенка (ГБН). Гемолитическая болезнь (синоним: эритробластоз) нередко является причиной смерти плода и новорожденного, повышенной заболеваемости в постнатальном периоде и последующие годы жизни. Значительное снижение перинатальной смертности и заболеваемости детей было достигнуто благодаря применению заменного переливания крови новорожденным с ГБН, а также введением матери антирезус-иммуноглобулина (Rh IgG) после прерывания беременности любым путем (аборт, внематочная беременность, роды). Введенный Rh IgG связывает Rh-антигены, которые могут поступать в кровоток матери при прерывании беременности, и тем самым предотвращает выработку материнских антител и Rh-иммуни-зацию. Издавна акушеры знали о заболеваниях (семейная желтуха, эритробластоз) новорожденных, сопровождающихся желтухой, нередко со смертельным исходом. Однако причина и патогенез гемолитической болезни стали известны только с 1940 г., когда американские ученые K.Landsteiner и A.Wiener обнаружили белковый фактор в эритроцитах, который обладал антигенными свойствами. Этими учеными в эксперименте было показано, что эритроциты обезьян (макака-резус) при введении кроликам вызывали у последних выработку антител. Реакция антиген—антитело (сыворотка иммунизированного кролика и эритроциты человека), выражающаяся в агглютинации, была обнаружена у 15 % людей. У остального населения подобный антиген, названный D-фактором, резус-фактором (Rh), содержится в эритроцитах, а также может быть в лейкоцитах, тромбоцитах и других клетках тканей. В последующем было доказано, что, помимо резус-фактора, в эритроцитах могут быть обнаружены и другие антигены, качественно отличающиеся друг от друга, — С (Rh') и Е (Rh"). Антиген С (Rh') содержится в крови 70 % людей, антиген Е (Rh") — 30 %. По существу кровь может считаться резус-отрицательной только в тех случаях, когда в ней отсутствуют все 3 разно- шшшш видности резус-фактора. Резус-отрицательная кровь не лишена антигенных свойств, в ней обнаруживают связанные с эритроцитами аллели антигенов С, D, Е: с, d, e (система Нг), из них только антиген с может иметь значение в развитии иммуноконфликта в системе мать—плод. Сложность системы резус обусловливается большим количеством мутаций каждого гена. Наследование резус-антигенов определяется серией аллельных генов, расположенных на одной хромосоме, причем гены D и d, Сие, Еие находятся во взаимоисключающих отношениях. Присутствие D-антигена на эритроцитах обусловлено геном D, который имеет аллель d. Таким образом, возможны 3 генотипа: DD — гомозиготный, Dd — гетерозиготный и dd — гомозиготный. Все 3 гена одной хромосомы наследуются одновременно. Гемолитическая болезнь плода и новорожденного может развиться также при несовместимости крови матери и плода по система АВО. Антигены А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных а- и р-антител соответственно и развитию у плода реакции антиген—антитело (Аа, ВР). При этом иммунологическая несовместимость проявляется в том случае, если у матери 0(1) группа крови, а у плода — А(П) или В(Ш). Групповая несовместимость крови матери и плода встречается чаще (1 случай на 200—256 родов), но ГБП и ГБН протекают легче. Это объясняется защитной функцией околоплодных оболочек и околоплодных вод. Значительно реже ГБП и ГБН возникают при несовместимости крови матери и плода по другим эритроцитарным антигенам: Келл (К, к), Даффи (Fya—Fyb), Кидд (Ika), MNSs, PP, Лютеран (Lua—Lub), Льюис и др. Гемолитическая болезнь плода. Этиология и патогенез. ГБП и ГБН развиваются в том случае, если кровь матери резус-отрицательная, а кровь плода резус-положительная. Однако заболевание возможно также при резус-положительной крови матери и резус-отрицательной крови плода, при сенсибилизации к антигену с. Как правило, ГБП и ГБН возникают после предшествующей резус-иммунизации, которая может наступить после попадания даже небольшого количества эритроцитов, содержащих Rh, в кровоток матери: переливание крови без учета резус-принадлежности, внутримышечное введение крови, а также попадание резус-положительных эритроцитов в кровоток матери во время предыдущей или настоящей беременности, сопровождающейся нарушением целости ворсин хориона или плаценты. Резус-фактор формируется в ранние сроки беременности (по некоторым данным, начиная с 3—8-го дня беременности), эритроциты плода в крови беременных могут появляться при сроке 6—8 нед. Продолжительность циркуляции эритроцитов плода в кровотоке матери точно не установлена, однако известно, что аборты в ранние сроки гестации и внематочная беременность способствуют иммунизации — выработке антител в материнском организме. Роды особенно часто являются причиной попадания антигенов в кровоток матери с ее последующей сенсибилизацией. Опасность сенсибилизации увеличивается при оперативных родах, особенно во время кесарева сечения и ручного отделения плаценты. В меньшей степени вероятно попадание эритроцитов плода в кровоток матери в процессе беременности, но и это не исключено при наличии факторов, способствующих нарушению целости ворсин хориона и плаценты: амниоцентез, угроза прерывания бе- ременности, предлежание плаценты, отслойка плаценты, наружный поворот плода, внутриутробная смерть плода. Даже небольшое количество антигена, попадающее в кровоток матери, может оказать выраженное сенсибилизирующее воздействие, вызвать выработку антител. Иммунизация может произойти и в процессе первой беременности, так как эритроциты плода могут попасть в кровоток матери, начиная с I триместра (6,7 %). Во II триместре гестации эритроциты плода обнаруживают у 15,9 %, в III — у 28,9 % беременных. Для иммунизации достаточно введения женщине с резус-отрицательной кровью 0,1 мл резус-положительной крови (этот факт доказан G.K.Cohen и соавт. в 1964 г. в экспериментах на добровольцах). Раз возникнув, антитела не исчезают, и чувствительность к повторному попаданию в организм резус-положительных эритроцитов велика. После первой беременности иммунизируются 10 % женщин, но и при последующих беременностях возможна иммунизация такого же числа женщин, если она не произошла после первой беременности. Тяжесть течения ГБП во многом зависит от вида антител, продуцируемых иммунной системой матери. Основную роль в развитии ГБП играют неполные антитела, относящиеся к IgG, которые легко проникают через плацентарный барьер. Полные антитела, относящиеся к IgM, имеют большую молекулярную массу и практически не проникают через плацентарный барьер. Антирезус-антитела матери, попадая в кровоток плода, вызывают агглютинацию его эритроцитов или сначала их блокаду, а затем агглютинацию. В последующем независимо от варианта воздействия комплексы эритроцитов разрушаются, выделяется большое количество непрямого билирубина, возникают анемия и гипербилирубинемия. Если эритроциты не разрушаются в кровяном русле, то они накапливаются в селезенке и там подвергаются гемолизу под воздействием фагоцитов. Обычно в том случае, если в организме появляется непрямой билирубин, он быстро переводится в прямой путем присоединения двух молекул глюкуроновой кислоты, вырабатываемой в печени. Прямой билирубин выводится почками. Непрямой билирубин плода может в определенном количестве выводиться трансплацентарно, а затем переходить в прямой в организме матери. Однако часть непрямого билирубина циркулирует в организме плода, чему способствует функциональная незрелость его печени. Кроме того, увеличение очагов эритропоэза в печени, расширение желчных протоков желчью, подвергшейся сгущению, приводят к изменению паренхимы печени и нарушению ее архитектоники. Последствиями этого являются уменьшение продукции протеинов в печени, гипопротеинемия, портальная гипертензия, асцит и генерализованные отеки. У плода при гемолитической болезни наряду с гипербилирубинемией возникают анемия и, следовательно, тканевая гипоксия с ацидозом. Непрямой билирубин является жирорастворимым, поэтому легко проникает в ткани, богатые липидами, подавляя ферментативные процессы. В связи с этим при гипербилирубинемии часто поражается мозговая ткань, особенно ядра головного мозга. В зависимости от степени иммунизации ГБП может развиться в различные сроки беременности, иногда очень рано, начиная с 22—23 нед. При любом сроке беременности могут отмечаться наиболее тяжелые проявления заболевания — общая водянка, отечная форма ГБП. Чаще же заболевание возникает в первые часы и дни после рождения. В зависимости от степени тяжести заболевание может проявляться в анемической, желтушной форме и форме универсального отека. При всех формах выражена анемия. При ГБП вследствие анемии, гипербилирубинемии, тканевой гипоксии, ацидоза нередко наблюдаются нарушения сердечной деятельности и состояния ЦНС. При ГБП беременность на всем протяжении может осложняться угрозой ее прерывания (поздний выкидыш, преждевременные роды). Диагностика основывается на выявлении ряда признаков, связанных с иммунизацией матери, развитием гипербилирубинемии, анемии и гипоксии плода. При определении тактики врача во время беременности, выборе способа и сроков родоразрешения, помимо выявления ГБП, очень важна оценка степени тяжести заболевания. Важным признаком является обнаружение антител в крови матери. Этот диагностический тест не является абсолютным, так как антитела не исчезают после их выработки в организме матери, даже если в последующем не развивается заболевание плода или если у плода резус-отрицательная кровь. Однако в комплексе с другими признаками наличие антител позволяет с некоторой долей вероятности предположить ГБП. Определенное значение имеет динамика титра антител. Титр антител отражает наибольшее разведение сыворотки крови (1:2, 1:4, 1:8, 1:16 и т.д.), при котором еще происходит гемолиз добавляемых к ней резус-положительных эритроцитов. Во время беременности титр антител может повышаться, несколько снижаться и колебаться. Нарастание титра антител не всегда определяется повышением степени иммунизации, иногда это объясняется попаданием их в кровяное русло из других клеток, а снижение — наоборот, связыванием их клетками. Тем не менее повышение титра антител, особенно значительное (на 3—4 порядка), учитывают как косвенный признак ухудшения течения ГБП. Гипербилирубинемия и анемия являются одними из основных признаков ГБП, поэтому чрезвычайно важно определение степени их выраженности, о чем с известной долей вероятности можно судить по оптической плотности билирубина (ОПБ) в околоплодных водах. ОПБ повышается по мере увеличения концентрации билирубина, экскретируемого почками плода. Околоплодные воды получают путем пункции передней стенки живота, матки, околоплодных оболочек (см. Амниоцентез). В околоплодных водах определяют ОПБ, титр антител, в случае необходимости — группу крови плода. При последнем амниоцентезе перед ро-доразрешением околоплодные воды исследуются на степень зрелости легких плода (пенный тест по методу Клеманса или определение соотношения содержания лецитина и сфингомиелина). ОПБ устанавливают с помощью спектрофотометрии при длине волны 450 нм по отношению к дистиллированной воде. При этом нормальная величина билирубинового пика, как правило, не превышает 0,1. При ОПБ от 0,1 до 0,15 можно предположить наличие ГБП легкой степени. В том случае, если ОПБ составляет от 0,15 до 0;2, можно ожидать рождение ребенка со средней и тяжелой формой гемолитической болезни. ОПБ от 0,2 и выше, как правило, свидетельствует о развитии у плода тяжелой формы ГБП либо его внутриутробной гибели. При оценке ОПБ могут быть получены ложноположительные результаты вследствие попадания в иглу крови матери (при производстве амниоцентеза), мекония, мочи или асцитической
жидкости плода. ОПБ может быть снижена при разведении билирубина большим количеством околоплодных вод при многоводии, что нередко наблюдается при ГБП. Более точно оценить тяжесть гемолитического процесса можно при исследовании ОПБ амниоти-ческой жидкости при различных длинах волн света — от 300 до 700 нм. В таких случаях вычисляют ЛЕ, наносят на график, разделенный на 3 зоны в зависимости от степени тяжести гипербилируби-немии и срока гестации. От того, в какую зону попадает установленное значение ОПБ, зависит дальнейшая тактика врача (рис. 15.1). Важную роль в диагностике ГБП имеет УЗИ, которое целесообразно проводить в следующие сроки беременности: 20—22, 24— 26, 30—32, 34—36 нед и непосредственно перед родоразрешением. УЗИ позволяет выявить изменения как плаценты, так и плода. В зависимости от степени тяжести заболевания наблюдается увеличение толщины плаценты (в норме она зависит от срока гестации, составляя в III триместре в среднем 34—36 мм). Превышение нормальной для срока гестации толщины плаценты на 0,5—1,0 см и более указывает на возможное заболевание плода, в связи с чем требуется провести повторное УЗИ. При отечной форме ГБП толщина плаценты может достигать 60—80 мм. При гемолитической болезни УЗИ позволяет выявить у плода увеличение размеров печени и селезенки. Признаками отечной формы гемолитической болезни являются выраженная гепатоспленомегалия, асцит, много-водие (рис. 15.2). При выраженной водянке плода отмечаются, кроме того, кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхо-генность кишечника вследствие отека его стенки, отек подкожной жировой клетчатки в области головы и конечностей плода. Дополнительными ультразвуковыми критериями оценки степени тяжести заболевания плода могут служить расширение вены пуповины (до 10 мм и более), повышенная скорость кровотока в нисходящей части аорты плода (скорость обратно пропорциональна содержанию гемоглобина у плода). В связи с тем что плод при ГБП переносит гипоксию, степень выраженности которой увеличивается по мере нарастания тяжести заболевания, важно получить информацию о его функциональном состоянии. С этой
Рис. 15.2. Эхограмма. Отечная форма гемолитической болезни плода, а — брюшная стенка плода; б — печень; в — асцитическая жидкость. целью проводят определение биофизического профиля по видоизмененной шкале Vintzileos (1983). В отличие от маловодия, которое является неблагоприятным фактором у беременных без изосерологической несовместимости, при наличии таковой учитывают степень многоводия, а вместо степени зрелости плаценты — ее толщину. Остальные критерии шкалы (сердечная деятельность, дыхательные движения, двигательная активность, тонус) оцениваются по стандартной схеме (см. Дополнительные методы исследования. Определить наличие и степень тяжести ГБП возможно, проводя анализ крови плода, полученной из сосудов пуповины путем ее пункции (кордоцентез; см. Дополнительные методы исследования). Кордоцентез позволяет произвести непосредственное исследование пу-повинной крови с определением группы крови и резус-принадлежности плода, уровня гемоглобина, билирубина, сывороточного белка и гематокри-та, прямой пробы Кумбса. Наиболее важным критерием ГБП считают ге-матокрит (Ht), который, с одной стороны, свидетельствует о степени гемолиза, а с другой, является показателем компенсаторных возможностей ге-
мопоэза. Снижение Ht на 10—15 % указывает на тяжелую форму ГБП (в норме Ht до 26 нед составляет 35 %, позднее — от 38 до 44 %). Ведение беременности и родов. У всех беременных при первом посещении врача определяют (или проверяют) группу и резус-принадлежность крови. У беременных с группой крови 0(1) в том случае, если у мужа иная группа, необходимо исследовать кровь на наличие групповых иммунных антител. У пациенток с резус-отрицательной кровью следует, начиная с ранних сроков, проводить анализ крови на наличие антител и определения их титра: до 20 нед беременности 1 раз в месяц, в последующем 1 раз в 2 нед. Для установления предполагаемой резус-принадлежности плода выявляют наличие резус-фактора у отца. Необходимо также проведение непрямой реакции Кумбса, которая позволяет определить, какие антитела циркулируют в крови, связанные или свободные. В отсутствие антител до 28 нед беременности многие исследователи рекомендуют беременным с резус-отрицательной кровью с профилактической целью внутримышечно вводить 300 мг Rh Ig, который может блокировать резус-антитела. Важно, чтобы препарат, содержащий антитела, не проходил через плаценту. Определение состояния плода на основании результатов оценки биофизического профиля и УЗИ проводят еженедельно, начиная с 31—32 нед. У беременных группы высокого риска развития ГБП (наличие в анамнезе у беременных с резус-отрицательной кровью поздних выкидышей, преждевременных родов, мертворождений, ГБН, переливания крови без учета Rh-принадлежности). УЗИ нужно проводить ежедневно или с интервалом 1—2 дня. С целью снижения сенсибилизации матери эритроцитами плода всем беременным с резус-отрицательной кровью даже в отсутствие у них резус-антител, а также при наличии АВО-сенсибилизации рекомендуется провести 3 курса неспецифической десенсибилизирующей терапии по 10—12 дней при сроке 10—12, 22—24, 32—34 нед. Женщины, у которых наблюдается осложненное течение беременности (угроза прерывания, токсикозы, гесто-зы), должны быть госпитализированы в отделение патологии беременных, где наряду с лечением основного заболевания проводят курс десенсибилизирующей терапии. Неспецифическая десенсибилизирующая терапия включает внутривенное введение 20 мл 40 % раствора глюкозы с 2 мл 5 % раствора аскорбиновой кислоты, 2 мл 1 % раствора сигетина и 100 мг кокарбоксилазы. Внутрь назначают рутин по 0,02 г 3 раза, теоникол по 0,15 г 3 раза или метионин по 0,25 г и кальция глюконат по 0,5 г 3 раза, препараты железа (ферроплекс по 1—2 драже 3 раза и др.), токоферола ацетат (витамин Е) по 1 капсуле. На ночь рекомендуется применять антигистаминные препараты (0,05 г димедрола, 0,025 г супрастина). Беременным, в анамнезе которых имеются самопроизвольные выкидыши и роды плодом с отечной или тяжелой желтушной формой гемолитической болезни, при высоком титре резус-антител в специализированном учреждении можно проводить плазмаферез, заключающийся в изъятии у беременных определенного объема (250—300 мл) плазмы, содержащей антитела, с помощью различных аппаратов (РК-0,5 "АМИНКО" и др.). Замещение изъятой плазмы производят коллоидными, кристаллоидными и белковыми препаратами и одновременно возвращают в кровоток форменные элементы крови беременной. Плазмаферез выполняют 1 раз в неделю под контролем титра антител, начиная с 23—24 нед беременности до родораз-решения; плазмаферез можно проводить и до беременности в качестве подготовки к ней. С целью уменьшения степени резус-сенсибилизации осуществляют ге-мосорбцию с использованием активированного угля для сорбции свободных антител. Применение гемосорбции оправдано у беременных с крайне отягощенным акушерским анамнезом (повторные выкидыши, рождение мертвого ребенка). Наиболее оптимальным сроком начала проведения гемосорбции считается 20—24 нед беременности. Гемосорбцию проводят в стационаре. За один сеанс гемосорбции через гемосорбент перфузируется 8—-12 л крови (2—3 ОЦК). Интервал между сеансами — 2 нед. Курс сорбционной терапии необходимо заканчивать за 1 нед до предполагаемого срока родо-разрешения. В настоящее время широко проводят лечение ГБП путем внутриматоч-ных гемотрансфузий под контролем ультразвука. Гемотрансфузии плоду можно проводить начиная с 18 нед беременности. Внутриутробное переливание крови создает предпосылки для пролонгирования беременности. Существуют внутрибрюшной и внутрисосудистый способы гемотрансфузии. Техника внутрибрюшной трансфузии заключается в проколе брюшной стенки матери, стенки матки, брюшной стенки плода и введении в его брюшную полость одногруппной и резус-отрицательной эритроцитной массы, которая адсорбируется лимфатической системой и достигает сосудистой системы плода. В последние годы предпочтение отдают внутрисосудистой гемотрансфузии плоду, показаниями к которой при резус-сенсибилизации являются выраженная анемия и гематокрит менее 30 %. С целью проведения внутрисосудистой гемотрансфузии выполняют кор-доцентез, при этом вену пуповины пунктируют в непосредственной близости от ее вхождения в плаценту. Проводник извлекают из иглы и производят забор крови для определения предтрансфузионного гематокрита плода. Эритроцитную массу медленно вводят через иглу, после чего забирают вторую пробу крови для определения конечного плодового гематокрита и оценки адекватности проведенной терапии. Для остановки движений плода, вследствие которых игла может быть вытолкнута им из вены пуповины, плоду вводят ардуан (пипекуроний) внутривенно или внутримышечно. Определение необходимости и времени проведения последующих гемотрансфузий плоду основывается на результатах УЗИ, посттрансфузионных показателях гемоглобина и гематокрита у плода. Проведение амниоцентеза после внутриутробной трансфузии не имеет смысла, так как амниотическая жидкость после этой процедуры обычно окрашена кровью, что может привести к ложноположительным результатам определения оптической плотности. Эффективность лечения тяжелых форм ГБП с помощью внутрисосудистого переливания крови составляет 85—91 %, при внутрибрюшном — 66 %. Беременных, у которых отмечается резус-сенсибилизация, следует направлять в родильный дом при сроке беременности 34—36 нед, при АВ0-сенсибилизации — 36—37 нед для дополнительного обследования и решения вопроса о родоразрешении. При наличии ГБП необходимо досрочное родо-разрешение, так как к концу беременности увеличивается поступление резус-антител к плоду. Оптимальные срок родоразрешения — 37—38 нед беременности, так как при более раннем родоразрешении вследствие функциональной незрелости органов (особенно печени) гемолитическая болезнь протекает более тяжело, ребенок чаще страдает от респираторного дистресс-синдрома. Однако, если объективные данные свидетельствуют о выраженном страдании плода, если женщина имеет отягощенный акушерский анамнез, родоразрешение возможно и в более ранние сроки беременности. При этом необходимо провести мероприятия, направленные на ускорение созревания легких недоношенного плода. Назначают дексаметазон по 2 мг 4 раза в сутки за 2—3 дня до предполагаемых родов. При выраженной отечной форме ГБП беременность прерывают при любом сроке. Если к моменту родоразрешения при УЗИ определяют очень большие размеры живота плода, целесообразно выпустить асцитическую жидкость путем прокола передней брюшной стенки матери, матки и передней стенки живота плода. Как правило, родоразрешение проводят через естественные родовые пути. Кесарево сечение выполняют при наличии дополнительных акушерских осложнений (предлежание плаценты, неправильное положение плода, рубец на матке, выпадение пуповины и т.п.). Родовозбуждение нужно начинать с создания глюкозо-витаминно-гор-монально-кальциевого фона в течение 2—3 дней (в зависимости от состояния шейки матки). При готовности шейки к родам производят амниотомию. В случае, если родовая деятельность не разовьется, через 5—6 ч после амниотомии начинают родовозбуждение окситоцином или простагландина-ми по общепринятой методике. В родах проводят тщательный контроль за состоянием плода, осуществляют профилактику гипоксии. Сразу после рождения ребенка его быстро отделяют от матери во избежание массивного попадания резус-антител в кровоток новорожденного. Из пуповины берут кровь для определения содержания билирубина, гемоглобина, группы крови ребенка, его резус-принадлежности. Проводят непрямую пробу Кумбса, позволяющую обнаружить эритроциты новорожденного, связанные с антителами (реакция агглютинации крови ребенка со специфической сывороткой Кумбса). Учитывая склонность плода и новорожденного с гемолитической болезнью к кровоизлияниям, следует бережно вести второй период родов. Целесообразны эпиду-ральная анестезия и рассечение промежности. При АВО-сенсибилизации ведение родов не имеет каких-либо особенностей. В последующем при необходимости заменного переливания крови новорожденным с гемолитической болезнью используют пуповинные сосуды, поэтому скобку на пуповину не накладывают. Пуповину перевязывают на расстоянии 2—3 см от пупочного кольца. Профилактика резус-сенсибилизации. Профилактические мероприятия заключаются в следующем: любое переливание крови производить с учетом резус-принадлежности крови реципиента и донора; необходимо сохранить первую беременность у женщин с резус-отрицательной кровью; профилактика и лечение осложнений беременности; проведение десенсибилизирующей терапии; осуществление специфической профилактики резус-сенсибилизации у женщин с резус-отрицательной кровью путем введения антирезус-иммуноглобулина после любого прерывания беременности. Иммуноглобулин-антирезус вводят по одной дозе внутримышечно одно- кратно. Родильнице указанную дозу назначают в течение 48 ч после родов, а лучше — 24 ч, при аборте — по окончании операции. После кесарева сечения и ручного отделения плаценты дозу препарата необходимо удвоить. Важно произвести примерный расчет количества доз иммуноглобулина для родовспомогательных учреждений. Принимая во внимание данные литературы, следует считать, что из 1000 рожающих у 170 будет резус-отрицательная кровь. Из них у 100 женщин ребенок будет резус-положительным. Следовательно, на 1000 родов необходимо 100 доз препарата, если вводить его всем женщинам с резус-отрицательной кровью, родивших детей с резус-положительной кровью. При неукоснительном выполнении методики специфической профилактики резус-сенсибилизации можно практически решить проблему резус-конфликтной беременности.
АНОМАЛИИ РАЗВИТИЯ И ЗАБОЛЕВАНИЯ ПЛОДА, ПЛОДНЫХ ОБОЛОЧЕК, ПУПОВИНЫ, ПЛАЦЕНТЫ Дата добавления: 2014-11-24 | Просмотры: 943 | Нарушение авторских прав |
 Глава 15
Глава 15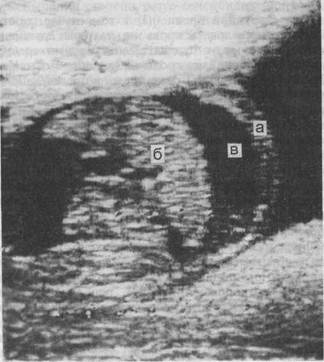
 Глава 16
Глава 16