|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Половая дифференцировкаГенетический пол Генетический пол определяется половыми хромосомами. При оплодотворении яйцеклетки сперматозоидом, который содержит гаплоидный набор с X-или Y-хромосомой, эмбрион получает женский (46,XX) или мужской (46,XY) набор хромосом. На Y-хромосоме локализуется ген, характеризующийся высокой консервативностью [так называемая область Y-хромосомы, детерминирующая
Рис. 7-1 Схема биосинтеза половых гормонов. пол (SRY — Sex-determinierende Region des Y-Chromosoms)!, или фактор, детерминирующий развитие яичек (TDF — Testis-determinierende Faktor) (Sinclair et al., 1990). Гонадный пол В течение первых нескольких недель эмбрионального развития гонады обоего пола бывают индифферентными и бипотентными. Под влиянием TDF на 7-й неделе после зачатия зачатки гонад дифференцируются в яички. При отсутствии TDF (SRY) с 10-й недели начинается диф-ференцировка гонад в яичники. Развитие яичников начинается на 10-й неделе после зачатия. На 14-й неделе в яичниках уже можно различить примордиальные фолликулы. До самого рождения яйцеклетки подвергаются редукционному делению, которое прерывается в профазе. Мей-оз яйцеклетки завершается лишь непосредственно перед овуляцией. Большая часть овогоний, общее количество которых достигает 6—7 млн, к 20-й неделе атрезируется. К моменту рождения девочки у нее остается 1 млн овогоний, к моменту наступления менархе — 400 000. Лишь 400 яйцеклеток подвергаются овуляции (Baker, 1963). Соматический пол У эмбрионов вначале развиваются два парных половых протока, которые дают начало мужским или женским половым органам: вольфовы и мюл-леровы протоки. При отсутствии яичек вольфовы протоки подвергаются обратному развитию, а из мюллеровых протоков развиваются матка, маточные трубы и проксимальный отдел влагалища. Наружные половые органы из индифферентных зачатков дифференцируются по женскому типу (урогенитальный синус, урогенитальный бугорок), если не подвергаются вирилизирующему действию андрогенов. Наличия функционирующих яичников для этого не нужно, необходимо только отсутствие яичек. В противоположность этому, дифференциров-ка по мужскому типу всегда представляет собой активный процесс. Яички плода продуцируют тестостерон и антимюллеров гормон. Под влиянием антимюллерова гормона, который вырабатывается клетками Сертоли, происходит обратное развитие мюллеровых протоков (Josso, 1975), в то время как высокая локальная концентрация стимулирует развитие вольфовых протоков (Siiteri u. Wilson, 1974). Из вольфовых протоков образуются придатки яичек, семявыносящие протоки и
семенные пузырьки. Из устьев вольфовых протоков в урогенитальном синусе образуются простатическая и мембранозная части уретры. Наружные половые органы в течение первых нескольких недель эмбрионального развития также индифферентны и бипотентны. При наличии яичек под влиянием тестостерона, вырабатываемого клетками Лейдига, происходит слияние уретральных и губно-мошоночных складок, из которых образуются пещеристые тела полового члена и мошонка. На 12-й неделе после зачатия развитие и образование мошонки завершается. Нарушение андрогенного влияния в течение этого периода всегда приводит к развитию половых органов по промежуточному типу. После 12-й недели андрогены уже неспособны вызвать сращение губно-мошоночных складок, если оно к этому времени не было завершено. Отсутствие у девочек яичек становится причиной обратного развития вольфовых протоков. Слияние мюллеровых протоков начинается с 6-й недели после зачатия. Из их краниального отде- ла образуются маточные трубы, каудальные отделы сливаются, образуя маточно-влагалищный канал. Этот зачаток связывается с эпителием уро-генитального синуса, из которого формируется влагалище (O'Rahilly, 1977) (рис. 7-2). Психический пол Многочисленные эксперименты на животных показали, что как у низших млекопитающих, так и у приматов гормоны в критические фазы развития оказывают решающее влияние на циклическую (женскую) или тоническую (мужскую) секрецию гонадотропинов, на мужской и женский тип полового поведения и половой диморфизм развития головного мозга. У людей знания добываются в процессе наблюдения за «экспериментами» самой природы. Большинство клинических исследований, касающихся гормональных нарушений в период развития, выполнены на пациентках с АГС. У них
Рис. 7-2. Схема нормальной половой дифференцировки.
были описаны мужской тип поведения («девочки с мальчишеским озорством»), би- или гомосексуальная ориентация (Erhardt, 1979; Erhardt u. Meyer/Bahlburg, 1981; Money et al., 1984), однако в исследованиях некоторых авторов эти данные не подтвердились (Muller et al., 1982). Девочки, матери которых во время беременности лечились гестагенными препаратами с андро-генным действием, обнаруживали мужской тип поведения (Money u. Erhardt, 1972). С другой стороны, гестагенные препараты, сходные по своему действию с прогестероном, препятствовали маскулинизирующему эффекту андрогенов и эстрогенов. В отличие от АГС, при полной резистентности к андрогенам (синдром тестикулярной феминизации) андрогенное влияние in utero отсутствует. Половая идентификация, а также тип поведения при этом женские (Masica et al., 1971). Уровень тестостерона в сыворотке крови этих пациенток соответствует верхней границе нормы для мужчин, и возможна беспрепятственная ароматизация его с превращением в эстрогены. Пациентки с недостаточностью 5а-редуктазы рождаются с наружными половыми органами, развитыми по женскому типу, и развиваются как девочки. В пубертатном периоде у них отмечается выраженная вирилизация. В группе таких пациенток из Доминиканской Республики в пубертатном периоде большинство изменили половую роль и половую идентичность (Imperato-McGinley et al., 1979). Мнение о том, что эти наблюдения подтверждают решающее значение биологических (гормональных) факторов в половой идентификации, оспаривается Rubin et al. (1981). Согласно этим авторам, в изменении половой идентичности пациенток, которые наблюдались Imperato-McGinley et al., решающую роль сыграли социокультурные условия в Доминиканской Республике, так как в сравнимой группе пациенток в США ни одна из них не перестала причислять себя к женскому полу, несмотря на вирилизацию в пубертатном периоде. Из сказанного выше следует, что повышенный уровень андрогенов во внутриутробном периоде у пациенток с АГС, несмотря на вирилизирующее действие на развитие половых органов, по-видимому, не оказывает существенного влияния на половую идентификацию и психосексуальную ориентацию (Erhardt, 1979; Erhardt et al., 1968; Money u. Schwarty, 1977). Половая идентификация, по-видимому, в значительной степени зависит от половой роли, в которой ребенок растет. Амбивалентная самоидентификация, вероятно, наблюдается в тех случаях, когда родители в воспитании ребенка не придерживаются строго определенной ролевой линии (Faiman u. Winter, 1974). Большинство исследователей основными в развитии половой идентификации считают либо врожденные, либо приобретенные факторы, в то время как речь идет скорее о взаимодействии гормональных и психосоциальных факторов (Rubin et al., 1981). 7.3. Нарушение половой дифференцировки Нарушение половой дифференцировки может произойти на любой ее стадии. В зависимости от характера нарушения, степени его выраженности и стадии, на которой оно происходит, возможен широкий спектр патологических изменений — от незначительных отклонений, не имеющих клинического значения, до различной степени выраженности амбивалентности или полного изменения соматического пола по отношению к генетическому. Истинный гермафродитизм, при котором у пациента имеются как яички, так и яичники, встречается редко. Чаще речь идет о пациентах с генетически детерминированным мужским полом, имеющих яички (и у которых при генетическом исследовании идентифицируют TDS), у которых маскулинизация недостаточно выражена (ложный мужской гермафродитизм), или о пациентках с генетически детерминированным женским полом, у которых, несмотря на функционирующие яичники, отмечается вирилизация (ложный женский гермафродитизм). Ложный мужской гермафродитизм При ложном мужском гермафродитизме пациенты имеют генетически детерминированный мужской пол (при генетическом исследовании у них выявляют TDS), яички, но недостаточно маскулинизированные внутренние и/или наружные половые органы. Выраженность клинических проявлений широко варьирует — от гениталий, развитых полностью по женскому типу, и множества вариантов амбивалентных гениталий до внешне нормальных мужских гениталий с гипоспадией. Недостаточность вирилизации детей с генетически детерминированным мужским полом классифицируют в соответствии с данными, приведенными в табл. 7-1 и на рис. 7-3 (Sinnecker et al, 1985; Sinnecker et al., 1996).
Таблица 7-1. Классификация фенотипов при ложном мужском гермафродитизме (Sinnecker et al., 1997)
Выделяют следующие причины недостаточной вирилизации: • Функциональная недостаточность яичек у плода (дисгенезия гонад). • Утрата какой-либо функции яичек, которые в остальном развиты нормально (дефект биосинтеза тестостерона, гипоплазия клеток Лейдига). • Неспособность тканей реагировать на тестостерон, вырабатываемый нормально развитыми яичками (резистентность к андрогенным гормонам, недостаточность 5а-редуктазы). Нарушения развития половых желез и хромосомные нарушения Нарушение развития яичек бывает обусловлено в основном хромосомными аберрациями, однако в некоторых случаях причину его установить не удается. В зависимости от степени нарушения дифференцировки, а также от того, нарушено развитие одного или обоих яичек, половые органы индивидуума могут быть развиты по женскому типу, амбивалентно или по мужскому типу. В половине случаев в основе дисгене-зии гонад лежит мозаицизм 45,X-/46,XY (Ferguson-Smith, 1965). Более чем у половины этих пациентов наружные половые органы развиты по женскому типу и имеются признаки вирилизации. Причиной этих отклонений считают структурные изменения Y-хромосомы в анафазе (Madan et al., 1979). В отличие от отмеченной выше аномалии, при дисгенезии гонад у пациентов с кариотипом 46,XY структурные изменения в Y-хромосоме отсутствуют. Этиология некоторых заболеваний, проявляющихся различными аномалиями развития, установлена: мутации гена WT1 обнаруживаются при синдромах Дени—Драша и WAGR (Mueller, 1949), при синдроме Смита—Лемли—Опица отмечается недостаточность дегидрохолестерин-С7-редуктазы, которая является причиной повышения уровня 7-дегидрохолестерина в сыворотке крови (Tint et al., 1995). Дисгенезию гонад может вызвать также удвоение локуса DSS на Хр21 и мутации гена SOX9 на 17q21, в этих случаях она сочетается с кампомелической дисплазией (Wagner et al., 1949). Неполная (смешанная) дисгенезия гонад Изменения в яичках при нарушении их дифференцировки могут быть выражены в различной степени, одинаково с обеих сторон или быть асим-
Рис. 7-3. Классификация фенотипов при ложном мужском гермафродитизме (Sinnecker et al„ 1996, 1997).
Рис. 7-4. Неполная дисгенезия гонад (пораженная область при тех или иных нарушениях окрашена в красный цвет или затушевана) метричными. Они могут затрагивать одно яичко при нормально развитом другом, оба яичка в различной степени вплоть до полной дисгенезии обоих яичек, которые при этом имеют вид соединительнотканных тяжей, расположенных в позиции яичников (стрековые гонады). Такое разнообразие морфологических вариантов обусловливает различную степень функциональных нарушений. Недостаточная секреция тестостерона и антимюллерова гормона приводит к недостаточной стимуляции воль-фова протока на стороне поражения и гипоплазии семенных пузырьков, семявыносящего протока и придатка яичка. Недостаточная секреция также нарушает обратное развитие мюллерова протока на стороне поражения, что обусловливает персистен-цию образующихся из него анатомических структур (маточная труба, матка, проксимальный отдел влагалища) с различной степенью их дисплазии (рис. 7-4). Клиническая картина Клиническая картина охватывает женский, амбивалентный и мужской фенотипы и все мно- гообразие промежуточных форм. Потеря функции дисгенетичным яичком обычно одинаково влияет на секрецию тестостерона и антимюллерова гормона. Если секреция нарушена настолько, что приводит к недостаточной маскулинизации наружных половых органов и развитию их по промежуточному или женскому типу, то обычно наблюдается персистенция анатомических структур, образующихся из мюллеровых протоков (маточные трубы, матка, проксимальный отдел влагалища). Эта важная особенность дисгенезии гонад, клинические проявления которой столь разнообразны, позволяет отличить ее от других причин ложного мужского гермафродитизма (рис. 7-5). Диагностика Заподозрить неполную дисгенезию гонад следует в тех случаях, когда у пациента с гениталиями промежуточного типа имеется матка и либо пальпируются гонады (это всегда яички), либо при генетическом анализе обнаруживают Y-хромосому.
Кариотип обычно бывает 46,XY, 45,X/46,XY, 45,X/47,XYY или подобный этому. Наружные половые органы развиты по женскому (отмечается гипертрофия клитора), промежуточному или мужскому типу. Отмечается различная степень дифференцировки вольфовых протоков и соответственно обратного развития мюллеровых протоков. Гонады представлены соединительнотканными тяжами (стрековые) либо дисгенетич-ные или одно яичко дисгенетично, а другое развито нормально (смешанная дисгенезия гонад). Половое созревание не наступает или отмечается вирилизация. Если появляется гинекомастия, ее причиной обычно бывает гонадобласто-ма, продуцирующая эстрадиол. Концентрация гонадотропинов (ЛГ, ФСГ) в плазме крови со 2-го года жизни повышена, тестостерона — снижена. Лечение При решении вопроса, какой пол следует выбрать для растущего ребенка, исходят из того, при каком поле скорее всего следует рассчитывать на нормальную функцию наружных половых орга- нов. Это определяют в зависимости от анатомических особенностей, возможности хирургической коррекции и культурного уровня семейного окружения ребенка. Если ребенок будет воспитываться как девочка, яички следует удалить. Оставление их таит в себе двоякую опасность. Во-первых, остаточная функция яичек обусловит гетеросексуальное (мужское) течение пубертатного периода. Во-вторых, дисгенетичные гонады, клетки которых содержат Y-хромосому, часто малигнизируются. Такая предрасположенность к развитию гонадобластомы объясняется присутствием на Y-хромосоме в так называемом гонадобластомном локусе гена GBY (Tsuchiya, 1995). Риск злокачественного перерождения в 10-летнем возрасте составляет 2%, в 20-летнем — 16%, в 30-летнем — 27,5% (Manuel et al., 1976). Обычно развивается гонадобластома или герминома. В период, соответствующий пубертатному, детям проводят заместительную терапию эстрогенами и гестагенами. Полная (чистая) дисгенезия гонад При полной, или чистой, дисгенезии гонад отмечается фиброзное их перерождение (стрековые гонады). Дети имеют кариотип 46,XY или 46,XX. Дисгенезия гонад при кариотипе 46,XY в 10% случаев бывает обусловлена мутацией гена SRY (Ferguson-Smith u. Goodfellow, 1995). В остальных случаях причиной дисгенезии, по-видимому, бывают мутации аутосомных генов дифференцировки. Клиническая картина При полной дисгенезии гонад отмечается нормальный женский фенотип (внутренние и наружные половые органы развиты нормально, по женскому типу). Схематически это показано на рис. 7-6. У большинства этих пациенток отсутствуют признаки полового созревания в пубертатном периоде и отмечается первичная аменорея. У пациенток с кариотипом 46,XY (синдром Суайера) чаще наблюдается гипертрофия клитора. Риск злокачественного перерождения стрековых гонад, клетки которых содержат Y-хромосому, такой же, как при смешанной дисгенезии гонад. Однако злокачественное перерождение дисгенетичных гонад, не содержащих Y-хромосому, является редкостью (см. рис. 7-6 и 7-7).
Рис. 7-6. Полная дисгенезия гонад (пораженная область при тех или иных нарушениях окрашена в красный цвет или затушевана)
Рис. 7-7. Пациентка с дисгенезиеи гонад и кариотипом 46.XY (Sinnecker et ot 1982).
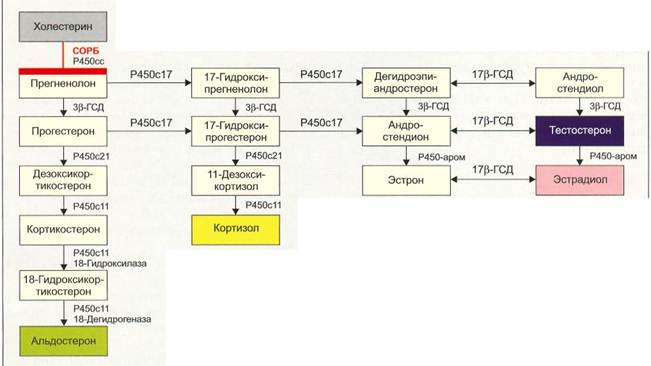
Диагностика Диагноз полной дисгенезии гонад ставят на основании отсутствия признаков полового созревания и гипогонадотропного гипогонадизма у пациентки с нормальным мужским или женским набором хромосом. При УЗИ яичники у них не идентифицируются, в остальном наружные и внутренние половые органы развиты нормально, по женскому типу. Лечение Лечение заключается в заместительной терапии эстрогенами и гестагенами, назначаемой в возрасте, соответствующем пубертатному периоду. В связи с высоким риском злокачественного перерождения стрековые гонады у пациенток с ка-риотипом 46,XY следует удалить в ранние сроки (Sinnecker et al., 1982). Механизмы развития ложного мужского гермафродитизма приведены на рис. 7-8. Нарушение биосинтеза тестостерона Этиология и патогенез О нарушении биосинтеза тестостерона свидетельствует недостаточная вирилизация у лиц с генетически мужским полом и выраженным в различной степени женским фенотипом. Поскольку выработка антимюллерова гормона не нарушена, то, в отличие от дисгенезии гонад, происходит полная регрессия мюллеровьгх протоков. Нарушение следующих трех звеньев может вызвать нарушение биосинтеза глю-кокортикоидных и половых гормонов: • Недостаточность СОРБ. • Недостаточность Зв-гидросистероиддегидроге-назы типа 2. • Недостаточность СУР17-(17а-гидроксилазы- 17,20-лиазы). Недостаточность следующих двух ферментов вызывает нарушение биосинтеза только половых гормонов:. СУР17-(17,20-лиазы). • 17(3-гидроксистероиддегидрогеназы типа 3.
Рис. 7-8. Механизмы развития ложного мужского гермафродитизма (пораженная область при тех или иных нарушениях окрашена в красный цвет или затушевана).
Рис. 7-9. Схема биосинтеза стероидных гормонов при недостаточности СОРБ, Недостаточность СОРБ Холестерин переносится с помощью СОРБ с наружной поверхности митохондриальной мембраны на внутреннюю, где при участии фермента CYP11A1 (цитохром P450scc) используется в качестве субстрата для биосинтеза стероидных гормонов (Bose et al., 1996). Недостаточность СОРБ вызывает нарушение синтеза всех стероидных гормонов в равной мере. Клинически это проявляется симптомами недостаточности глюко- и минералокортикоидов и половых гормонов. Клиническая картина Ребенок имеет женский или амбивалентный фенотип. Влагалище заканчивается слепо, производные мюллеровых протоков отсутствуют. Воль-фовы протоки находятся в рудиментарном состоянии. Тяжелая недостаточность коркового вещества надпочечников, если ее не диагностировать и не лечить своевременно, быстро приводит к смерти. Все выжившие к настоящему времени дети росли как девочки. В пубертатном периоде возможны легкие проявления вирилизации (рис. 7-9 и 7-10). Диагностика Диагностическое значение имеют очень низкий уровень всех стероидных гормонов в плазме крови (глюкокортикоидов, минералокортикоидов, половых гормонов) и повышенный уро-
Рис. 7-10. Пациентка (кариотип 46,XY) с нарушением биосинтеза стероидов в надпочечниках и половых железах. Обращает на себя внимание бронзовый цвет кожи.
вень АКТГ, ренина, иногда — гонадотропинов, гиперплазия надпочечников со смещением почек в каудальном направлении при УЗИ и ги-перпигментированная кожа, имеющая бронзовый цвет. Стимуляция АКТГ не вызывает повышения уровня кортизола в плазме крови. Диагностика должна включать также анализ ДНК. Лечение Жизненно необходима заместительная терапия минерало- и глюкокортикоидами. Во избежание вирилизации в пубертатном периоде гонады желательно удалить до его наступления. В пубертатном периоде назначают эстрогены. Для индуцирования роста волос на лобке назначают малые дозы тестостерона. Недостаточность ЗЬ-гидроксистероиддетидрогеназы Этиология и патогенез При недостаточности Зр-гидроксистероидде-гидрогеназы происходит блокирование биосинтеза стероидных гормонов на ранней его стадии, в результате возникает недостаточность как глю-ко- и минералокортикоидов, так и половых гормонов. В основе заболевания лежит мутация гена HSD3B2, кодирующего фермент Зр-гидроксисте-роиддегидрогеназа-А4 5-изомеразу типа 2, который находится в основном в надпочечниках и половых железах. Клиническая картина Клинические проявления отличаются большим разнообразием. Отмечаются амбивалентные гениталии с микропенисом, гипоспадия, неполное сращение губно-мошоночных складок, пер-систенция урогенитального синуса, слепо заканчивающееся влагалище и в зависимости от степени недостаточности фермента — выраженные в различной степени симптомы недостаточности коркового вещества надпочечников. Внутренние половые органы развиты нормально, по мужскому типу, производные мюллеровых протоков отсутствуют. В пубертатном периоде отмечаются незначительная вирилизация и гинекомастия. Диагностика Для заболевания характерна повышенная концентрация 17р-гидроксипрегненолона и дегид-роэпиандростерона. Поскольку концентрация этих гормонов может быть повышенной и у здоровых новорожденных, целесообразно провести стимуляционную пробу с АКТГ и ХГ. Диагностика включает также анализ ДНК. Лечение Назначают заместительную терапию глюкокортикоидами, а также минералокортикоидами (в зависимости от степени недостаточности Зв-гидроксистероиддегидрогеназы). В пубертатном периоде проводят заместительную терапию половыми гормонами. При микропенисе начинают раннюю терапию тестостероном (Chung et al., 1987). Недостаточность фермента СУР-(17а-гидроксилазы-17,20-лиазы) Фермент CYP (цитохром Р450с17) катализирует гидроксилирование прегненолона и прогестерона в 17а положении (гидроксилазная активность) и отщепление боковой цепи от образовавшегося 17а-гидроксилированного субстрата (17,20-лиазная активность). Несмотря на то что этот фермент кодируется одним геном (Conte et al., 1994), активность его может нарушаться по-разному. Так, возможно нарушение одновременно гидроксилазной и 17,20-лиазной активности или изолированное нарушение одной из них. В зависимости от этого клиническая картина проявляется симптомами недостаточности 17а-гидроксилазы-17,20-лиазы или изолированной недостаточности 17,20-лиазной активности. Недостаточность 17а-гидроксилазной активности приводит к нарушению синтеза глюкокортикои-дов и половых гормонов. Повышенное образование 11-дезоксикортикостерона и кортикостерона вызывает артериальную гипертензию, гиперкалиемию и подавление активности ренина плазмы. Недостаточность бывает выражена в различной степени, что и определяет клинические проявления. Клиническая картина Для заболевания характерно разнообразие клинических вариантов. Больные могут иметь
генетически детерминированный мужской пол при женском фенотипе со слепо заканчивающимся влагалищем, различные варианты амбивалентных половых органов или мужской фенотип в сочетании с микропенисом и гипоспа-дией. Производные вольфовых протоков гипопластичны, производные мюллеровых протоков отсутствуют. В пубертатном периоде возможны вирилизация и гинекомастия. Минера-локортикоидный эффект высоких концентраций дезоксикортикостерона и кортикостерона вызывает задержку натрия и воды, потерю калия, увеличение объема циркулирующей плазмы, артериальную гипертензию с гипоренине-мией и алкалозом. Диагностика Характерна повышенная концентрация в плазме АКТГ, 11 -дезоксикортикостерона, кортикостерона и прогестерона и пониженная концентрация альдостерона, 17а-гидроксипрогестерона, кортизола и половых гормонов. Отмечаются также гипоренинемическая артериальная гипертен-зия и гипокалиемический алкалоз. Лечение • Заместительная терапия глюкокортикоидами приводит к нормализации артериального давления и уровня калия в сыворотке крови. Половые гормоны назначают в пубертатном периоде. Из-за возможности вирилизации у лиц с генетически детерминированным мужским полом до наступления пубертатного периода яички желательно удалить. Изолированная недостаточность CYP-(17,20-лиазы) Недостаточность 17,20-лиазной активности фермента CYP17 (цитохром Р450с17) приводит к нарушению превращения 17а-гидроксипрег-ненолона и 17а-гидроксипрогестерона в андро-генные гормоны дегидроэпиандростерон и анд-ростендион. Клиническая картина Фенотип лиц с генетически детерминированным мужским полом может быть женским со слепо заканчивающимся влагалищем, амбивален- тным или преимущественно мужским. Вольфо-вы протоки дифференцированы нормально или гипопластичны, производные мюллеровых протоков отсутствуют. В пубертатном периоде отсутствуют вторичные половые признаки или появляются легкие симптомы вирилизации. Диагностика Диагностическое значение имеют повышенная концентрация С21 -стероидов 17а-гидроксип-рогестерона и 17а-гидроксипрегненолона, сниженная концентрация С19-стероидов дегидроэ-пиандростерона и андростендиона, а также тестостерона и эстрадиола. При стимуляции АКТГ или ХГ отношение С21-стероиды/С|9-сте-роиды значительно повышается. Лечение Заместительную терапию половыми гормонами проводят в пубертатном периоде. При генетически детерминированном мужском поле у пациента, который рос и воспитывался как девочка, до наступления пубертатного периода яички следует удалить, чтобы избежать вирилизации. Недостаточность 17Ь-гидроксистероиддегидрогеназы Из 5 изоферментов 17в-ГСД наибольшее значение для дифференцировки по мужскому типу имеет экспрессирующийся в яичках фермент 17в-ГСД типа 3, который катализирует последнюю ступень биосинтеза половых гормонов. На этой ступени происходит превращение дегидроэпи-андростерона в А5-андростендиол, андростендиона в тестостерон и эстрона в 17в-эстрадиол. Недостаточность тестостерона приводит к полному отсутствию маскулинизации у плода мужского пола во внутриутробном периоде. Однако в пубертатном периоде в результате экстрагланду-лярного превращения имеющегося в избытке андростендиона в тестостерон другими изофермен-тами 17р-ГСД происходит выраженная вирилизация. Клиническая картина В большинстве случаев лица с генетически детерминированным мужским полом имеют женские наружные половые органы со слепо заканчи-
вающимся влагалищем, иногда отмечаются легкие симптомы вирилизации. Вольфовы протоки дифференцированы, производные мюллеровых протоков отсутствуют. В пубертатном периоде происходит выраженная вирилизация с ломкой голоса и увеличением клитора. Иногда отмечается гинекомастия. Как и при недостаточности 5а-редуктазы, описаны случаи изменения женской половой роли на мужскую при начавшейся вирилизации. Диагностика Начиная с пубертатного периода повышается концентрация андростендиона и эстрона в плазме крови, концентрация тестостерона и эстради-ола снижается. В препубертатном периоде необходима стимуляция ХГ, она приводит к выраженному увеличению отношения андростендион/ тестостерон и эстрон/эстрадиол. Диагностика включает в себя также анализ ДНК, в частности гена HSD17B3. Лечение У лиц с генетически детерминированным мужским полом, которые росли и воспитывались как де- вочки, следует удалить яички до наступления пубертатного периода. При амбивалентных половых органах может встать вопрос о мужской половой ориентации. В таких случаях в детском возрасте проводят терапию тестостероном для увеличения размеров полового члена, которую дополняют хирургической коррекцией, направленной на маскулинизацию половых органов. В пубертатном периоде следует назначить заместительную терапию тестостероном для достижения полной маскулинизации и предупреждения гинекомастии (рис. 7-11 и 7-12). Гипоплазия клеток Лейдига Редкой причиной ложного мужского гермафродитизма является отсутствие чувствительности клеток Лейдига к ХГ и ЛГ (агенезия или гипоплазия клеток Лейдига). Этиология и патогенез Гипоплазия или агенезия клеток Лейдига объясняется недостаточностью рецепторов, которая делает эти клетки нечувствительными к влиянию ХГ и ЛГ (Themmen u. Branner, 1996). Недостаточная выработка тестостерона приводит к недо-
Рис. 7-11. Схема нарушения биосинтеза стероидных гормонов при недостаточности 17(3-ГСД.
Рис. 7-12. Пациентка с недостаточностью 17(3-ГСД. статочной маскулинизации плода мужского пола во внутриутробном периоде. Поскольку, в отличие от дисгенезии гонад, клетки Сертоли сохранены и нормально функционируют, т. е. продуцируют антимюллеров гормон, то у лиц с этой патологией производные мюллеровых протоков отсутствуют. У некоторых пациентов вольфовы протоки бывают дифференцированы, несмотря на недостаточную маскулинизацию наружных половых органов. Это, по-видимому, объясняется па-ракринной секрецией тестостерона, которого достаточно для локального действия: индуцирования дифференцировки вольфовых протоков. Однако концентрация тестостерона в плазме остается слишком низкой, чтобы вызвать достаточную маскулинизацию наружных половых органов. Клинические проявления недостаточности тестостерона соответствуют характеру нарушений его биосинтеза. Клиническая картина Наружные половые органы обычно развиты по женскому типу со слепо заканчивающимся влагалищем и легкими признаками вирилизации, но могут быть также амбивалентными или развиты по мужскому типу. Отмечаются развитые в различной степени производные вольфовых протоков, производные мюллеровых протоков отсутству- ют. Признаки полового созревания в пубертатном периоде не появляются. Диагностика Уровень тестостерона в плазме низкий, однако в препубертатном периоде он не имеет диагностического значения. После стимуляции ХГ происходит небольшое повышение уровня тестостерона, но без повышения уровня его предшественников, которое наблюдается при нарушении его биосинтеза. Связывание ХГ и ЛГ с рецепторами клеток Лейдига незначительное. Лечение Выбор пола определяется по степени маскулинизации. Заместительную терапию половыми гормонами проводят ко времени наступления пубертатного периода. Недостаточность стероид-5а-редуктазы типа 2 Новаковский и Ленц в 1961 г. впервые описали форму ложного гермафродитизма, наследуемую по аутосомно-рецессивному типу. Они назвали ее псевдовагинальной перинеоскроталь-ной гипоспадией (Nowakowski u. Lenz, 1961). В дальнейшем Императо-Магинли и соавт. (Imperato-McGinley et al., 1974) показали, что в основе этого заболевания лежит недостаточность стероид-5а-редуктазы типа 2, кодируемой геном SRD5A2. Этиология и патогенез Превращение тестостерона в биологически более активный дигидротестостерон происходит при участии фермента стероид-5а-редуктазы типа 2, кодируемого геном SRD5A2 (Andersson et al., 1991). Известны различные дефекты этого фермента. Чаще речь идет об уменьшении сродства к тестостерону и тем самым снижении активности фермента (Moore et al., 1975). К другим дефектам относятся изменения, приводящие к уменьшению стабильности фермента и его сродства к кофактору NADPH (Leshin et al., 1978). Во всех случаях нарушается превращение тестостерона в дигидротестостерон в тканях. Это проявляется в недостаточной маскулинизации наружных половых органов. Развитие вольфо-вых протоков, находящееся исключительно под
влиянием паракриннои секреции тестостерона, а также регрессия мюллеровых протоков не нарушены. В пубертатном периоде происходит выраженная вирилизация, несмотря на сохраняющуюся недостаточность 5ос-редуктазы. Секреция эстрадиола нормальная, гинекомастия не наблюдается. Клиническая картина У детей с генетически детерминированным мужским полом недостаточность стероид-5а-ре-дуктазы типа 2 вызывает выраженное в различной степени нарушение маскулинизации. Клинически это может проявиться внешне нормальными наружными половыми органами, развитыми по мужскому типу, различными вариантами амбивалентных половых органов, а также полностью женским фенотипом. Яички бывают расположены в паховых каналах, губно-мошоночных складках или мошонке. Производные вольфовых протоков полностью развиты (придатки яичек, семявыносящие протоки и семенные пузырьки). Семявыносящие протоки иногда открываются во влагалище. Производные мюллеровых протоков отсутствуют (Sinnecker et al., 1996; Walsh, 1974). В пубертатном периоде на фоне нормального повышения уровня тестостерона отмечается выраженная вирилизация с ломкой голоса и увеличением размеров полового члена без появления гинекомастии. Диагностика В детском возрасте определение концентрации гормонов в сыворотке крови диагностического значения не имеет. После стимуляции ХГ отмечается существенное повышение отношения тестостерон/дигидротестостерон (Hiori et al., 1996). Снижение активности фермента можно выявить и в культуре фибробластов, полученных из кожи половых органов (Pinsky et al., 1978). Анализ гена SRD5A2 позволяет подтвердить диагноз даже при минимальной недостаточности фермента (Hiori et al., 1996; Sinnecker et al., 1996). Лечение Дети, у которых половой член выражен, несмотря на малые размеры, должны воспитываться как мальчики. Раннее лечение дигидротесто- стероном способствует увеличению размеров полового члена и облегчает хирургическую коррекцию гипоспадии. После пубертатного периода также показана терапия высокими дозами тестостерона для усиления вирилизации (Price et al., 1984). У детей, которых воспитывают как девочек, до наступления пубертатного периода следует обязательно удалить яички во избежание вирилизации. В пубертатном периоде проводят заместительную терапию эстрогенными и гестагенны-ми препаратами (рис. 7-13 и 7-14). Синдром резистентности к андрогенам Резистентность к андрогенам является второй после дисгенезии гонад причиной ложного мужского гермафродитизма. Несмотря на нормальную или даже повышенную концентрацию андрогенов в плазме крови, отмечается недостаточность андрогенного влияния на ткани. Клинически синдром может проявиться полностью женским фенотипом (тип 5, см. рис. 7-3 и табл. 7-1) при полной резистентности к андрогенам (синдром тестикулярной феминизации), различными вариантами амбивалентных гениталий (типы 4—2) или мужским фенотипом, при котором у пациентов отмечаются частичная резистентность к андрогенам и бесплодие (тип 1). Этиология и патогенез Причиной резистентности к андрогенам является недостаточность андрогенных рецепторов. Она может быть обусловлена нарушением связывания андрогенов с рецепторами, транслокацией комплекса стероидный гормон—рецептор из цитоплазмы в клеточное ядро, димеризацией рецепторов и связыванием их с ДНК и последующей транскрипцией и трансляцией. Белок андрогенного рецептора кодируется геном, локализованным на длинном плече Х-хро-мосомы (Xqll-12). Этот белок в С-концевой области имеет домены, связывающие ДНК и гормон (рис. 7-15). Почти во всех случаях резистентности к андрогенам удается выявить мутации гена, кодирующего андрогенный рецептор. Чаще это точко-вые мутации, затрагивающие одну аминокислоту. В зависимости от локализации мутации рецеп-торная недостаточность проявляется по-разно-
Рис. 7-13. Недостаточность стероид-5а-редуктазы типа 2.
Рис. 7-14. Пациентка (кариотип 46.XY) с недостаточностью 5а-редуктазы (Sinnecker et al„ 1996).
Рис. 7-15. Схематическое изображение гена белка андрогенно-го рецептора и взаимодействия активированного комплекса ан-дрогенный рецептор-дигидротестостерон с ДНК.
му — от полной утраты активности рецептором (Burstein et al., 1979; Marcelli et al., 1990) до изменения качества связи с гормоном (McPhaul et al., 1991) или нарушения связывания комплекса стероидный гормон—рецептор с ДНК. Замена одного или нескольких оснований кодирующей последовательности гена при нарушенном сплайсинге может привести к преждевременному появлению стоп-кодона и утрате рецептором ДНК-и гормонсвязывающего доменов (Hiort et al., 1996; Marcelli et al., 1990; McPhaul et al., 1991). Помимо точковых мутаций, возможны также делеции и инсерции, которые, как правило, вызывают полную резистентность к андрогенам. Обычно пациенты с одинаковой мутацией имеют сходный фенотип, хотя в отдельных случаях фенотипы у больных членов одной семьи могут сильно различаться (рис. 7-16, а и б). Полная резистентность к андрогенам Если действие андрогенов полностью блокируется, в эмбриональном периоде происходит развитие вольфовых протоков или маскулини- зация наружных половых органов. Поскольку выработка антимюллерова гормона и его действие не нарушаются, происходит полная регрессия мюллеровых протоков. У детей концентрация половых гормонов и гонадотропинов в сыворотке крови низкая и соответствует возрастной норме (Fakhry et al., 1988). В пубертатном периоде в гипоталамо-гипофизарной системе, которая также резистентна к андрогенам, увеличивается амплитуда и частота пульсирующей секреции ЛГ (Brown et al., 1990), что вызывает повышенную выработку яичками тестостерона (Tsuchiya et al., 1995) и эстрадиола (MacDonald et al., 1979). В результате экстрагландулярной ароматизации накапливающегося в крови тестостерона происходит дальнейшее увеличение концентрации эстрадиола, которое вызывает выраженную феминизацию. Клиническая картина Клиническая картина при полной резистентности к андрогенам характеризуется женским фенотипом (см. рис. 7-16, а) при генетически
Рис. 7-16. Полная резистентность к андрогенам, о - пациентка (кариотип 46.XY) с полной резистентностью к андрогенам типа 5; б- наружные половые органы этой пациентки
детерминированном мужском поле и хорошо развитыми женскими вторичными половыми признаками, появляющимися в пубертатном периоде (тип 5). Вторичное оволосение обычно слабо выражено. Клитор нормальных размеров, малые половые губы недостаточно развиты, влагалище слепо заканчивается. Производные мюллеровых (матка, маточные трубы) и вольфовых протоков отсутствуют. Глубина влагалища обычно достаточна для нормальной половой жизни. Половая идентификация женская. Частота полной резистентности к андрогенам составляет 1 на 20 000 рождений мальчиков (Grumbach u. Conte, 1998). У детей иногда обнаруживают яички в паховых каналах или паховые грыжи. Однако основанием для диагностики синдрома часто становится отсутствие менструаций, несмотря на появление признаков полового созревания. Диагностика Характерные клиническая картина и гормональный профиль — феминизация, первичная аменорея, слепо заканчивающееся влагалище, повышенный уровень ЛГ и резко повышенный уровень тестостерона в сыворотке крови в постпубертатном периоде — позволяют поставить правильный диагноз. До наступления пубертатного периода клиническая картина и гормональный профиль неинформативны. Заподозрить синдром позволяют расположенные в паховых областях или в половых губах яички. Иногда яичко обнаруживают во время операции, выполняемой по поводу паховой грыжи. В таких случаях для подтверждения диагноза проводят пробу на резистентность к андрогенам и молекулярно-генетический анализ, позволяющий выявить мутации в гене рецептора к андрогенам. Проба на резистентность к андрогенам основана на биологическом эффекте анаболического андрогенного гормона станозолола на концентрацию СССГ в сыворотке крови. В норме после введения 0,2 мг/кг станозолола в течение 3 дней концентрация СССГ в сыворотке крови через 5—8 дней снижается наполовину. У пациентов с полной резистентностью к андрогенам (тип 5) такого снижения не происходит, а при частичной резистентности к андрогенам концентрация СССГ снижается в различной степени в зависимости от недостаточности маскулинизации, но это снижение выражено в меньшей степени, чем в норме (Sinnecker u. Kohler, 1989; Sinnecker et
Рис. 7-17. Проба на резистентность к андрогенам (Sinnecker et al„ 1997). Снижение концентрации СССГ в сыворотке крови через 3 дня после введения станозолола (0,2 мг/кг) выражено в процентах от исходного значения у пациентов с резистентностью к андрогенам (типы 2-5) и у пациентов контрольной группы с различными аномалиями развития половых органов, но нормальной чувствительностью к андрогенам, Точками обозначены пациенты, линиями - медианы в каждой группе, Звездочки обозначают степень достоверности различий между исследованными группами пациентов (н,д, - недостоверно; * - <0,05; ** - <0,01; *** - <0,001; **** - <0,0001). al., 1997). Результаты пробы на резистентность к андрогенам приведены на рис. 7-17. Эта проба позволяет оценить степень резистентности к андрогенам и тем самым дополняет информацию, получаемую при структурном анализе ДНК. Лечение Лечение полной резистентности к андрогенам не представляет трудностей. Яички следует по возможности сохранить до завершения пубертатного периода, чтобы обеспечить спонтанное развитие по женскому типу. После пубертатного периода их необходимо удалить, так как риск злокачественного их перерождения на третьем десятилетии жизни возрастает до 4—10% (Manuel et al., 1976; Rutgers u. Scully, 1991; Verp u. Simpson, 1987). После гонадэктомии назначают заместительную терапию эстрогенами и гестагенами. При неглубоком влагалище его углубляют с помощью экспандера.
Рис. 7-18. Наружные половые органы пациентки (кариотип 46,XY) с частичной резистентностью к андрогенам (тип 4). Частичная резистентность к андрогенам Если биологическое действие андрогенов нарушено частично, в эмбриональном периоде стимуляция вольфовых протоков и маскулинизация наружных половых органов оказываются неполными. Поскольку выработка антимюллерова гормона и его эффект не нарушены, то происходит полная регрессия мюллеровых протоков. Клиническая картина В зависимости от степени недостаточности рецепторов андрогенов пациенты имеют преимущественно женский фенотип, слепо заканчивающееся влагалище и легкие признаки вирилизации (тип 4), различные варианты амбивалентных гениталий (типы 3 и 2) или нормальный мужской фенотип, при котором, однако, страдают бесплодием, обусловленным азооспермией (тип 1). Фотографии половых органов таких пациентов приведены на рис. 7-18—7-20. В пубертатном периоде из-за частичного эффекта андрогенов, несмотря на высокую концентрацию тестостерона в сыворотке крови, мужские вторичные половые признаки выражены относительно слабо. С другой стороны, повышенная экстрагландулярная продукция эстрогенов приводит к развитию гинекомастии. Рис. 7-19. Наружные половые органы у пациентки (кариотип 46,XY) с частичной резистентностью к андрогенам (тип 3). Разнообразие клинических форм заболевания велико. Хотя, учитывая Х-сцепленный рецессивный тип наследования, в одной и той же семье пациенты должны иметь одинаковый генетический дефект рецептора, степень маскулинизации у них может быть различной. Разнообразие клинических проявлений требует проведения диф-
Рис. 7-20. Наружные половые органы пациента (кариотип 46,XY) с частичной резистентностью к андрогенам (тип 2),
ференциальной диагностики с другими формами ложного мужского гермафродитизма. Диагностика Развитие наружных половых органов отличается значительной вариабельностью. Вольфовы протоки у пациентов либо отсутствуют, либо ги-попластичны или развиты нормально. Производных мюллеровых протоков обычно не бывает. Гормональный профиль до наступления пубертатного периода неинформативен. После стимуляции ХГ уровень тестостерона бывает нормальный, при пробе на резистентность к андрогенам концентрация СССГ снижается в меньшей степени, чем в норме, в отличие от пациентов с полной резистентностью, у которых она не снижается (Sinnecker u. Kohler, 1989; Sinnecker et al., 1997). Различны также биохимические изменения рецепторов андрогенов, которые часто носят качественный характер. Однако нередко в исследованиях на культуре фибробластов, полученных из кожи половых органов, дефект рецепторов выявить не удается (Griffin, 1992). Анализ ДНК позволяет верифицировать диагноз, отличить наследственные формы от новых мутаций и выявить соматический мозаицизм (Hiort et al., 1993; Hiort et al, 1998; Holterhus et al., 1997). От практиковавшегося ранее пробного лечения тестостероном детей, которых можно было воспитывать как девочек, в настоящее время отказались. У таких детей следует по возможности уменьшить риск дополнительной вирилизации во избежание гипертрофии клитора. Лечение Выбор пола для дальнейшего воспитания ребенка зависит от того, насколько выражена недостаточность маскулинизации. Чтобы оценить шансы на достижение достаточной вирилизации лечением высокими дозами тестостерона, проводят пробу на резистентность к андрогенам, а при семейной форме заболевания — также пробное лечение кого-нибудь из более старших членов семьи с этим заболеванием (Sinnecker et al., 1997). В пубертатном периоде часто развивается выраженная гинекомастия. Если предполагается слабый ответ на лечение тестостероном, даже при высоких его дозах, ребенка с амбивалентными половыми органами следует воспитывать как девочку. Для этого по возможности раньше (в те- чение первых 2 лет жизни) прибегают к феминизации наружных половых органов с помощью пластики вульвы. Пластику преддверия влагалища и самого влагалища выполняют в конце пубертатного периода или в более поздние сроки (см. ниже). Гонадэктомию следует выполнять по двум соображениям: во-первых, из-за высокого риска злокачественного перерождения, во-вторых, из-за возможности вирилизации в пубертатном периоде. В отличие от полной резистентности к андрогенам, при частичной резистентности яички у детей, которые воспитываются как девочки, следует обязательно удалять до наступления пубертатного периода. В пубертатном периоде проводят заместительную терапию эстрогенами и гестагенами. Дата добавления: 2014-12-11 | Просмотры: 4336 | Нарушение авторских прав |