|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
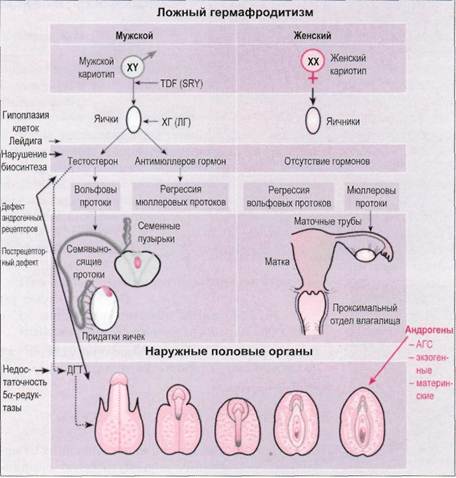
Ложный женский гермафродитизмОпределение Лица с ложным женским гермафродитизмом имеют генетически детерминированный женский пол (TDF отсутствует), яичники и развитые по женскому типу внутренние половые органы, а также вирилизированные наружные половые органы. Ложный женский гермафродитизм характеризуется разнообразием клинических проявлений: от женского фенотипа и легкой вирилизации половых органов, множества вариантов амбивалентных половых органов до внешне нормально развитых мужских гениталий с «пустой» мошонкой. Поскольку развитие внутренних и наружных половых органов при отсутствии функционирующих яичек всегда происходит по женскому типу, то вирилизация плода женского пола может произойти лишь при условии экстрагонадного происхождения андрогенов. Источником андрогенов может быть сам плод (АГС) или мать (прием препаратов, опухоли, лютеома беременности). Механизм развития ложного женского гермафродитизма показан на рис. 7-21. Адреногенитольный синдром Наиболее частой причиной ложного женского гермафродитизма является недостаточность фермента CYP21 (21-гидроксилаза). Этот фермент ло-
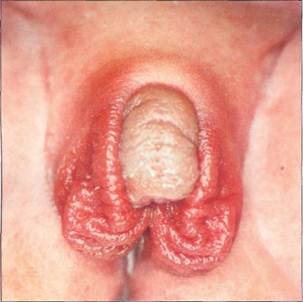
Рис. 7-21. Механизм развития ложного женского гермафродитизма (пораженная область при тех или иных нарушениях окрашена в красный цвет или затушевана). кализуется в корковом веществе надпочечников и катализирует превращение 17в-гидроксипрогесте-рона в кортизол и прогестерона в альдостерон. Накопление субстрата (17в-гидроксипрогестерон), обусловленное недостаточностью фермента, приводит к повышенному образованию андростенди-она и тестостерона, которое влечет за собой вирилизацию наружных половых органов. Клиническая картина в зависимости от степени недостаточности 21-гидроксилазы включает симптомы, характерные для избытка андрогенов и недостаточности кортизола, реже — альдостерона. Степень вирилизации оценивают по классификации Прадера (рис. 7-22). Недостаточность фермента CYP11B1 (11в-гид-роксилаза) приводит к нарушению превращения 11-дезоксикортизола в кортизол и 11 -дезоксикорти-костерона в кортикостерон. При этом нарушении также отмечается избыточная продукция андрогенов, приводящая к внутриутробной вирилизации плода женского пола (рис. 7-23). Недостаточность плацентарной ароматазы Плацентарная ароматаза CYP19 катализирует превращение андростендиона и 16в-гидроксиандро-стендиона в эстрогены, предохраняя таким образом плод от вирилизирующего влияния плацентарных андрогенов. При недостаточности ароматазы не только нарушается синтез эстрогенов, но и происходит накопление андростендиона и тестостерона, которое вызывает внутриутробную вирилизацию плода женского пола (Dittmann, 1989; Shozu et al, 1991). У девочек при рождении отмечаются выраженная в той или иной степени вирилизация наружных половых органов и нормально развитые по женскому типу внутренние половые органы. Для пубертатного периода характерны гипергонадотроп-ный гипогонадизм, гиперандрогенемия и полики-стозные яички. Созревание костной ткани (но не рост) замедлено, и нарушена минерализация костей. Эти проявления можно устранить заместительной терапией эстрогенами.
Рис. 7-22. Классификация фенотипов при ложном женском гермафродитизме (Prader, 1978).
Рис. 7-23. Пациентка с генетически детерминированным женским полом (кариотип 46,ХХ) с ложным женским гермафродитизмом при АГС. Трансплацентарная вирилизация Экзогенные материнские андрогены Назначение беременным производных тестостерона и гестагенов (в том числе производных 19-нортестостерона) может вызвать внутриутробную вирилизацию плода женского пола (Grum-bach et al., 1959). Степень вирилизации зависит от вида стероидного препарата и его дозы и особенно от сроков приема препаратов. Если он приходится на период после 12-й недели после зача- тия, то сращение губно-мошоночных складок уже не произойдет, а разовьется только гипертрофия клитора. Эндогенные материнские андрогены Источником андрогенов, поступающих от матери и вызывающих внутриутробную вирилизацию плода женского пола, могут быть также вирилизирующие опухоли надпочечников или яичников (Murset et al., 1970). Образование андрогенов, вызывающих вирилизацию плода, может быть также обусловлено АГС у матери, лю-теомой беременности и лютеиновыми кистами яичников (Malinak u. Miller, 1965). Как и при недостаточности плацентарной ароматазы, диагностическое значение имеет вирилизация матери во время беременности. Необходимость в специальном лечении обычно отсутствует, так как после рождения вирилизация не прогрессирует, а в пубертатном периоде появляются женские вторичные половые признаки. К хирургической коррекции половых органов прибегают лишь в тех случаях, когда маскулинизация их сильно выражена. Если она заключается только в гипертрофии клитора, то по мере роста ребенка размеры клитора могут постепенно уменьшиться (собственное наблюдение). Поэтому при гипертрофии клитора хирургическая коррекция оправдана у тех пациенток, у которых клитор по размерам напоминает половой член.
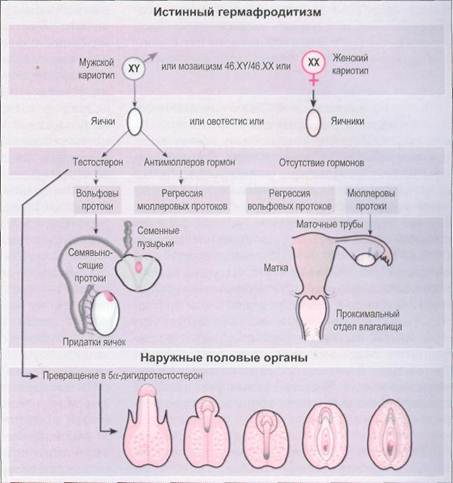
Определение Истинный гермафродитизм характеризуется наличием у пациентов одновременно яичников и яичек. Чаще у пациентов на одной стороне имеется половая железа смешанного строения (овотестис), а на другой — яичник или яичко (реже). Однако возможны и другие комбинации, например яичник на одной стороне и яичко на другой или овотестис с обеих сторон. Этиология и патогенез Причинами истинного гермафродитизма могут быть (рис. 7-24): «мозаицизм по половым хромосомам; • транслокации Y-хромосомы или ее фрагментов на аутосомы или Х-хромосомы; • химеризм. Лица с истинным гермафродитизмом обычно имеют кариотип 46,XX, реже — 46,XY или мозаицизм по половым хромосомам. Считают, что при «скрытом» мозаицизме происходит транслокация генов Y-хромосомы (ген SRY) на аутосомы или половые хромосомы. Кроме того, при двойном оплодотворении или слиянии двух нормальных оплодотворенных яйцеклеток возникает химеризм 46,XX/46,XY (Erhardt, 1979). Клиническая картина Клиническая картина характеризуется значительным разнообразием. Половые органы обычно развиты по промежуточному типу (амбивалентные), однако могут быть развиты также преимущественно по женскому или мужскому типу. Частыми симптомами являются гипоспадия, неполное сращение губно-мошоночных складок, крипторхизм и паховые грыжи, в которых обнаруживают гонады или производные мюллеровых
Рис. 7-24. Механизм возникновения истинного гермафродитизма,
протоков. Развитие внутренних половых органов соответствует ипсилатеральной гонаде: на стороне расположения яичка происходит стимуляция вольфова протока и подавление мюлле-рова, а на стороне расположения яичника развиваются производные мюллерова протока, в то время как вольфов проток подвергается обратному развитию. Поскольку тестикулярная часть овотестиса обычно бывает дисгенетичной, на его стороне внутренние половые органы развиваются по женскому типу. В пубертатном периоде происходит частичная вирилизация и развивается гинекомастия, часто появляются менструации. Диагностика Развитие половых органов по промежуточному типу и пальпируемый овотестис позволяют поставить предварительный диагноз истинного гермафродитизма. Диагностическое значение имеют кариотип 46,XX/46,XY, стимуляционная проба с помощью ХГ и менопаузального гормона, подтверждающая наличие как тестикулярной, так и овариальной ткани, а также гистологическое исследование половых желез, при котором обнаруживают оба вида ткани. Лечение Выбор пола определяется анатомическими соотношениями и возможностью хирургической коррекции. У детей, которых воспитывают как девочек, следует по возможности раньше удалить тестикулярную ткань из-за высокого риска ее злокачественного перерождения и профилактики вирилизации. У них возможно нормальное течение пубертатного периода, так как функция яичника может оказаться для этого достаточной (Nihoul-Fekete et al., 1984). У детей, которых воспитывают как мальчиков, следует удалить производные мюллеровых протоков и овариальную ткань. Поскольку тестикулярная часть овотестиса часто дисгенетична, то ее также следует удалить. Яички, расположенные в мошонке, сохраняют, но при этом регулярно следят за их состоянием. В отдельных случаях при необходимости проводят заместительную гормональную терапию и/или выполняют корригирующую операцию. 7.4. Тактика лечения при гермафродитизме Определение пола Быстрый и обоснованный выбор пола крайне важен для дальнейшего развития ребенка с амбивалентными гениталиями. Этот выбор основывается на оценке того, при каком поле следует рассчитывать на нормальную функцию половых органов. Давая такую оценку, учитывают анатомические соотношения и особенно размеры полового члена и возможность его роста. Следует учитывать также возможности хирургической коррекции и уровень культуры семьи ребенка. Поэтому решение о поле ребенка принимается совместно несколькими специалистами — гинекологом, урологом, детским хирургом, психологом, генетиком. Хирургическое лечение Относительно хирургического лечения на сегодняшний день существуют различные мнения и даются разные рекомендации. Так, одни специалисты считают необходимой по возможности раннюю «полную коррекцию» как наружных, так и внутренних половых органов (пластика вульвы, влагалища, редукция клитора), другие, в частности члены «рабочей группы против насилия в педиатрии и гинекологии», выступают за отказ от пола как признака, характеризующего личность, и любого оперативного вмешательства у детей, так как дети еще не способны выразить свое отношение к этому вопросу. К сожалению, как правило, невозможно знать, смогут ли маленькие дети и их родители ориентироваться в нашем двуполом обществе, если половая принадлежность ребенка однозначно не определена. По-прежнему все, что касается сексуальности, в значительной степени табуизировано. Поэтому родители, которым необходимо принять эту необычность своего ребенка и общаться с ним, ничего не скрывая, оказываются перед большой проблемой. Ребенок, принадлежащий к «третьему полу» (или не имеющий пола), в реальной жизни не только будет подвержен частым конфликтам с обществом, но может оказаться не принятым своими родителями и тем самым недостаточно защищенным. Мы понимаем и одобряем тех, кто ратует за толерантность в обществе, за то, чтобы в нем с уважением, с христианской терпимостью отно-
сились к человеку независимо от происхождения, цвета кожи, расовой и половой принадлежности. К сожалению, мы не видим такой терпимости ни в нашем обществе, ни в другом социокультурном окружении. Достаточно у ребенка небольшого отклонения от нормы (малый рост, ожирение, плохая успеваемость, высокая одаренность, телесный дефект), чтобы его выделили в школьном коллективе и в группах досуга. Особенно травмируются дети с неопределенной половой принадлежностью в пубертатном периоде. Поэтому ничего не предпринимая, врач не снимает с себя ответственность за судьбу таких детей. Необходимо после тщательного обследования и установления диагноза провести беседу с родителями ребенка и вместе с психологом, имеющим достаточный опыт в этой области, разработать индивидуальный план лечения. Мы считаем, что наружные половые органы, если это необходимо, нужно реконструировать в течение первого, но не позднее второго года жизни таким образом, чтобы они полностью соответствовали женским (пластика преддверия влагалища). Это важно для того, чтобы как сам ребенок, так и его сверстники не усомнились в его принадлежности к женскому полу. Редукционную пластику клитора, при которой удаляют лишь его «ствол», сохраняя сосудисто-нервные пучки, в этом возрасте предпринимают лишь в том случае, если размеры клитора слишком велики и он напоминает половой член. Поскольку отдаленные результаты таких операций еще не изучены, отношение к ним должно быть сдержанным. Ранее практиковавшаяся клиторэктомия в настоящее время не применяется. Вагинопластику или операцию по созданию нового влагалища у детей не выполняют, чтобы избежать травмирующих переживаний и болезненного послеоперационного долечивания (например, бужирования). Исходя из сказанного, объем хирургической коррекции наружных половых органов у детей должен быть минимальным. В период полового созревания у пациентки может сформироваться осознанное желание начать половую жизнь. К этому желанию следует отнестись с уважением, оно также должно послужить обоснованием к хирургической коррекции. Пациентке не следует жить с постоянным половым партнером, хотя при ее неуверенности в себе, которую порождает ее необычность, поиск полового партнера затруднителен, с другой стороны, это освобождает ее от обязательств. С наступлением пубертатного периода ткани половых органов под влиянием эстрогенов становят- ся более податливыми и эластичными. Пациентки уже могут самостоятельно принимать решения, касающиеся изменения своего тела и выполнения хирургической коррекции. Лишь к этому времени должны выполняться большие по объему реконструктивные вмешательства с учетом пожелания пациенток, а не только их родителей. У лиц с генетически детерминированным мужским полом (наличие Y-хромосомы), которые воспитываются как девочки, необходимо раннее удаление гонад (до начала пубертатного периода). Остаточная функция гонад таит в себе риск гетеросексуального (мужского) развития в пубертатном периоде. Единственным исключением являются случаи полной резистентности к анд-рогенам, при которой гонады следует сохранять и после пубертатного периода, чтобы способствовать спонтанной феминизации. В связи с риском злокачественного перерождения дисгенетичные гонады, клетки которых содержат Y-хромосому, подлежат удалению также у пациентов, которые воспитываются как мальчики. Лишь при условии, что яички находятся в мошонке, отчетливо пальпируются и имеется возможность наблюдать пациентов, яички оставляют, так как при достаточной остаточной функции они могут обеспечить спонтанное половое созревание мальчиков. Гормональная терапия Заместительную терапию половыми гормонами у детей с гипогонадизмом начинают к началу пубертатного периода: у девочек в 12 лет, у мальчиков в 13 лет. Цель гормональной терапии — обеспечить половое развитие, близкое к нормальному. Девочкам вначале назначают конъюгирован-ные эстрогенные препараты по 0,3 мг/сут в течение длительного времени. Через 6—12 мес или после появления менструаций переходят на циклическую эстроген-гестагенную терапию. Доза препаратов при этом соответствует дозе при заместительной терапии. Эстрогенный препарат назначают с 1-го по 21-й день, гестагенный (например, медроксипрогестерона ацетат) — с 12-го по 21-й, в период с 22-го по 28-й день препараты отменяют. Дозу эстрогенов в течение первых 2—3 лет повышают до соответствующей 0,6—1,25 мг конъюгированного препарата. Применение препаратов, подавляющих овуляцию, нецелесообразно из-за их сильного нефизиологичного действия.
У пациенток с задержкой роста (например, при синдроме Ульриха—Тернера) при назначении высоких доз эстрогенов следует учитывать их угнетающее действие на рост тела. Психологический аспект лечения Рождение ребенка с амбивалентными гениталиями вызывает серьезные психосоциальные проблемы. Не следует пытаться определить половую принадлежность такого ребенка уже в родильном зале. Не следует делать также предположений. Родителям необходимо объяснить, что пол ребенка пока точно установить невозможно. Им следует также сообщить, что формирование пола еще не завершено, так же как оказывается незавершенным иногда формирование сердца или почек. С помощью целенаправленного обследования следует по возможности быстро установить причину аномалии и связанные с ней анатомические изменения. И лишь после этого решением консилиума в составе детского эндокринолога, гинеколога, уролога (или детского хирурга), психолога и генетика с учетом психосоциального и культурного окружения ребенка и мнения родителей определяют его пол. Конечно, такое решение не может быть абсолютно правильным при любых обстоятельствах. Однако следует приложить все усилия для того, чтобы правильно оценить каждый случай с учетом накопленных знаний и опыта и принять такое решение, которое в дальнейшем по возможности уменьшит проблемы ребенка. Мы считаем, что в этом вопросе следует проявлять сдержанность и осторожность и не одобряем радикальную коррекцию, которая направлена только на исправление анатомического дефекта без учета наклонностей ребенка, его характера и физиологических особенностей. Однако при всей сдержанности и недостаточной изученности проблемы не следует доходить до отрицания необходимости лечения и оставлять ребенка и его родителей без помощи и поддержки. Быстрое и решительное определение пола ребенка и постоянная врачебная и психологическая помощь, оказываемая специалистами смежных дисциплин, могут создать предпосылки для нормальной жизни (в том числе половой) ребенка в дальнейшем. Литература Andersson S., Barman DM., Jenkins E.P., Russell D.W. Deletion of steroid 5a-reductase 2 gene in male pseudohermaphroditism // Nature. - 1991. - Vol. 354. - P. 159-161. Baker T. G. A quantitative and cytological study of germ cells in the human ovaries // Proc. R. Soc. Lond. В Biol. Sci. - 1963. - Vol. 158. - P. 417. Bose H.S., Sujiwara Т., Strauss J.F. 3rd, Miller W.L. The pathophysiology and genetics of congenital lipiod adrenal hyperplasia. International Congenital Lipoid Adrenal Hyperplasia Consortium // N. Engl. J. Med. — 1996. — Vol. 335. - P. 1870-1878. Brown Т.К., Lubahn D.B., Wilson EM. et al. Functional characterization of naturally occurring mutual androgen receptors from subjects with complete androgen insensitiv-ity// Mol. Endocrinol. - 1990. - Vol. 4. - P. 1759-1772. Burstein S., Grumbach MM., Kaplan S.L. Early determination of androgen-responsiveness is important in the management of microphallus // Lancet. — 1979. — Vol. 2. — P. 983-986. Chung В., Picado-Leonard J., Haniu M. et al. Cytochrome P-450cl7 (steroid 17a-hydroxylase/17,20-lyase): Cloning of human adrenal and testis cDNAs indicates the same gene is expressed in both tissues // Proc. Natl. Acad. Sci. USA. - 1987. - Vol. 84. - P. 407-311. Conte F.A., Grumbach M.M., Ito Y. et al. A syndrome of female pseudohermaphroditism, hypergonadotropic hypogonadism, and multicystic ovaries associated with missense mutations in the gene encoding aromatase (P450arom) // J. Clin. Endocrinol. Metab. - 1994. - Vol. 78. - P. 1287— 1292. Dittmann R. W. Pranatal wirksame Hormone und Verh-altensmerkmale von Patientinnen mil den beiden klassis-chen Varianten des 21-Hydroxylase-Defektes. Bin Beitrag zur Psychoendokrinologie des adrenogenitalen Syndroms. Europaische Hochschulschriften, Reihe VI Psychologic — Frankfurt; Bern; N.Y.; Paris: Peter Lang, 1989. - S. 1-333. Ehrhardt A.A. Psychosexual adjustment in adolescence in patients with congenital abnormalities of their sex organs // Genetic Mechanisms of Sexual Development / Eds H.L. Vallet, I.H. Porter. - N.Y.: Academic Press, 1979. -P. 473-483. Ehrhardt A.A., Epstein R., Money J. Fetal androgens and female gender identity in the early-treated adrenogenital syndrome // Johns Hopkins Med. J. — 1968. — Vol. 122. - P. 160-167. Ehrhardt A.A., Meyer-Bahlburg H.F.L. Effects of prenatal sex hormones on gender-related behavior // Science. — 1981. -Vol. 211. - P. 1312-1318. Faiman C., Winter J.S.D. The control of gonadotropin secretion in complete testicular feminization // J. Clin. Endocrinol. Metab. - 1974. - Vol. 39. - P. 631-638.
Fakhry J., Khoury A., Kotval P.S., Noto R.A. Sonography of autonomous follicular ovarian cysts in precocious pseudopuberty // J. Ultrasound. Med. - 1988. - Vol. 7. -P. 597-603. Ferguson-Smith M.A. Karyotype-phenotype correlations in gonadal dysgenesis and their bearing on the pathogenesis of malformations // J. Med. Genet. — 1965. — Vol. 2. — P. 142-155. Ferguson-Smith M.A., Goodfellow P.N. SRY and primary sex reversal syndromes // The Metabolic and Molecular Basis of Inherited Disease / Eds C.R. Scriver, A.L. Beau-det, W.S. Sly, D. Valle. - 7th ed. - N.Y.: McGraw-Hill, 1995. - P. 739-748. Griffin J.E. Androgen resistance — the clinical and molecular spectrum // N. Engl. J. Med. - 1992. - Vol. 326. -P. 611-618. Grumbach M.M., Conte F.A. Disorders of sex differentiation // Williams Textbook of Endocrinology / Eds J.D. Wilson, D.W. Foster, H.M. Kronenberg, P.R. Larsen. — 9th ed. - Philadelphia: WB Saunders, 1998. - P. 1303-1425. Grumbach M.M., Ducharme J.R., Moloshok R.E. On the fetal masculinizing action of certain oral progestins // J. Clin. Endocrinol. Metab. - 1959. - Vol. 19. - P. 1369-1380. Hall P. F. Role of cytochromes P-450 in the biosynthesis of steroid hormones // Vitam. Horm. — 1985. — Vol. 42. - P. 315-368. Hiort 0., Huang Q., Sinnecker G.H. G. et al. Rapid characterization of mutations of the androgen receptor in patients with androgen insensitivity syndromes: application for diagnosis, genetic counseling, and therapy // J. Clin. Endocrinol. Metab. - 1993. - Vol. 77. - P. 262-266. Hiort O, Sinnecker G.H.G., Holterhus P.M. et al. The clinical and molecular spectrum of androgen insensitivity syndromes // Am. J. Med. Genet. - 1996. - Vol. 63. - P. 218-222. Hiort O., Sinnecker G.H.G., Holterhus P.M. et al. Inherited and de novo androgen receptor gene mutations: investigation of single case families // J. Pediatr. — 1998. — Vol. 132. - P. 939-943. Hiort O., Willenbring H., Albers N. et al. Molecular genetic analysis and hCG stimulation tests in the diagnosis of prepubertal patients with partial 5a-reductase deficiency // Eur. J. Pediatr. - 1996. - Vol. 155. - P. 445-451. Holterhus P.M., Bruggenwirth H.T., Hiort O. et al. Mosaicism due to a somatic mutation of the androgen receptor gene determines phenotype in androgen insensitivity syndrome // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. - P. 3584-3589. Imperato-McGinley J., Guerrero L., Gautier Т., Peterson R.E. Steroid 5a-reductase deficiency in man: an inherited form of male pseudohermaphroditism. — Science. — 1974. — Vol. 186. - P. 1213-1215. Imperato-McGinley J., Peterson R.E., Gautier Т., Sturla E. Male pseudohermaphroditism secondary to 5a-reduc-tase deficiency — a model for the role of androgens in both the development of the male phenotype and the evolution of a male gender identity // J. Steroid Biochem. — 1979. — Vol. 11. - P. 637-645. Josso N. L'hormone anti-mullerienne: une foeto-pro-teine? // Arch. Fr. Pediatr. - 1975. - Vol. 32. - P. 109-111. Leshin M., Griffin J.E., Wilson J.D. Hereditary male pseudohermaphroditism associated with an unstable form of 5a-reductase // J. Clin. Invest. - 1978. - Vol. 62. - P. 685-691. MacDonald P.C., Madden J.D., Brenner P.F. et al. Origin of estrogen in normal men and in women with testicular feminization //J. Clin. Endocrinol. Metab. — 1979. — Vol. 49. - P. 905-916. Madan K., Gooren L., Schoemaker J. Three cases of sex chromosome mosaicism with a nonfluorescent Y // Hum. Genet. - 1979. - Vol. 46. - P. 295-304. Malinak L.R., Miller G.V. Bilateral multicentric ovarian luteomas of pregnancy associated with masculinization of a female infant // Am. J. Obstet. Gynecol. — 1965. -Vol. 91. - P. 251-256. Manuel M., Katayama K.P., Jones H. W. The age of occurrence of gonadal tumors in intersex patients with a Y chromosome // Ibid. - 1976. - Vol. 124. - P. 293-300. Marcelli M., Tilley W.D., Wilson СМ.. et al. A single nucleotide substitution introduces a premature termination codon into the androgen receptor gene of a patient with receptor-negative androgen resistance // J. Clin. Invest. — 1990. - Vol. 85. - P. 1522-1528. Masica D.N., Money J., Ehrhardt A.A. Fetal feminization and female gender identity in the testicular feminizing syndrome of androgen insensitivity // Arch. Sex. Behav. — 1971. -Vol. 1. - P. 131-142. McPhaul M.J., Marcelli M., Tilley W.D. et al. Molecular basis of androgen resistance in a family with a qualitative abnormality of the androgen receptor and responsive to high-dose therapy // J. Clin. Invest. - 1991. - Vol. 87. -P. 1413-1421. Money J., Ehrhardt A.A. Man and Woman. Boy and Ggirl. — Baltimore; Lond.: The Johns Hopkins University Press, 1972. Money J., Schwartz M. Dating, romantic and nonro-mantic friendships, and sexuality in 17 early-treated adrenogenital females, aged 16—25 // Congenital Adrenal Hyperplasia / Eds P.A. Lee, L.P. Plotnick, A.A. Kowarski, C.J. Migeon. — Baltimore: University Park Press, 1977. — P. 419-431. Money J., Schwartz M., Lewis V.G. Adult erotosexual status and fetal hormonal masculinization and demasculin-ization: 46,XX congenital virilizing adrenal hyperplasia and
46,XY androgen-insensitivity syndrome compared // Psy-choneuroendocrinology. - 1984. - Vol. 9. - P. 405-414. Moore R.J., Griffin J.E., Wilson J.D. Diminished 5a-reductase activity in extracts of fibroblasts cultured from patients with familial incomplete male pseudohermaphroditism, type 2 // J. Biol. Chem. - 1975. - Vol. 250. - P. 7168-7172. Mueller R.F. The Denys-Drash syndrome // J. Med. Genet. - 1994. - Vol. 31. - P. 471-177. Muller M., Bidlingmeier F., Forster C, Knorr D. Psy-chosexuelles Verhalten von Frauen mil adrenogenitalem Syndrom // Helv. Paediatr. Acta. - 1982. - Bd 37. - S. 571-580. Murset G, Zachmann M., Prader A. et al. Male external genitalia of a girl caused by a virilizing adrenal tumor in the mother. Case report and steroid studies // Acta Endocrinol. (Copenh.). - 1970. - Vol. 65. - P. 627-638. Nihoul-Fekete C, Lortat-Jacob S., Cachin O., Josso N. Preservation of gonadal function in true hermaphroditism // J. Pediatr. Surg. - 1984. - Vol. 19. - P. 50-55. Nowakowski H., Lenz W. Genetic aspects in male hypogonadism // Recent Prog. Horm. Res. — 1961. — Vol. 17. - P. 53. O'Rahilly. The development of the vagina in the human // Birth Defects Orig. Artie. Ser. - 1977. - Vol. 13. -P. 123-136. Pinsky L., Kaufman M., Straisfeld C. et al. 5a-reductase activity of genital and nongenital skin fibroblasts from patients with 5a-reductase deficiency, androgen insensitivity, or unknown forms of male pseudohermaphroditism // Am. J. Med. Genet. - 1978. - Vol. 1. - P. 407-416. Prader A. Storungen der Geschlechtsdifferenzierung (In-tersexualitat) // Klinik der inneren Sekretion / Labhardt A. (Hrsg). — Berlin; Heidelberg; N.Y.: Springer, 1978. -S. 654-688. Price P., Wass J.A.H., Griffin J.E. et al. High dose androgen therapy in male pseudohermaphroditism due to 5a-reductase deficiency and disorders of the androgen receptor // J. Clin. Invest. - 1984. - Vol. 74. - P. 1496-1508. Rubin R.T., Reinisch J.M., Haskett R.F. Postnatal gonadal steroid effects on human behavior // Science. — 1981. -Vol. 211. - P. 1318-1324. Rutgers J.L., Scully R.E. The androgen insensitivity syndrome (testicular feminization): a clinicopathologic study of 43 cases // Int. J. Gynaecol. Pathol. - 1991. - Vol. 10. -P. 126-144. Shozu M., Akasofu K., Harada Т., Kubota Y. A new cause of female pseudohermaphroditism: placental aro-matase deficiency // J. Clin. Endocrinol. Metab. — 1991. — Vol. 72. - P. 560-566. Siiteri P.K., Wilson J.D. Testosterone formation and metabolism during male sexual differentiation in the human embryo // Ibid. - 1974. - Vol. 38. - P. 113-125. Sinclair A.H., Berta P., Palmer M.S. et al. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif// Nature. — 1990. - Vol. 346. - P. 240-244. Sinnecker G., Kohler S. Sex hormone-binding globulin response to the anabolic steroid stanozolol: evidence for its suitability as a biological androgen sensitivity test // J. Clin. Endocrinol. Metab. - 1989. - Vol. 68. - P. 1195-200. Sinnecker G.H.G., Hiort O., Dibbelt L. et al. Phenotypic classification of male pseudohermaphroditism due to steroid 5a-reductase 2 deficiency // Am. J. Med. Genet. — 1996. - Vol. 63. - P. 223-230. Sinnecker G.H.G, Hiort O., Nitsche E.M. et al. Functional assessment and clinical classification of androgen sensitivity in patients with mutations of the androgen receptor gene. German Collaborative Intersex Study Group // Eur. J. Pediatr. - 1997. - Vol. 156. - P. 7-14. Sinnecker G.H.G., Sinnecker R., Muhlenberg R., Hiort O. Gender assignment in patients with partial androgen insensitivity syndrome: significance of genotype and assessment of androgen receptor function (Abstract 23) // Horm. Res. - 1995. - Vol. 44. - Suppl. 1. - P. 6. Sinnecker G., WilligR.P., Stahnke N., Braendle W. 46,XY Reine Gonadendysgenesie (Swyer-Syndrom). Klinische und endokrinologische Befunde // Monatsschr. Kinderheilkd. — 1982. - Bd 130. - S. 795-797. Stocco D.M., Clark B.J. The role of the steroidogenic acute regulatory protein in steroidogenesis // Steroids. — 1997. - Vol. 62. - P. 29-36. Themmen A.P.N., Brunner H.G. Luteinizing hormone receptor mutations and sex differentiation // Eur. J. Endocrinol. - 1996. - Vol. 134. - P. 533-540. Tint G.S., Salen G, Batta A.K. et al. Correlation of severity and outcome with plasma sterol levels in variants of the Smith-Lemli-Opitz syndrome // J. Pediatr. — 1995. — Vol. 127. - P. 82-87. Tsuchiya K., Reijo R., Page D.C., Disteche CM. Gona-doblastoma: molecular definition of the susceptibility region on the Y chromosome // Am. J. Hum. Genet. — 1995. - Vol. 57. - P. 1400-1407. Verp M.S., Simpson J.L. Abnormal sexual differentiation and neoplasia // Cancer Genet. Cytogenet. — 1987. — Vol. 25. - P. 191-218. Wagner Т., Wirth J., Meyer J. et al. Autosomal sex reversal and campomelic dysplasia are caused by mutations in and around the SRY-related gene SOX9 // Cell. - 1994. -Vol. 79. - P. 1111-1120. Walsh P.C., Madden J.D., Harrod M.J. et al. Familial incomplete male pseudohermaphroditism, type 2. Decreased dihydrotestosterone formation in pseudovaginal perineoscrotal hypospadias // N. Engl. J. Med. - 1974. - Vol. 291. -P. 944-949.
Дата добавления: 2014-12-11 | Просмотры: 1442374 | Нарушение авторских прав |





 Истинный гермафродитизм
Истинный гермафродитизм