|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
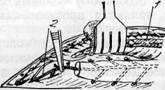
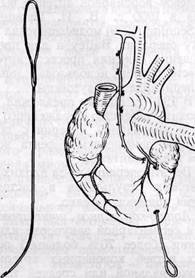
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ. Отсутствие достаточно эффективных способов консервативного лечения коронаросклероза и, следовательноОтсутствие достаточно эффективных способов консервативного лечения коронаросклероза и, следовательно, ишемической болезни сердца вызывает необходимость разработки различных методов хирургического лечения этого заболевания. Большую роль в развитии хирургии коронарных артерий сыграло внедрение в клиническую практику искусственного кровообращения и селективной коронарографии. Применение коронарографии позволило кардиохирургам прижизненно оценивать состояние коронарного кровообращения и проводить более дифференцированное лечение больных ишемической болезнью сердца. В настоящее время не вызывает сомнения тот факт, что если при резких стено-зирующих и окклюзионных поражениях коронарных артерий консервативная терапия неэффективна, показано хирургическое лечение по принципу создания новых источников кровоснабжения миокарда. За последние полвека предлагалось множество принципиально различных хирургических способов лечения ишемической болезни сердца. Наиболее ранние попытки хирургического вмешательства были направлены на облегчение болевого синдрома и производились на нервной системе (Ю. Ю. Дженалидзе, 1950; В. И. Казанский, 1952; Jonesco, 1920; Eppinger, Hoffer, 1923; Arnulf, 1958). Позже было предложено множество операций с целью образования сосудистых анастомозов сердца с окружающими тканями. Для создания окольного кровообращения к сердцу подшивали сальник (O'Shaugnessy, 1936), прямую мышцу живота (П. И. Тофило, 1955), большую грудную мышцу (Loewe, 1957), петлю тощей кишки (Key с соавт., 1954), желудок, диа-фрагмальный лоскут, ткань селезенки. В 1939 г. Fieschi с целью усиления притока крови к мышце сердца предложил перевязывать внутренние груд- ные артерии. В настоящее время все вышеперечисленные операции не применяют ввиду их малой эффективности и плохих отдаленных результатов. Имплантация внутренней грудной артерии в миокардотносится к методам «непрямой» реваскуляризации миокарда. Предложенная в 1946г. канадским хирургом Viniberg, она до сих пор находит применение в клинике. Положительный результат имплантации внутренней грудной артерии в миокард объясняется своеобразным строением мышцы сердца, особенностями его кровоснабжения и способностью мышцы сердца активно утилизировать кислород крови. Вокруг каждого мышечного волокна имеется сосудистое образование в виде губки, в котором калибр сосудов варьирует от артериол и синусов до капилляров. Вытекающая из внутренней грудной артерии кровь попадает прямо в си-нусоидную губку, которая быстро ее впитывает. Именно благодаря этому, по мнению Viniberg (1972), у 80% больных имплантированный сосуд остается открытым и является добавочным источником питания ишемизиро-ванного миокарда., После того как Sones (1962) ангио-графически подтвердил проходимость имплантированного сосуда через длительное время после операции, появились различные модификации этого метода: имплантация желудочно-саль-никовой, селезеночной, интеркостальной артерий; имплантация венозного аутотрансплантата, анастомозирован-ного с аортой, а также внутренней грудной артерии с сопутствующей веной, окружающей клетчаткой, плеврой и мышцами. Показания к операции.Имплантация внутренней грудной артерии в миокард показана больным с частыми приступами стенокардической боли, возникающей не только при физической нагрузке, но и в покое. Показания к операции основываются на тщательном изучении данных коронарографии и левожелудочковой вентрикулографии. Ее применяют больным с диффузным поражением одной из главных коронарных артерий сердца — передней межжелудочковой ветви, огибающей ветви левой коронарной артерии или правой коронарной артерии с недостаточным дистальным руслом, когда диаметр артерии ниже поражения меньше 1 мм. При поражении передней межжелудочковой ветви левой коронарной артерии методом выбора является имплантация правой внутренней грудной артерии через срединный доступ. Если имеется диффузное поражение огибающей ветви левой коронарной артерии или дистальных отделов правой коронарной артерии, можно использовать имплантацию левой грудной артерии через левостороннюю зад-не-боковую торакотомию. Имплантация двух внутренних грудных артерий показана больным с тяжелым диффузным поражением системы левой и правой коронарных артерий; ее выполняют через срединный доступ. Важным фактором при определении показаний к операции имплантации внутренней грудной артерии в миокард является состояние сократительной функции миокарда. Лево-желудочковая вентрикулография дает объективные данные о состоянии сердечной мышцы. Наиболее благоприятные клинические результаты операции Вайнберга наблюдаются у больных с хорошей сократительной функцией левого желудочка и нормальным конечным диастолическим давлением, не превышающим 20 мм рт. ст. Такие условия обычно имеют место при поражении только одной из коронарных артерий сердца. И наоборот, у больных с поражением системы левой и правой коронарных артерий часто выявляются нарушения сократительной функции миокарда, зоны повреждения миокарда и передне-боковой верхушечной или диафрагмальной стенки левого желудочка. Нарушение сократительной функции миокарда, повышение конечного диастолического давления более 30 мм рт. ст., особенно у больных старше 60 лет, являются противопоказанием к операции. В настоящее время операцию Вайнберга как самостоятельное оперативное лечение у больных ишеми-ческой болезнью сердца выполняют редко. Чаще она является вспомогательным методом улучшения коронарного кровообращения при выполнении аорто-коронарного шунтирования. Техника операции. Срединную стер-нотомию применяют у большинства больных. Этот доступ показан при имплантации двух внутренних грудных артерий, правой внутренней грудной артерии и у больных старше 60 лет. Левостороннюю заднюю боковую торакотомию используют для имплантации левой внутренней грудной артерии при поражении огибающей ветви левой коронарной артерии или дистальных отделов правой коронарной артерии. Выделение артерии. После выполнения торакотомии и отделения подэпикардиальной клетчатки от грудной стенки можно увидеть внутреннюю грудную артерию в средней и верхней ее трети. В нижней части артерия прикрыта m. transversus tho-racis и прилежит близко к срединной линии. Поэтому при стернотомии необходимы осторожные манипуляции, чтобы не повредить артерию в дисталь-ном отделе. Выделение артерии начинают на уровне IV или V реберных хрящей. После рассечения мягких тканей до хрящей рядом расположенных ребер выделяют межреберную артерию, отходящую от внутренней грудной артерии, и пересекают ее между зажимами. Проксимальный ее конец перевязывают, а периферический — коагулируют. Выделение внутренней грудной артерии с сопровождающей ее веной, окружающей клетчаткой, плеврой и мышцами производят до места отхождения ее от подключичной артерии. Книзу при левосторонней торакотомии внутреннюю грудную артерию выделяют до IV или VII меж-реберья. При стернотомии выделение Рис. 59. Выделение внутренней грудной артерии со вскрытием влагалища прямой мышцы живота: / — прямая мышца живота; 2 — внутренняя грудная артерия артерии можно продлить до анастомо-зирования ее с нижней эпигастраль-ной артерией, для чего необходимо вскрыть влагалище прямой мышцы живота (рис. 59). Выделенный стебель рассекают дистально между двумя зажимами и концы его перевязывают. Готовый к имплантации стебель заворачивают в марлевую салфетку, смоченную раствором папаверина с гепарином. Если для имплантации используют обе артерии, то сначала выделяют левую грудную артерию. Техника имплантации. При имплантации внутренней грудной артерии через левостороннюю то-ракотомию после выделения артерии вскрывают перикард кпереди от диаф-рагмального нерва и рану перикарда широко растягивают. Для формирования туннеля в миокарде и проведения имплантируемого сосуда мы применяем зонд-проводник (рис. 60). При поражении огибающей ветви левой коронарной артерии делают надрез миокарда на глубину 2—3 мм в области боковой поверхности диа-фрагмальной стенки левого желудочка. Зондом-проводником формируют туннель в миокарде глубиной 2—3 мм и длиной 3—4 см. Шелковую лигатуру заправляют в ушко петли и проводят через туннель (рис. 61). Перед проведением внутренней артерии в туннель на имплантируемом участке артерию частично освобождают от сопровождающих ее мягких тканей и срезают концы перевязанных концов межреберных ветвей. Имплантируемый сосуд фиксируют у верхушки и основания 2—3 шелковыми швами. Если имплантацию выполняют при поражении правой коронарной артерии, туннель начинают на боковой поверхности диафраг-мальной стенки левого желудочка и продлевают до середины диафраг-мальной поверхности правого желудочка. Имплантацию правой внутренней грудной артерии производят при поражении передней межжелудочковой ветви левой коронарной артерии. Применяют срединную стернотомию. Перикард вскрывают длинным продольным разрезом с использованием дополнительного разреза в области левого сердца. Сердце приподнимают левой рукой и его ложе заполняют 2—3 большими марлевыми салфетками, что значительно облегчает технику операции и, как показывает клинический опыт, существенно не вызывает нарушения гемодинамики. При поражении передней межжелудочковой ветви левой коронарной артерии туннель располагают параллельно по ходу артерии слева от нее на 0,5—1 см. При поражении огибающей ветви левой коронарной артерии и дистальных участков правой коронарной артерии через срединный доступ производят имплантацию левой внутренней грудной артерии.Поддерживая верхушку сердца левой рукой, формируют туннель на диафрагмаль-ной и боковой стенках левого желудочка с введением зонда-проводника по направлению к верхушке сердца. Глубина туннеля не должна превышать 2—3 мм, так как стенка правого желудочка на диафрагмальной поверхности тонкая и возможно ее прободение. В случае прободения стенки желудочка и появления кровотечения из его полости туннель не пригоден для имплантации. Место повреждения ушивают и формируют новый туннель. Операцию заканчивают ушиванием перикарда 2—3 швами без сдавления имплантированного стебля. Дренируют полость перикарда и загрудин- ное пространство, а при левосторонней торакотомии — левую плевральную полость. Результаты операции.Операционная летальность составляет 2—4% при имплантации одной внутренней грудной артерии в миокард и 6—8% — при имплантации в миокард двух внутренних грудных артерий (Bailey с соавт., 1970; Favaloro с соавт., 1971, и др.). По данным Favaloro (1971), из 288 больных, которым была произведена имплантация одной внутренней грудной артерии, умер только 1, а из 326 больных с имплантацией в миокард двух внутренних грудных артерий умерли 16 человек. Повышение летальности больных при имплантации в миокард двух внутренних грудных артерий связано с тем, что операцию выполняют при поражении системы правой и левой коронарных артерий при нарушенной сократительной функции миокарда, часто у больных, перенесших инфаркт миокарда. Особо опасна операция у больных с поражением главного ствола левой коронарной артерии, после которой летальность достигает 24%. Причиной смерти у большинства является инфаркт миокарда. Данные литературы о клинических результатах операции разноречивы. Большинство авторов отмечают значительное улучшение состояния у 80 — 92% больных (Viniberg, 1965; Bigellow, 1966; Ferguton с соавт., 1968, и др.). Из 2000 больных, оперированных Favaloro (1971), у 33% получены отличные результаты, у 30% — хорошие, у 15% — удовлетворительные. Лишь у 22% больных не отмечено улучшения состояния. По данным селективной корона-рографии, у 92—95% больных им-плантат остается открытым через 1 год после операции и у 60% больных имеется связь его с коронарным кровообращением. Нами операция Вайнберга выпол-
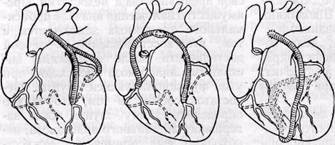
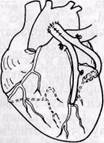
Рис. 60. Зонд-проводник для формирования туннеля в миокарде Рис. 61.Имплантация внутренней грудной артерии в миокард левого желудочка нена у 35 больных. Значительное клиническое улучшение отмечено у 57% больных, когда прекратились приступы стенокардии. У 32% больных отмечено уменьшение интенсивности и частоты приступов стенокардии и у 11 % — операция оказалась неэффективной. Умерли 2 больных. Причиной смерти был острый инфаркт миокарда и легочная недостаточность. Операции «прямой» реваскуляризации миокарда. В настоящее время новые достижения в лечении ишеми-ческой болезни сердца обусловлены внедрением в клиническую практику прямых операций на коронарных артериях. Восстановительные операции на венечных артериях начали применять с 1956 г., когда Bailey успешно выполнил эндартериэктомию из пораженного сегмента коронарной артерии, использовав специальную кюретку May. В Советском Союзе первая успешная операция эндартериэктомии у больного с изолированным поражением передней межжелудочковой вет- ви левой коронарной артерии выполнена в 1960 г. В. И. Прониным. Senning (1959) модифицировал технику операции Bailey и для предотвращения сужения просвета артерии в месте разреза использовал заплату из перикарда или аутовены. В 1940 г. Миггау предложил производить резекцию пораженного сегмента коронарной артерии с последующим замещением дефекта венозным трансплантатом. Все эти операции из-за плохих клинических результатов в настоящее время применяют редко. Аорто-коронарное шунтирование. При сегментарной закупорке или сужении (более 70% больных) основных ветвей коронарных артерий в проксимальной или средней трети с сохраненным дистальным кровотоком показано аорто-коронарное шунтирование. Это оперативное вмешательство, восстанавливая кровоток в пораженной коронарной артерии, приводит к улучшению метаболизма сердечной мышцы, ликвидирует симптомы стенокардии, повышает активность больных и уменьшает угрозу инфаркта миокарда. М. Д. Князев и Б. В. Шабалкин (1973) подчеркивают, что объем реконструктивной операции зависит от типа кровоснабжения сердца и значения пораженных артерий в кровоснабжении ишемизированного участка миокарда. При атеросклероти-ческом поражении нескольких коронарных артерий хирургическая тактика зависит оттого, какие артерии поражены и какова их роль в кровоснабжении миокарда. При стенози-ровании правой коронарной и передней нисходящей артерий операцией выбора является двойное аорто-коронарное шунтирование при правом типе кровоснабжения сердца; при левом типе — только шунтирование левой нисходящей артерии. При выраженном атеросклеротическом стенозиро-вании левой передней нисходящей артерии (более 70% больных) и умерен- ном поражении (50—60%) аорто-коронарное шунтирование может быть выполнено с передней нисходящей артерией. При поражении 3 коронарных артерий достаточно восстановить кровоток по двум магистральным сосудам: правой коронарной и передней нисходящей артериям. По данным Cibaski и Lehan (1972), при хронической ишемии миокарда между огибающей и передней нисходящей коронарными артериями образуется от 4 до 7 анастомозов, которые располагаются обычно на передней верхушечной поверхности сердца и, кроме того, 1—2 анастомоза между огибающей и правой коронарными артериями. При наложении лигатуры на переднюю нисходящую коронарную артерию у собак с хронической ишемией миокарда ретроградный кровоток в левой огибающей артерии снижался до 12% исходного уровня, а артериальное давление в ней падало до 30% исходного уровня. В то же время при окклюзии правой коронарной артерии ретроградный кровоток в левой огибающей артерии снижался в среднем лишь до 92% исходного уровня и артериальное давление в ней — до 95%. При одновременной перевязке передней нисходящей и правой коронарных артерий ретроградный кровоток в левой огибающей артерии снижался до 1 % исходного со столь же незначительным падением давления в ней. Окклюзия анастомозов между передней нисходящей и левой огибающей артериями приводила к снижению ретроградного кровотока в левой огибающей артерии до 23% исходного уровня и падению артериального давления в ней до 41%, а коллатерального миокар-диального кровотока — до 62% исходного. При одновременной перевязке этих анастомозов и правой коронарной артерии ретроградный кровоток в левой огибающей артерии снижался с 82 ± 44 до 10 ± 7 мл/мин, амиокар-диальный кровоток — с 80 + 9 до 33 ± 6 мл/мин/100 г сердца. Исходя из этих данных предложения М. Д. Князева и Б. В. Шабалкина следует признать обоснованными. Операция эффективна, если сохранена в достаточной степени сократительная функция левого желудочка, определяемая достоверно при помощи вентрикулографии. При фракции изгнания левого желудочка (отношение ударного объема левого желудочка к конечно-диа-столическому объему) менее 25% после аорто-коронарного шунтирования умирают 55% больных. При фракции изгнания левого желудочка 30% плохие результаты после аорто-коронарного шунтирования и летальный исход наблюдаются у 80% больных (Cohn и др., 1975). При фракции выброса левого желудочка свыше 40% послеоперационная летальность, по данным американских хирургов, составляет 2—4%. Аорто-коронарное шунтирование стали применять в клинике с 1967 г. (Fovoloro). С тех пор техника выполнения ее стандартизировалась, за исключением некоторых деталей. В настоящее время принято накладывать анастомозы по возможности проксимально на коронарной артерии с таким расчетом, чтобы снабдить кровью как можно большую часть миокарда. У большинства больных поражение коронарных артерий локализуется в проксимальной части и поэтому обойденный шунтом сегмент ее в результате изменения кровотока в нем после операции со временем тромбируется у 50%больных. Вопрос о том, какой анастомоз следует накладывать раньше (дисталь-ный коронарный или проксимальный аортальный), а какой из анастомозов при множественном шунтировании надо выполнить в первую очередь, не считается принципиальным. Большинство хирургов начинают с самых сложных и наиболее отдаленных анастомозов, а это, как правило, дисталь-ный анастомоз на огибающей ветви левой коронарной артерии. И тем не менее, и та, и другая методика имеет свои преимущества и недостатки. Преимущество наложения вначале проксимального анастомоза заключается в том, что восстановление сердечной деятельности после наложения дистального анастомоза происходит при уже функционирующем шунте. Недостаток состоит в том, что трудно определить длину шунта после завершения дистального анастомоза, необходимо еще применение искусственного кровообращения до восстановления миокарда. Преимуществ наложения сначала дистального анастомоза, а затем проксимального заключается в том, что фаза восстановления сердечной деятельности совпадает по времени с выполнением проксимального анастомоза. Недостаток — оживление сердца после ишемии при резком стенозе коронарной артерии (особенно, основного ствола) может быть затруднительным, так как шунт к этому моменту еще не функционирует. Надо сказать, что эти преимущества и недостатки особенно заметны при множественном шунтировании. Все варианты отклонения от прямого шунтирования аорты и коронарной артерии (У-образный, подковообразный и змеевидный шунт) (рис. 62) имеют один общий недостаток — дефект одного анастомоза может отразиться на функции других. Эти методы так же эффективны, как и непосредственный аорто-коронарный шунт, но очень трудно правильно определить длину, а также угол входа и выхода анастомоза. Эти методы оправданы при короткой и измененной восходящей аорте. Мы применяли в таких случаях бифуркационный шунт, изготовленный из двух венозных трансплантатов (рис. 63). Маммарно-коронарный анастомоз (разработан и внедрен в практику В. И. Колесовым, 1964) нашел мало сторонников (6% американских кардиохирургов применяют маммарно-коронарный анастомоз (Miller и др., 1977), несмотря на то что проходимость
Рис. 62. Варианты множественного аорто-коронарного шунтирования: а — У-образный шунт, 6 — подковообразный, о—змеевидный
Рис. 63. Бифуркационный шунт, изготовленный из двух венозных трансплантатов
его в отдаленный период выше (до 96%), чем венозных шунтов (80—90%). Это объясняется не столько тем, что техника выполнения анастомоза мам-марной артерии с коронарным сосудом сложнее, чем венозный шунт, сколько тем, что кровоток по внутренней грудной артерии недостаточный для снятия явлений ишемии миокарда. Малый кровоток по внутренней грудной артерии Hamby с соавторами (1977) объясняет малым диаметром и большой длиной артерии, то есть большим сопротивлением, чем в вене; кроме того, давление во время диастолы выше в соустье, отходящем от восходящей аорты (венозном шунте), чем в нисходящей аорте (внутренней грудной артерии). Green (1978) сообщил о большом клиническом опыте применения свободного отрезка внутренней грудной артерии в качестве шунта между восходящей аортой и передней межжелудочковой артерией. Если применяется множественное шунтирование, то используется большая подкожная вена бедра или голени. Автор считает это особенно показанным у больных с высокой гиперлипидеми-ей, поскольку в этой ситуации шунт из вены быстро повреждается, в то время как внутренняя грудная артерия остается свободной от атерома-тозных изменений. Возможно, что такой способ мам-марно-коронарного шунтирования окажется перспективным. Мы не имеем опыта применения маммарно-коро-нарного анастомоза и опишем применяемую нами методику аутовенозно-го аорто-коронарного шунтирования. Вначале через множественные разрезы на бедре и голени выделяем большую подкожную вену бедра. При этом важно не повредить стенку вены, не перевязывать ветки у самой стенки. После выделения вены промываем ее раствором Рингера с гепарином и папаверином и храним в этом растворе. Затем производим срединную стер-нотомию, вскрываем перикард, осматриваем и пальпируем коронарные артерии. После того как принято решение о шунтировании, намечаем места анастомоза с коронарной артерией и определяем длину шунта. Больному вводим расчетную дозу гепарина (4 мг на 1 кг массы тела), отжимаем восходящую аорту и делаем в ней овальное отверстие диаметром 5 мм при помощи конхото-ма. Выделенную вену косо срезаем (рис. 64), переворачиваем и дистальным концом анастомозируем с отверстием в аорте круговым швом нитью 3—-0. Если предстоит шунтирование правой коронарной артерии, то вену вшиваем таким образом, чтобы конец среза вены был обращен косо влево, а если же анастомозируем переднюю межжелудочковую артерию или же ветви огибающей артерии, то конец среза вены поворачиваем косо вправо. Это делается для того, чтобы не было загиба шунта. Вначале выполняем все анастомозы с аортой, а затем канюли -руем нижнюю полую вену, восходящую аорту и верхнюю полую вену. Включаем АИК, проводя умеренную гипотермию (30° С). После запустевания сердца закрываем аорту и проводим наружное охлаждение сердца раствором Ринге-ра (5—10° С). Дренаж левого отдела сердца необходим, если сердце имеет тенденцию к расширению кровью во время закрытия аорты. Через 3—5 мин от начала охлаждения сердца возникает фибрилляция желудочков. Если операция длится дольше, то каждые 20 мин аорту открываем на несколько минут. Для анастомоза с правой коронарной артерией вытягиваем острый край правого желудочка, который удерживается ассистентом. Артерию вскрываем маленьким скальпелем и расширяем изогнутыми ножницами Поттса. Конец вены слегка скашиваем и выполняем дистальный анастомоз нитью 6—О, начиная с дистального конца артериального разреза. При наложении анастомоза с передней межжелудочковой артерией под сердце подкладываем марлевые салфетки, приподнимая участок анастомоза. Артерию, так же как и правую, вскрываем маленьким скальпелем (узко заточенным глазным скальпелем) и расширяем в длину до 1 см изогнутыми ножницами. Зондом проверяем проходимость дистального отдела артерии. Если операционное поле не сухое, то проксимально проводим под артерию турникет капроновой нитью 3—0. Выполняем анастомоз, используя стереоскопические очки, с верхнего угла разреза артерии. Накладываем круговой шов нитью 6—0. Во время этой операции сердце орошаем холодным раствором Рингера.
Рис. 64.Проксимальный конец вены, подготовленный к трансплантации Для экспозиции огибающей артерии второй ассистент становится справа от больного и влажной салфеткой вытягивает сердце вправо. Ветку тупого края огибающей артерии рассекаем продольно и накладываем анастомоз нитью 6—0 с верхнего угла разреза артерии. После завершения анастомозов аорту открываем; восстанавливается кровоток по шунтам. Если сердце не восстанавливает спонтанно свою деятельность, то фибрилляция снимается разрядом дефибриллятора. После стабилизации сердечной деятельности отключаем АИК- Операцию заканчиваем измерением кровотока по шунту и дренированием полости перикарда и переднего средостения. Проводим коррекцию водно-электролитного баланса, восстанавливаем исходный уровень гематокрита, и больного переводим в палату интенсивного наблюдения. Искусственную вентиляцию легких применяем до окончательной нормализации гемодинамики и восстановления активного дыхания. Для этого обычно требуется 4—6 ч. В течение первых 3 дней назначаем реополиглюкин 400—800 мл в сутки, а затем в течение 3 дней назначаем гепарин 5000 ЕД каждые 4 ч с дальнейшим переходом на антикоагулянты непрямого действия, поддерживая про-тромбиновый индекс на уровне 50— 60%. На 2-й день после операции больные сидят в постели, а на 3-й день разрешаем им ходить. С 1973 г. в Киевском научно-исследовательском институте клинической и экспериментальной хирургии выполнено аорто-коронарное шунтирование у 49 больных, причем у 33 из этих больных (за последние полтора года) с применением вышеописанной методики. У 26 больных наложен один шунт с передней межжелудочковой артерией, у 6 больных произведено двойное шунтирование (у 4— с правой коронарной и передней межжелудочковой артериями и у 2— с передней межжелудочковой и огибающей артериями) и 1 больному шунтированы все три артерии. У всех больных восстановлен кровоток по коронарной артерии от 32 до 107 мл/мин (в среднем 71 мл/мин). После операции умерли 6 человек. У 2 из 3 больных, умерших от острой сердечной недостаточности, были поражены три коронарные артерии с низкой фракцией изгнания левого желудочка. Один из них перенес инфаркт миокарда 4 раза, другой — два раза и третий — один раз. Все они страдали стенокардией покоя и принимали в сутки до 60 таблеток нитроглицерина. Двое из них умерли во время операции и третий — через день после операции. Причинами смерти после аорто-коронарного шунтирования были: острая сердечная недостаточность — у 3 больных, инфаркт миокарда — у 1, нарушение мозгового кровообращения—у 1, кровотечение—у 1 больного. У больного, умершего от инфаркта миокарда, на вскрытии был обнаружен тромбоз шунта. Причиной смерти пятого больного была неадекватная перфузия во время операции в связи с недиагностированным атеросклеротическим поражением брюшной аорты и подвздошных артерий (была канюлирована бедренная артерия). Один больной умер от кровотечения вследствие нарушения свертывающей системы крови. Все перенесшие операцию больные избавились от стенокардии, и у них значительно возросла толерантность к физической нагрузке. Большинство больных в настоящее время вернулись к работе. В отдаленный период наблюдения ни у одного больного не отмечено инфаркта миокарда, а также летальных исходов. Следует отметить, что с каждым годом результаты операции улучшаются; так, за последний год из 26 больных, которым был наложен одиночный шунт между аортой и передней межжелудочковой артерией, умер лишь 1 (3,8%). Широкое освоение аорто-коро-нарного шунтирования привело к тому, что некоторые хирурги начали применять его как экстренную операцию при острых окклюзиях коронарных артерий, предупреждая тем самым развитие некроза миокарда и его осложнений. Бесспорно, это дальнейший прогресс в хирургическом лечении ише-мической болезни сердца. ХИРУРГИЯ БРЮШНОЙ АОРТЫ И ЕЕ ВЕТВЕЙ. Дата добавления: 2014-06-28 | Просмотры: 1581 | Нарушение авторских прав |