|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
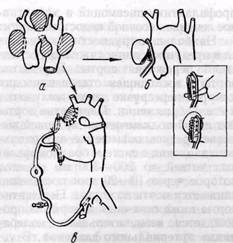
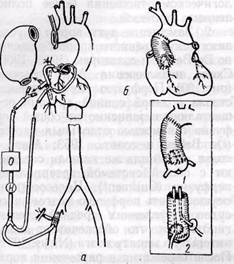
ЛЕЧЕНИЕ. Лечение аневризм аорты только хирургическое, необходимость которого диктуется тяжелым прогнозом, а также задачей устранения компрессионного синдрома иЛечение аневризм аорты только хирургическое, необходимость которого диктуется тяжелым прогнозом, а также задачей устранения компрессионного синдрома и осложнений. Риск операции крайне высокий. Показания к хирургическому лечению определяются предполагаемым риском операции, который зависит в первую очередь от наличия и тяжести сопутствующих заболеваний (хроническая коронарная недостаточность, гипертония, цереброваскулярные нарушения, заболевания легких и почек), формы и локализации аневризмы. Основными показаниями к операции являются аневризмы с относительно меньшим операционным риском (мешотчатые аневризмы любой локализации, аневризмы нисходящей аорты), аневризмы больших размеров (больше 7—8 см в диаметре), вызывающие выраженный медиастиналь-ный компрессионный синдром. При аневризме дуги аорты с выраженной клиникой больных целесообразно оперировать, так как только около 20% живут больше 5 лет. При асимптом-ном течении больше 50% больных живут свыше 5 лет, поэтому операция не показана, так как успешные результаты хирургического лечения значительно не превышают это число (Carpentier и соавт., 1971). Ведущее значение в настоящее время приобрели радикальные хирургические методы лечения аневризм грудной аорты. Паллиативные операции, направленные на укрепление стенки аневризмы синтетической или органической тканью с целью предотвращения ее разрыва, а также введение в просвет аневризмы металлических тел с целью вызвать ее тромбирование оставлены как бесполезные и опасные. Первая попытка радикального лечения — перевязка мешотчатой аневризмы — сделана Tuffier в 1902 г. Впервые успешно выполнили резекцию аневризмы в сочетании с устранением коарктации грудной аорты Ochsner (1944) и Schumacker (1948), резекцию мешотчатой аневризмы — Monod (1949) и Bahnson (1953). В нашей стране первые радикальные операции по поводу аневризмы грудной аорты выполнили А. Н. Бакулев и Б. В. Петровский. Однако систематическим изучением этой патологии и развитием хирургии грудной аорты клиническая хирургия обязана в первую очередь De Bakey и его сотрудникам, которые разработали ряд оригинальных способов оперативного лечения. В нашей стране ни один автор не располагает большим опытом оперативного лечения данной патологии. Основной принцип радикальных операций заключается в иссечении аневризмы и восстановлении непрерывности кровотока с помощью сосудистого шва или пластики аорты. Трудности при операциях на грудной аорте заключаются не в самой технике операции, а в необходимости решения следующих основных проблем, связанных с пережатием аорты: предупреждение ишемических поражений головного и спинного мозга, почек, миокарда; предупреждение острой перегрузки сердца в связи с острой артериальной гипертензией выше места пережатия аорты. Важным для успеха операции является выбор адекватного доступа, а также метода пластики и трансплантата для замещения дефекта аорты. Решение этих вопросов стало возможным в связи с разработкой методов временного шунтирования, искусственного кровообращения и созданием синтетических сосудистых протезов. Хирургический доступ должен быть достаточно широким, чтобы свободно манипулировать на аневризме, обеспечить контроль сосудов проксимально и дистально от аневризмы, а при необходимости — возможность шунтирования и экстракорпоральное кровообращение. Выбор оптимального доступа определяется локализацией и протяженностью аневризмы. Оптимальный хирургический доступ к восходящей аорте — продольная срединная стернотомия (доступ Милтона). При необходимости выполнения манипуляций на брахиоце-фальных ветвях разрез может быть продлен на область шеи (см. рис. 41). Доступ удобен также для применения искусственного кровообращения. Для доступа к дуге аорты и бра-хиоцефальным артериям в зависимости от локализации поражения и характера оперативного вмешательства могут быть использованы срединная стернотомия, горизонтальная (двусторонняя) стерноторакотомия и средин- ная стернотомия, дополненная тора-котомией слева. При двусторонней стерноторакотомии разрез выполняют по II межреберью справа и по III— IV — слева с пересечением грудины. Больной при этом находится в положении лежа на правом боку с отведением и фиксацией левой руки. Разрез обеспечивает достаточно хороший доступ ко всем отделам дуги аорты и возможность применения искусственного кровообращения, но связан с большой операционной травмой. Срединная стернотомия с левосторонней боковой торакотомией по IV или V межреберью обеспечивает доступ ко всем отделам грудной аорты. Для доступа к нисходящей части аорты чаще используют боковую то-ракотомию слева по IV или V межреберью или же с поднадкостничной резекцией ребра. Этот разрез обеспечивает выделение перешейка аорты, дис-тальной части дуги, левой подключичной артерии, а также большей части нисходящего отдела аорты. При этом доступе возможно применение лево-предсердно-бедренного экстракорпорального шунтирования. При поражении дистального отдела нисходящей грудной аорты торакотомия может быть выполнена по VI или VII межреберью. Для доступа к торакоабдоми-нальному отделу аорты используют торакофренолапаротомию или торако-френолюмботомию. В большинстве случаев доступы к грудной аорте связаны с большой операционной травмой и возможностью развития тяжелых осложнений. Особенно травматичны двусторонняя то-ракостернотомия и комбинированные доступы (стернотомия, дополненная торакотомией). Большое значение при этих доступах имеют тщательный гемостаз и хорошее дренирование полостей (загрудинный и внутриплевральный дренажи). В послеоперационный пе-. риод необходимо тщательно налаживать активное функционирование дренажей, проводить клинический рентгенологический контроль за плевральными полостями и средостением, профилактику пневмоний и эффективное лечение легочной недостаточности. Наибольшие трудности заключаются в предупреждении тяжелых последствий пережатия аорты. Пережатие аорты в восходящем отделе приводит к острой перегрузке левого желудочка и его фибрилляции. Пережатие аорты под левой подключичной артерией вызывает резкое повышение артериального давления в системе брахиоцефаль-ных ветвей до 200—300 мм рт. ст., которое через 10—20 мин постепенно снижается почти до нормы. Пережатие аорты ниже почечных артерий сопровождается незначительными колебаниями артериального давления. В условиях нормотермии пережатие восходящей аорты приводит через несколько минут к необратимым изменениям в головном мозге, через 20—30 мин — в спинном мозге с последующей параплегией. Почки могут переносить ишемию при пережатии грудной аорты в течение 30—40 мин, печень, селезенка, кишечник — 40—50 мин. Опасность ишемического поражения органов значительно уменьшается при умеренной гипотермии. Использование временного шунтирования сосудистым синтетическим трансплантатом, который вшивают проксималь-нее и дистальнее аневризмы, или внут-рисосудистого шунтирования при помощи пластмассовых трубок, применение экстракорпорального кровообращения позволили решить проблему кровоснабжения жизненно важных органов во время иссечения аневризмы и пластики аорты. Для пластики аорты применяют синтетические сосудистые протезы из дакрона, тефлона, фтор-лон-лавсана. При радикальном лечении аневризм грудной аорты применяют два основных метода: боковую (тангенциальную) резекцию аневризмы с ушиванием раны аорты и резекцию ее с замещением стенки аорты сосудистым трансплантатом. Первый метод наиболее простой, так как кровоток в аорте полностью не прерывается. С момента первой Рис. 27. Методы реконструктивных операций при мешотчатых аневризмах грудной аорты: а '— наиболее частая локализация мешотчатых аневризм; б — тангенциальная резекция аневризмы без перерыва кровотока в аорте; в — резекция мешотчатой аневризмы восходящей аорты с широкой шейкой, занимающей 1/3 — 1/2 окружности аорты в условиях экстракорпорального кровообращения операции перевязки мешотчатой аневризмы эта техника операции достигла высокого развития (De Bakey и соавт., 1958; Dubost и соавт., 1962; НеЬегег, 1966). Операцию производят в случае мешотчатых аневризм при условии, если шейка аневризмы располагается в положении, допускающем тангенциальное пережатие аорты. Большой изогнутый зажим или зажим Сатин-ского накладывают параллельно стенке аорты обычно без перерыва кровотока в ней. Аневризму иссекают над зажимом (рис. 27). Дефект в аорте ушивают двухэтажным швом: П-об-разным прерывистым и непрерывным обвивным или восьмиобразным (De Bakey). Важным условием является наложение швов в пределах здоровой стенки аорты. Для укрепления ее стенки может быть подшита сверху заплата из синтетической ткани. Второй способ — резекция аневризмы с замещением дефекта трансплантатом — применяют при веретенообразных аневризмах, а также мешотчатых с широкой шейкой, занимающей 1/3 — V2 окружности аорты. При этом методе необходимо времен- ное пережатие аорты, что сопряжено с большими техническими трудностями и большим операционным риском. Выбор метода операции и способа защиты жизненно важных органов от ишемии во время пережатия аорты зависит от локализации и формы аневризмы. Лечение аневризм восходящей аорты. Первые успешные операции по поводу аневризмы восходящей аорты выполнили Cooley и соавторы (1955). При аневризмах этой локализации лучшим доступом считается срединная продольная стернотомия. Этот разрез удобен также для подключения экстракорпорального кровообращения. При наличии больших аневризм, тесно прилегающих к передней грудной стенке, узурирующих грудину, ребра, выполнение срединной стерно-томии рискованно. Целесообразно применить правостороннюю переднюю торакотомию или двустороннюю тора-котомию с поперечной стернотомией. Мешотчатые аневризмы с хорошо оформленной шейкой, доступные для тангенциального пережатия, резецируют над зажимом, как описано выше. Если шейка широкая, охватывает более V3 окружности аорты или аневризма кзади расположена, а также при веретенообразных аневризмах необходима резекция пораженного участка аорты с замещением его трансплантатом. Для поддержания кровотока дистальнее места пережатия аорты применяют полное экстракорпоральное кровообращение. При резекции аневризм, расположенных близко к аортальным клапанам, необходима перфузия всех органов, включая миокард. Кровоток в органах брюшной полости, спинном и головном мозге обеспечивается искусственным кровообращением с помощью АИК через бедренную артерию, в миокарде — селективной перфузией коронарных артерий (рис. 28, а). При распространении поражения на ветви дуги аорты используют также дополнительную перфузию сонных артерий. Рис. 28. Метод операции при аневризме восходящей аорты, осложненной выраженной недостаточностью аортального клапана: а — резекция аневризмы в условиях искусственного кровообращения с коронарной перфузией; б — имплантация искусственного клапана и пластика восходящей аорты синтетическим сосудистым протезом: / — супракоронарная резекция; 2 — инфракоронарная резекция с имплантацией устьев коронарных артерий в сосудистый протез (по Benntall с соавт., 1968) В случае выраженной недостаточности аортального клапана выполняют резекцию аорты с бикуспидализацией (впервые выполнена Ellis и соавт., 1961; Groves и соавт., 1964) или протезированием (Groves и соавт., 1964; Cooley и соавт., 1967; Schulte, Bircks, 1971) аортальных клапанов (рис. 28, б). Применение искусственного кровообращения при удалении аневризм восходящей аорты в настоящее время считается методом выбора. Способ временного шунтирования, предложенный Cooley и соавторами (1955), используется редко при условии, если имеется относительно здоровый участок аорты над клапанами для наложения бокового анастомоза с шунтом. Лечение аневризм дуги аорты.Аневризмы этого сегмента аорты считаются наиболее трудными для хирургического лечения. Это обусловлено сложностью анатомического строения этого отдела аорты, расположенного в переднем и заднем средостении, не-
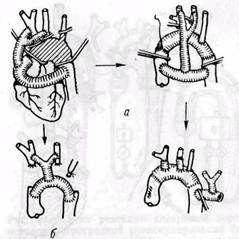
Рис. 29. Резекция аневризмы дуги аорты с замещением дуги синтетическим сосудистым протезом без применения искусственного кровообращения: а — способ временного наружного шунтирования сосудистым протезом с последующим удалением шунта (по Cooley с соавт, 1955); б — способ временного шунтирования с последующим превращением временного шунта в постоянный трансплантат (no Cwathmey с соавт., 1958) редким поражением брахиоцефальных сосудов и опасностью ишемического поражения головного мозга во время операции. Известны три основных способа оперативного лечения аневризм дуги аорты. 1. Способ временного шунтирования без искусственного кровообращения (Cooley и соавт., 1955). Временный шунт из синтетического сосудистого протеза анастомозируют с восходящей и нисходящей аортой по типу конец в бок при тангенциальном отжатии аорты. Боковые ветви шунта анастомозируют конец в бок с плече-головным стволом и левой сонной артерией. Затем аорту пережимают, переключая кровоток на временный шунт, аневризму иссекают, вшивают постоянный сосудистый протез конец в конец с восходящей и нисходящей аортой, плече-головным стволом, левой сонной и левой подключичной артериями (рис. 29, а). Временный шунт удаляют и ушивают разрезы на сосудах. Основные недостатки способа: технические трудности при резекции Рис. 30. Полное замещение дуги аорты по поводу ее аневризмы синтетическим сосудистым трансплантатом в условиях искусственного кровообращения (метод De Bakey). Селективная перфузия безымянной, левой общей сонной и венечных артерий аневризмы и замещении дуги аорты, расположенной кзади от временного шунта, большая продолжительность операции (13 анастомозов и 4 боковых сосудистых шва). Этот способ в настоящее время применяют очень редко. Gwathmey и соавторы (1958) предложили временный шунт превращать в постоянный, ушивая наглухо поперечные сечения аорты и брахиоцефаль-ных ветвей после резекции аневризмы (рис. 29, б), что позволяет сократить продолжительность операции. Heberer и соавторы (1969) на основании собственного опыта и анализа данных литературы считают, что способ операции («постоянный шунт-трансплантат») в условиях средней гипотермии обеспечивает лучшие результаты, чем другие методы. Преимущество способов «шунт-резекции» состоит в возможности избежать применения искусственного кровообращения, что особенно важно у пожилых больных. Отпадает необходимость в применении гепарина, в связи с чем уменьшается кровопоте-ря через поры протеза и возможно использование крупнопористых, в био- логическом отношении более полноценных протезов. 2. Замещение дуги аорты в уело виях искусственного кровообращени? по De-Bakey и соавторам (1960, 1966) Схема подключения АИК обычна5 (рис. 30). Перфузию плече-головногс ствола и левой сонной артерии осу ществляют независимо от общей пер фузии с помощью отдельных насосо! (De Bakey и соавт., 1953; Asano i соавт., 1969) или же канюли соединяют с общей системой артериальной перфузии (Guilment). Целесообразнс осуществлять перфузию мозговых сосудов в условиях средней степенр гипотермии, что обеспечивает дополнительную защиту мозга (Nicks, 1972), После пережатия и рассечения аорть начинают перфузию коронарных сосудов. Аневризму иссекают полностьк или частично. Дефект аорты замещаю! сосудистым трансплантатом. Боковые ветви трансплантата анастомозирукл последовательно конец в конец с левой подключичной, левой сонной артериями и плече-головным стволом. Предложено канюлировать сосуды вне операционного поля на грудной клетке — через правую и левую плечевые и левую сонную артерии, чтс облегчает манипулирование на аневризме (Реагсе и соавт., 1969; Nicks и соавт., 1972). Все различные типы аневризм дуги аорты и ее восходящей части могут быть оперированы в условиях искусственного кровообращения. Недостатки способа — продолжительное время экстракорпорального кровообращения, гепаринизация, в связи с чем возможна значительная кровопотеря через поры протеза, необходимость использования мелкопористых протезов. 3. Метод ретроградной реваскуля-ризации, предложенный Hu-You-Lin и соавторами (1964), позволяет значительно уменьшить продолжительность искусственного кровообращения. Протез вначале анастомозируют с нисходящей аортой (конец протеза в бок аорты), затем последовательно с левой подключичной, левой сонной артериями и плече-головным стволом (конец артерий в бок протеза). Зажим последовательно перекладывают прокси-мальнее каждого анастомоза, чтобы обеспечить ретроградную реваскуля-ризацию брахиоцефальных ветвей (рис. 31). Экстракорпоральное кровообращение и гепаринизация требуются только на последнем этапе операции — при анастомозировании протеза с восходящей аортой. Операцию осуществляют через срединную стернотомию с левосторонней торакотомией по V межребер ью в положении больного на правом боку. Carpentier и соавторы (1971) считают целесообразным применять методы ретроградной реваскуляризации при поражении всей дуги аорты, а способ De Bakey — в условиях искусственного кровообращения при поражении проксимальной части дуги аорты. Лечение аневризм нисходящей аорты. Этот сегмент аорты относительно легко доступен для хирургического вмешательства. Операцию выполняют через левостороннюю задне-боковую торакотомию по V, а при низких аневризмах — по VI или V межреберьям. Этот разрез обеспечивает доступ к грудной аорте от левой подключичной артерии до диафрагмы, а также возможность использования шунтирования, в том числе экстракорпорального кровообращения, между левым предсердием и левой бедренной артерией. Удаление аневризм нисходящей аорты представляет собой менее сложную проблему, чем проксимальных ее отделов. Основной задачей является защита спинного мозга от ишемии во время резекции аневризмы и пластики аорты. Для защиты спинного мозга эт ишемического повреждения предложены разные методы. К ним относятся: способ временного наружного нунтирования в обход резецируемого сегмента аорты с использованием сосудистого протеза или пластмассовой грубки (Kahn, 1970). Недостаток ме-
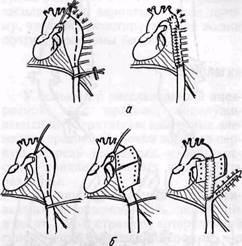
Рис. 31.Схема резекции аневризмы аорты методом ретроградной реваскуляризации (по Hu-You-Lin с соавт., 1964); протез анасто-мозируют с нисходящей аортой конец в бок, затем последовательно с левой подключичной, левой общей сонной (а) и безымянной артериями (б), перекладывая проксимальнее каждого анастомоза зажим, чтобы обеспечить ретроградную реваскуляризацию брахиоцефальных ветвей. Использование экстракорпорального кровообращения требуется только при анастомозировании протеза с восходящей аортой. Дугу аорты замещают синтетическим сосудистым протезом (в) тода — значительная продолжительность операции. Метод временного внутреннего шунтирования. На шунт (пластмассовую трубку) одевают протез, резецируют аневризму, и анастомозы конец в конец ушивают на внутреннем шунте (рис. 32). Шунт удаляют через поперечный разрез протеза. Кеап и Frimble (1968) применили простой метод резекции с использованием внутреннего шунта. Они не иссекают аневризму, а рассекают ее продольно, удаляют тромбы, атерома-тозные массы, иссекают избыток ткани и снова ушивают выключенный сегмент аорты. Оставление части стенки аневризмы, по их мнению, позволяет сохранить кровоснабжение спинного мозга через межреберные сосуды и избежать неврологических осложнений, связанных с резекцией большого сегмента аорты. Антикоагулянты и экстракорпоральное кровообращение авторы не применяют, аорту пережимают во время операции на 2—3 мин. Рис. 32.Методы резекции веретенообразной аневризмы нисходящей аорты: а, д — резекция аневризмы и замещение ее сосудистым протезом; 6 — использование экстракорпорального шунта между левым предсердием и левой бедренной артерией; в — способ временного наружного шунтирования с применением пластмассовой трубки; г — способ временного внутреннего шунтирования; шунт удаляют через поперечный разрез протеза Способ экстракорпорального шунтирования между левым предсердием и бедренной артерией с использованием насоса без оксигенератора в настоящее время применяют большинство авторов (Leads, Culiner, 1952; De Bakey и соавт., 1960; Taber, 1970, и др.). Объем перфузии 80— 100 мл/мин/кг (Taber, 1970). Преимущество способа: уменьшается продолжительность вмешательства на аорте, надежный контроль кровообращения, незначительная операционная крово-потеря. Недостатки: необходимость применения гепарина и в сбязи с этим использование биологически менее полноценных мелкопористых протезов. Метод периферического экстракорпорального кровообращения заклю- чается в следующем. Катетер ввод в нижнюю полую вену через бедре ную вену; перфузию нижней полови] тела осуществляют через бедренн; артерию. По мнению Schildberg Heberer (1971), такой способ искус< венного кровообращения может бы применен при угрожаемом состояв пациента еще до выполнения торак томии. Предложено использовать гипоте мию средней степени, что позволя пережимать аорту до 60 мин. Резекция аневризмы без примен ния специальных методов защю спинного мозга при кратковременнс пережатии аорты (Crawford и соавп 1970): аневризматический мешок пос. его продольного рассечения и ушив ния боковых сосудов изнутри оста ляют in situ, дефект аорты замещай протезом (анастомоз конец в конец после чего его окутывают аневризм; тической оболочкой. Время переж; тия аорты не должно превышать 30-45 мин (Harrison, 1970). Crawford соавторы (1970) сравнили результат лечения двух групп больных с ане! ризмой нисходящей части аорты, л< ченных этим способом и с применение шунтирования, и не выявили сущее' венной разницы. Harrison (1970) C4i тает, что упрощение методики оперг ции без применения шунтировани имеет преимущество перед другим методами. Наиболее важными факторами, вы зывающими ишемическое поврежде ние спинного мозга при резекции анен ризм нисходящей аорты, считаютс объем резекции, число лигируемы: сегментарных ветвей, характер и про тяженность поражения, варианты кро воснабжения спинного мозга. Опас ность возникновения параплегии боль ше при обширной резекции по повод] расслаивающей аневризмы аорты, Tai как сам по себе патологически! процесс вызывает облитерацию межре берных и поясничных артерий. Факти чески 4/э параплегии связаны с резек циями большого сегмента аорть (Schildberg, Heberer, 1971). В этой связи целесообразно выполнять экономную резекцию аневризмы, сохраняя, насколько возможно, межреберные артерии. При обширной резекции аорты необходимо вшить в протез крупные межреберные артерии, а тромбированные сосуды перевязать. Cranford и соавторы (1968) предложили имплантировать в протез заднюю стенку аорты с 8—12 межреберными артериями или резецировать аневризму лишь частично, ушивать аневризматический мешок, анастомо-зируя протез конец в конец — проксимально, конец в бок аорты -— дистально (рис. 33). Может быть использована также методика Кеоп и Frimble (1968), описанная выше. Лечение торако-абдоминальных аневризм. Аневризмы этой локализации вовлекают в процесс сосуды, снабжающие кровью органы брюшной полости и забрюшинного пространства (чревной ствол, верхняя брыжеечная, почечные артерии), сдавливают пищевод и кардиальный отдел желудка. У большинства больных отмечаются боль в подложечной области, отрыжка, рвота, дисфагия, приступообразная боль в животе (брюшная жаба), нередко артериальная гипертензия. Нередко больным ошибочно ставят диагноз рака желудка. Грудо-брюшные аневризмы обычно не определяются при пальпации. Для диагностики и уточнения локализации необходима аортография. Кли-нико-рентгенологические исследования грудной клетки, пищевода и желудка дают возможность заподозрить это заболевание. Перед операцией исследуют функцию почек. В качестве трансплантата после резекции аневризмы применяют сложные сосудистые протезы с боковыми ветвями для замещения артерий под-диафрагмального сегмента аорты. Хирургическое лечение торако-абдоминальных аневризм представляет более сложную проблему по сравнению с лечением аневризм нисходящей аорты. Для предупреждения ишемического повреждения спинного мозга и органов
Рис. 33. Методы предупреждения ишемичес-ского повреждения спинного мозга при резекции аневризмы нисходящей аорты: а — имплантация задней стенки аорты с межреберными артериями (8 — 12 артерий) в сосудистый протез; б — частичная резекция аневризмы с сохранением межреберных артерий (8—-12) и анастомозом конец в бок между протезом и аортой брюшной полости во время резекции аневризмы используют метод временного шунтирования синтетическим сосудистым протезом с последующим превращением его в постоянный шунт (методОе Bakey с соавт., 1960, рис. 34). При поражении только устья чревной артерии может быть применен описанный выше способ Кеоп и Frimble (1962) с использованием временного внутреннего шунта. Чревную артерию вшивают в протез до удаления шунта. При аневризмах этой локализации применяют левосторонний торако-аб-доминальный доступ (торакофренола-паротомия). Разрез кожи — по VII или VIII межреберью от средней подмышечной линии в косом направлении, а затем по средней линии живота. Пересекают хрящи реберной дуги, плевру, брюшину, а также диафрагму до аортального отверстия. Вскрывают забрюшинное пространство слева. От-препаровывают аорту проксимально и дистально от аневризмы, чревную, почечные и верхнюю брыжеечную артерии и под них подводят турникеты. Производят боковое пережатие Рис. 34. Схема резекции аневризмы грудобрюшного сегмента аорты методом временного наружного шунтирования синтетическим сосудистым протезом с последующим превращением временного шунта в постоянный (по De В a key с соавт., 1960) зажимом Сатинского аорты выше аневризмы с тем, чтобы не нарушать кровоток в аорте, и вшивают конец сосудистого протеза в бок аорты. Трансплантат готовят до операции с ветвями для почечных, чревной и верхней брыжеечной артерий, которые должны быть несколько большего диаметра, чем артерии. Дистальный конец протеза анастомозируют с аортой ниже аневризмы конец в бок или конец в конец. Пересекают левую почечную артерию и ее дистальный конец анастомозируют с соответствующей ветвью протеза, после чего открывают параллельный кровоток по протезу. Затем аневризму иссекают, сшивают правую почечную артерию конец в конец с соответствующей ветвью протеза и открывают кровоток в правую почку. Подобным образом восстанавливают кровоток в чревной и верхней брыжеечной артериях. Проксимальное и дисталь-ное поперечное сечение аорты заши- вают. Особое внимание необход: обращать на то, чтобы не было ш гиба отходящих от протеза вет (опасность тромбоза). При такой тодике операции прекращение крс тока в почках не должно превыш 20—30 мин, в кишечнике и в печенр 40—50 мин. Аневризмы синусов Вальсаль.Аневризма области корня аорты в л те расположения полулунных кла нов носит название аневризмы син Вальса львы. Эта патология встречг ся редко. В большинстве случаев блюдаются аневризмы правого сину Они имеют чаще сифилитическую п роду или развиваются вследст) врожденной неполноценности элас ческих структур аорты (синдр Марфана). Клиническая картина определя ся симптомами часто развивающш при этой патологии недостаточно! аортального клапана, сужения прос та коронарных артерий, сдавления. точной артерии и правого предсерд (синдром правожелудочковой недос точности), верхней полой вены. ahi ризмы малого размера не выявля себя до разрыва, который nponcxoi обычно в полость перикарда, прав отделы сердца с развитием синдро перенапряжения правого желудоч! Распознать аневризму синуса Baj сальвы до разрыва аневризмы край сложно. Аневризмы синусов Вальсаль: иногда выявляются на обычн рентгенограмме, произведенной в nf вой задней косой позиции. Aopi и ангиокардиография позволя! диагностировать эту патологию, ос бенно при прорыве аневризмы в пр вый желудочек. Прогноз при аневризме синус Вальсальвы неблагоприятный. Результаты лечения. Аневризи грудной аорты являются наиболее т желой патологией в ангиохирурги Риск операций по поводу аневри; грудной аорты очень высокий. Наиб лее высокая операционная летал ность, а также наибольшие технич ские трудности наблюдаются при удалении веретенообразных аневризм восходящего отдела и дуги аорты и составляют, по данным разных авторов, от 20 до 75% (Б. Д. Комаров, 1967; De Bakey и соавт., 1968; Heberer и соавт., 1969, и др.). Летальность при резекции аневризм нисходящей аорты значительно ниже — 12—38%. Неврологические осложнения (парапарез, параплегия) после резекции аневризмы нисходящей аорты наблюдаются у 5—10% больных (Heberer, Schild-berg, 1970). Результаты хирургического лечения травматических аневризм грудной аорты значительно лучше по сравнению с таковыми при аневризмах другой природы (сифилис, атеросклероз, медионекроз), что обусловливается лучшим общим состоянием больных, в большинстве молодого возраста, с травматическими аневризмами. Отмечено, что артериальная гипер-тензия, коронарная недостаточность, выраженный атеросклероз, недостаточность аортального клапана значительно увеличивают риск операции. Операционная летальность уменьшается в зависимости от накопления опыта лечения больных с этой патологией. Дата добавления: 2014-06-28 | Просмотры: 2097 | Нарушение авторских прав |