|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
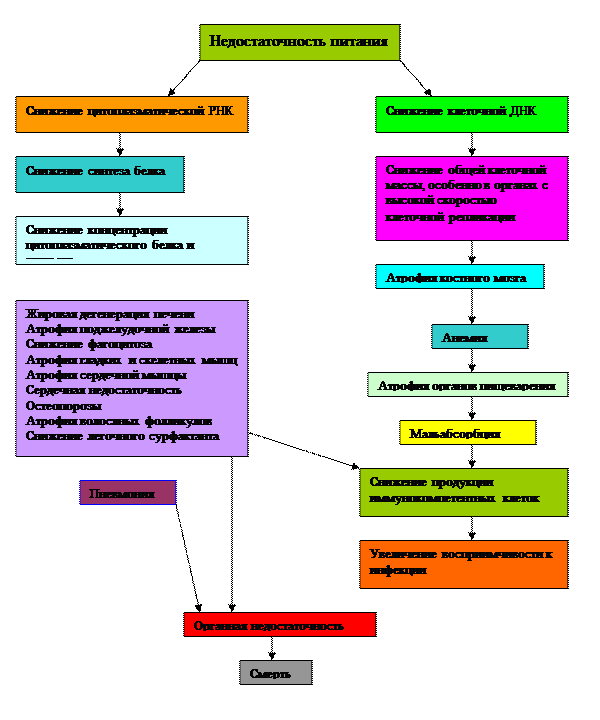
Белково-энергетическая недостаточность у онкологических больныхБелково-энергетическая недостаточность (БЭН) является фактором повышенного риска в период лечения онкологических больных. Она может привести к послеоперационным осложнениям и другим нежелательным результатам, среди которых следует выделить: • Развитие ранних ипоздних раневых осложнений (недостаточность швов анастомоза, эвентрация) • Развитие инфекционных нозокомиальных осложнений (пневмония, уроинфекция, синуситы и др.) • Увеличение длительности ИВЛ • Раннее формирование синдрома полиорганной недостаточности (ПОН) • Существенный рост медикаментозной нагрузки на пациента • Увеличение длительности пребывания больных в ОРИТ и стационаре • Увеличение затрат на лечение больного Схема танатогенеза при прогрессирующей БЭН представлена на рисунке 2. Недостаточность питания (malnutrition) приводит к снижению уровня нуклеиновых кислот. Уменьшение цитоплазматической рибонуклеиновой кислоты (РНК) ведет к снижению синтеза белка. В результате последовательных патологических процессов снижается концентрация цитоплазматического белка и энзимов. Нарушение синтеза и увеличение катаболизма соматических белков приводят к атрофии гладких и скелетных мышц, атрофии сердечной мышцы с развитием сердечной недостаточности. Появляются остеопорозы, атрофия волосяных фолликул. Нарушения обмена висцеральных белков проявляется в нарастании жировой инфильтрации печени, атрофии поджелудочной железы. Снижается синтез легочного сурфактанта, возникают условия для развития пневмонии. Этому способствует снижение активности фагоцитоза, атрофия костного мозга, снижение продукции иммунокомпетентных клеток. Развитие этих процессов связано со снижением общей клеточной массы, особенно в органах с высокой скоростью клеточной репликации, что определяется уменьшением клеточной дезоксирибонуклеиновой кислоты (ДНК). Параллельно нарастающие процессы клеточного катаболизма ведут к прогрессированию органной, полиорганной недостаточности (ПОН) и как следствие этого - к летальному исходу. Одной из первых публикаций о связи послеоперационной летальностью с нарушениями питания больных явилась статья Worren в 1932 г., где сообщалось, что из 500 аутопсий умерших от онкологических заболеваний больных, 22 % были связаны с истощением больных. Последующая и современная литература полностью подтверждает эти сведения, свидетельствуя о причинной связи «истощение → иммунодефицит → присоединение инфекции → летальный исход».
Рис. 2. Схема танатогенеза при прогрессирующей белково-энергетической недостаточности (Douglass H.O., 1997) По данным мета-анализа, проведенного американскими учеными в 80-х годах прошлого века, 50 % онкологических больных, направляемых на комплексное лечение, имеют дефицит веса разной степени, а у 15 % - до 10 % от уровня до начала заболевания. При раке легкого потеря веса также существенна (Chlebowsky e.a., 1996, Jebb e.a., 1997). Энтеральное питание в онкологии, как и в хирургии, применяется издавна, однако лишь в последние 15-20 лет сформировалась современная концепция, в соответствии с которой доказаны неоспоримые преимущества энтерального пути приема пищи по сравнению с парентеральным. Энтеральное питание подразумевает введение питательных смесей через зонды, как правило - назогастральный и назоеюнальный, или через стомы. Оно считается более физиологичным и полезным по сравнению с парентеральным питанием, так как способно не только обеспечивать полноценное питание организма, но и самой кишечной трубки, которая в условиях длительного парентерального питания подвергается ряду серьезных патологических изменений - от функциональных нарушений ферментативного аппарата и моторно-эвакуаторной активности до тяжелых дистрофических изменений слизистой оболочки. Рациональность энтерального питания определяется следующими эффектами (В.М. Луфт и А.Л. Костюченко, 2001): 1) питательные субстраты стимулируют рост и регенерацию клеточных элементов слизистой оболочки за счет непосредственного поступления в нее, активируют ферментативную активность пищеварительных соков, выработку интестинальных гормонов и увеличивают мезентериальный кровоток; 2) кишечный химус активизирует процесс пищеварения и является профилактическим фактором в возникновении острого гастродуоденального эрозивно-язвенного поражения; 3) энтеральное питание предупреждает контаминацию микрофлоры из дистальных отделов кишечника в проксимальные и транслокацию бактерий из кишечника в кровь. Учитывая интегративную роль желудочно-кишечного тракта (ЖКТ) в гомеостазе, становится ясной роль энтерального питания в профилактике полиорганной недостаточности. Кишечная недостаточность имеет большое значение в формировании ПОН. По данным А.Л. Костюченко с соавт. (1996), при кишечной недостаточности развивается истощение энтероцитов, меняется микрофлора и возникает ишемия стенки кишки, что приводит к чреспортальной абсорбции токсинов и микробов. В результате этого происходит повреждение гепатоцитов и активируются макрофаги. Одновременно происходит лимфатическая транслокация токсинов и микробов, что ведет к системным и органным нарушениям.
Дата добавления: 2015-01-18 | Просмотры: 1224 | Нарушение авторских прав |