|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГЛАВА 293. Т-ЛИМФОТРОПНЫЕ ВИРУСЫ ЧЕЛОВЕКА
Роберт К. Галло, Антоны С. Фаучи (Robert С. Gallo, Anthony S. Fauci)
Биология ретровирусов. Впервые ретровирусы были выделены от цыплят в начале этого века. Позднее, в 50-х годах, от мышей, больных лейкозом, был выделен ретровирус млекопитающего. В настоящее время уже хорошо известно, что эти вирусы связаны с возникновением у многих видов животных как злокачественных, так и незлокачественных заболеваний. Ретровирусы в зависимости от вызываемых ими форм заболеваний могут быть разделены на злокачественные, незлокачественные, одновременно злокачественные и незлокачественные и непатогенные. Непатогенные вирусы часто наследуются как нормальные генетические менделевские элементы. Этот путь их наследования уникален, эти вирусы получили название эндогенных. Примером вируса, обладающего одновременно как злокачественными, так и незлокачественными свойствами, служит вирус, который может вызвать лейкоз у кошек. Он вызывает Т-лейкоз, однако чаще бывает ответствен за нарушения, напоминающие синдром приобретенного иммунодефицита человека (см. гл. 257). Ретровирусы, вызывающие незлокачественные заболевания, например энцефалит и другие неврологические болезни, артриты, болезни легких, относятся к медленно действующим и обозначаются как лентивирусы. Их выделяют от копытных животных, человека (Т-лимфотропный вирус, человека III типа, или HTLV-III) и нечеловекообразных обезьян (обезьяний Т-лимфотропный вирус III типа, или STLV-III). Ретровирусы имеют внешнюю оболочку, отпочкованную от клеточной мембраны, и содержат электронно-плотную сердцевину, окружающую вирусный геном. Sine qua поп ретровируса представляет собой ДНК-полимеразу, которую называют обратной транскриптазой и которая вместе с РНК входит в состав сердцевины. Обратная транскриптаза катализирует перевод генетической информации из РНК-в ДНК-форму (провирус). Провирус затем обычно мигрирует из цитоплазмы к ядру и после перехода в кольцевую двуспиральную форму интегрируется с ДНК клетки-хозяина, в которой и остается на протяжении всей жизни клетки (рис. 293-1). Поскольку провирус в процессе S-фазы клеточного цикла удваивается вместе с собственно клеточной ДНК, то и дочерние клетки наследуют вирусный геном. Таким образом, организм инфицируется как бы в течение всей жизни. При экспрессии вируса его РНК и белки можно обнаружить в цитоплазме клетки, а также в связи с внутренней поверхностью клеточной мембраны, в которой отпочковывание и высвобождение вируса завершают его жизненный цикл. Иногда происходят делеции провируса, в результате чего формируемый вирус приобретает некоторые свойства, отличающие его от оригинального варианта. Молекулярные механизмы повреждения клетки вирусом обусловлены структурными особенностями его генома. Наиболее показательны в этом плане вирусы хронических лейкозов, содержащие всего три гена, ответственных за вирусную репликацию: gag, pol и env (рис. 293-2; см. гл. 59). Первый (gag) кодирует синтез внутренних структурных белков, pol — обратной транскриптазы, а env — гликопротеинов оболочки. Свойства оболочки вируса имеют решающее значение в выборе типов клеток, которые он может инфицировать, исходя из чего можно понять требования, предъявляемые к новым антивирусным вакцинам, которые должны способствовать выработке антител, действие которых направлено на оболочку вируса. Вирусная генная цепочка на обоих концах ограничена нуклеотидной последовательностью, которую называют длинным концевым повтором (ДКП) и которая содержит регуляторные элементы, влияющие на экспрессию вирусных генов, а иногда и на вблизи расположенные гены клетки-хозяина. Длинный концевой повтор содержит сигналы, определяющие интеграцию провируса в ДНК клетки-хозяина и образует участки окончания считывания интегрированной провирусной последовательности нуклеотидов. Примерами вирусов, вызывающих хронические лейкозы, могут служить FeLV, вирус лейкоза мышей, вирус лейкоза птиц. До индукции лейкоза эти вирусы интенсивно реплицируются в клетках хозяина. Доказано, что эти вирусы вызывают лейкоз путем интеграции в специфический участок хромосомы, таким образом, ассоциированные ДКП стимулируют постоянную экспрессию клеточных генов, участвующих в процессах роста клетки. Наиболее демонстративным примером этого механизма действия служит развитие у цыплят лейкоза, обусловленного вирусом лейкоза птиц. Его длинный концевой повтор стимулирует экспрессию клеточного онкогена, что, по-видимому, служит первой ступенью в индукции лейкоза. Интеграция вируса носит случайный характер, однако высокая скорость репликации благоприятствует интеграции вируса именно в те участки хромосомы, которые расположены достаточно близко к клеточному онкогену, и, таким образом, ДКП получает возможность его активации. Все это позволяет объяснить совершенно очевидную необходимость длительного размножения вируса до начала развития злокачественного процесса.
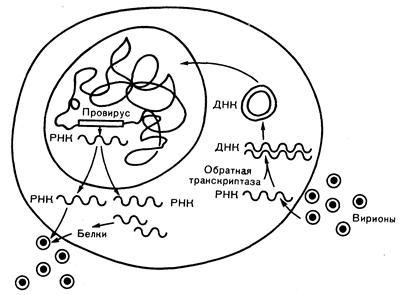
Рис. 293-1. Жизненный цикл ретровируса. Интактные вирионы проникают в клетку после адсорбции на специфических клеточных рецепторах. Одноцепочечная вирусная РНК лишается оболочки, а обратная транскриптаза синтезирует двуспиральную вирусную ДНК, проникающую в ядро и интегрирующуюся в геной клетки-хозяина. При определенных условиях ДНК провируса не экспрессируется. В других случаях она транскрибируется с образованием РНК, кодирующей вирусные белки, и геномной РНК. Затем происходит сборка вириона из вирусных белков и геномной РНК с последующим его отпочковыванием от клеточной мембраны.
Ретровирус, в результате генетических рекомбинаций приобретающий в своем геноме ген клетки-хозяина, который быстро трансформирует клетки и индуцирует острые злокачественные процессы, часто называют вирусом острого лейкоза или саркомы, а ген обозначают как вирусный onc-ген (см. рис. 293-2; см. гл. 58 и 59).
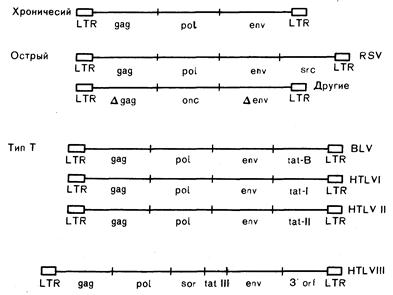
Рис. 293-2. Генная структура и предлагаемая классификация ретровирусов. Синтез внутренних структурных белков кодирует gag, синтез обратной транскриптазы — ро1, гликопротеинов оболочки — env; LTR — длинный концевой повтор; Dgag, Denv — неполные гены; sre — один из онкогенов; BLV — вирус коровьего лейкоза; tat — транскрипционный трансактиватор; sor — короткая открытая рамка считывания; 3'orf—3' — открытая рамка считывания. Функции последних двух генов у HTLV-III не известны.
Вирусы, содержащие onc-ген, немногочисленны и у человека не обнаружены. Они представляют скорее интерес для изучения механизмов неопластической трансформации, чем как этиологический фактор естественного развития опухолей. Каждая клетка, инфицированная этими вирусами, может трансформироваться (развивается поликлональная опухоль), так как продукт вирусного onc-гена оказывает непосредственное трансформирующее действие. Таким образом, для развития опухоли не требуется интеграции вируса в какой-либо определенный участок хромосомы клетки-хозяина. Общие свойства ретровирусов человека. Третья категория ретровирусов (трансактивационные ретровирусы) представлена хорошо известными вирусами человека: Т-лимфотропными вирусами типов I и II (HTLV-I и HTLV-II) и вирусом коровьего лейкоза (BLV). Третий известный ретровирус человека HTLV-III, или лимфаденопатический вирус, выделен в особую категорию. Геномы всех этих вирусов обладают следующими свойствами: 1) помимо генов вирусной репродукции, они содержат один добавочный ген или более; 2) добавочный ген (гены) негомологичен гену (генам) клеток млекопитающего, т. е. не представляет собой onc-ген; 3) по крайней мере один из добавочных генов кодирует синтез протеина, который участвует в активации экспрессии других вирусных генов и, возможно, некоторых генов клетки (преимущественно за счет связывания с регуляторными усиливающими элементами в клетке, которые сходны с вирусными ДКП). Биологический эффект этих вирусов опосредован именно этим геном, который обозначается как транскрипционный трансактиватор (tat). С учетом того, что tat кодирует синтез протеина ядра, который может активировать другие гены, становится ясно, что для индукции заболевания этому вирусу совсем не требуется интегрироваться в какую-то особую область хромосомы. Следовательно, для развития опухолевого процесса нет необходимости в продолжительной репликации вируса в организме. Сходный феномен отмечается и при развитии лимфомы у коров, вызываемой вирусом BLV. Вирус HTLV-III содержит не только три гена вирусной репликации и ген tat, но еще по крайней мере два других гена, функции которых остаются невыясненными. Вирусы HTLV-I и HTLV-II сходны по структуре, зрелая форма HTLV-III отличается от них и обладает цилиндрической сердцевиной с высокой плотностью. Первым ретровирусом, идентифицированным у человека, был HTLV-I, который в 1978 г. был выделен от мужчины с агрессивным Т-клеточным злокачественным процессом. Метод идентификации вируса основывался на определении обратной транскриптазы как следа, оставляемого ретровирусом. Этот метод оказался более чувствительным, нежели электронная микроскопия. Помимо этого, с открытием фактора роста Т-клеток, называемого в настоящее время интерлейкином-2, появилась возможность реплицировать вирус in vitro в культуре Т-лимфоцитов-мишеней. Тот же метод использовался и для изоляции вируса СПИДа. Основное свойство всех известных в настоящее время ретровирусов заключается в их тропизме к Т4 -лимфоцитам (Т-хелперы). Несмотря на то что другие клетки тоже могут инфицироваться этими вирусами, in vitro Т-хелперы в первую очередь повреждаются всеми тремя типами ретровирусов человека; кроме того, при всех заболеваниях, вызываемых ими, практически всегда повреждаются именно эти клетки. Поскольку Т4 -клетки участвуют в регуляции многих иммунных процессов, а также некоторых функций нелимфоидных клеток (см. гл. 62), нетрудно понять, почему эти вирусы вызывают столь серьезные нарушения. Человеческие ретровирусы обладают также способностью имитировать in vitro процессы, протекающие in vivo. Инфицирование Т4+-клеток вирусами HTLV-I или HTLV-II in vitro сопровождается трансформацией некоторых клеток. Свойства трансформированных клеток очень близки к свойствам первично HTLV-1-положительных клеток при Т-клеточном лейкозе взрослых (ТЛВ). Остальные Т4-клетки и другие типы Т-клеток, инфицированные HTLV-I, могут и не трансформироваться, однако у них изменяются некоторые функции. Инфицирование Т4-клеток in vitro вирусом HTLV-III с экспрессией вирусных генов может привести к преждевременной их гибели, что напоминает процессы, протекающие у больных при СПИДе. Болезни, ассоциированные с HTLV-I. В большинстве случаев лейкозов и лимфом, индуцированных HTLV-I, повреждаются T4+-клeтки, ядро которых приобретает выраженную дольчатость или которые приобретают вид гигантских многоядерных клеток. Однако в ряде случаев не удается выявить каких-либо явных морфологических изменений. Большое значение в патогенезе этих лейкозов имеют существенная экспрессия и увеличение количества рецепторов к интерлейкину-2. Рецепторы к этому фактору роста в течение непродолжительного времени определяются и в здоровых Т-клетках, но только после их иммунной активации. Инфицирование культивируемых интактных Т-клеток сопровождается изменением или полной утратой их иммунных функций. Подобные изменения происходят параллельно развитию оппортунистических инфекций, которые часто сопровождают эти вирусные лейкозы. Лейкозы/лимфомы, вызываемые HTLV-I, обычно протекают в форме лимфоидной неоплазии, известной как Т-клеточный лейкоз/лимфома взрослых (ТЛВ), которой свойственны агрессивное течение, частое развитие гиперкальциемии (механизм не известен), инфекционные осложнения и в половине случаев — формирование лейкозных инфильтратов в коже (см. гл. 294). HTLV-I может вызывать T4+-клeтoчныe лейкозы/лимфомы, для которых типично более хроническое течение (15—20 % всех случаев), кроме того, они отличаются от ТЛВ и по другим проявлениям. Патогистологически или клинически эти формы заболевания могут быть неотличимы от Т-клеточных хронических лимфоидных лейкозов, диффузных гистиоцитарных или крупно- и смешанноклеточных лимфом, грибовидного микоза или лейкоза Сезари. Лишь у небольшого процента лиц в США эти болезни протекают как HTLV-1-положительный процесс, тогда как практически во всех случаях ТЛВ обнаруживают этот вирус. В некоторых регионах, эндемичных по HTLV-I, определенные В-клеточные лимфоидные и раковые опухоли ассоциированы с HTLV-I чаще, чем это можно было бы ожидать, исходя из распространенности вируса в популяции. В отличие от HTLV-1-положительных Т-клеточных лейкозов, когда вирусные гены интегрированы в ДНК лейкозных клеток, HTLV-I не обнаруживается в ДНК поврежденных клеток при лейкозах В-клеточного происхождения. Напротив, в этих случаях вирус выявляется в интактных Т-клетках. Малигнизированные В-клетки больных продуцируют единственный тип антител, направленных против протеина HTLV-I. Таким образом, опухоли В-клеточного происхождения образуются (по крайней мере частично) за счет опосредованного влияния HTLV-I, т. е. хроническая антигенная стимуляция, сочетающаяся со снижением иммунных свойств Т-клеток, приводит к увеличению вероятности неопластической трансформации в увеличивающейся популяции В-клеток. Происхождение и эпидемиология HTLV-I. Несмотря на то что HTLV-I первоначально был обнаружен у двух лиц негроидной популяции в США со спорадической Т-клеточной опухолью, а первые кластеры этого процесcа были выявлены у жителей Японии и несколько позднее у представителей негроидной популяции, уроженцев Карибских островов, этот вирус, по-видимому, имеет африканское происхождение. В пользу этого предположения свидетельствуют: 1) широкое распространение вируса среди населения по всему Африканскому континенту; 2) преимущественная заболеваемость ТЛВ на Американском континенте и в Европе лиц африканского происхождения; 3) обнаружение у африканских примитивных обезьян близкородственного вируса (STLV-I). HTLV-I также широко распространен среди населения двух небольших островов юго-западной Японии (Кюсю и Сикоку), куда он, возможно, был привнесен африканцами в XVI в. Он имеет относительно ограниченное распространение в США и Европе, где инфицировано менее 1 % представителей европеоидной популяции, а у лиц, населяющих Азию, вирус практически не встречается. Таким образом, совсем несложно было установить эпидемиологическую связь между вирусом и вызываемыми им заболеваниями. Передается вирус при половых контактах, переливаниях крови или ее препаратов, а также через плаценту. Выдвигалось предположение о возможном переносе вируса кровососущими насекомыми, однако каких-либо убедительных данных в его пользу получено не было. С увеличением миграции населения, ростом наркомании (использование загрязненных кровью инъекционных игл), изменениями в сексуальном поведении и широким использованием переливаний крови и ее препаратов инфицированность HTLV-I может возрастать. При инфицировании HTLV-I или HTLV-II небольшая часть Т-клеток становится «бессмертной», теряя потребность в экзогенном интерлейкине-2 для поддержания роста. Этот процесс, по-видимому, опосредован продуктом гена tat, который, как полагают, связывается с регуляторными элементами Т-клеток, активирующих экспрессию гена (генов), участвующего в процессе Т-клеточной пролиферации. Один из этих генов представляет собой рецептор для интерлейкина-2, который, как уже отмечалось, существенно экспрессирован в трансформированных клетках. Причина столь частой трансформации именно Т4+-клеток остается неизвестной, ведь инфицируются не только они, но и другие типы клеток. Поддержание неопластического процесса, вероятно, требует каких-либо дополнительных генетических изменений в клетках, так как гены HTLV-I после развития ТЛВ обычно не экспрессируются. HTLV-II был первоначально изолирован из культуры клеток, полученных от мужчины, больного Т-вариантом волосатоклеточного лейкоза. Впоследствии вирус был обнаружен еще у двух представителей европеоидной популяции с хроническими формами Т-клеточных опухолей. Получены важные сведения относительно природы HTLV-II генома (он на 50 % гомологичен геному HTLV-I), его эффектов in vitro. Эти два типа вирусов лишь незначительно различаются между собой. Этиология СПИДа. Этиологическим агентом служит ретровирус, называемый HTLV-III. Этот вирус называют также лимфаденопатическим (LAV) ретровирусом, ассоциированным со СПИДом (ARV). Патогенез синдрома заключается в инфицировании вирусом T4+-индyктopныx/xeлпepныx лимфоцитов, что приводит к преждевременной гибели этих клеток. Наступающий иммунный дефект способствует развитию оппортунистических инфекций и некоторых форм злокачественных опухолей. Детально СПИД обсуждается в гл. 257. Другие болезни, обусловленные HTLV-III. Помимо характерной картины. СПИДа с оппортунистическими инфекциями, повышенной частотой развития саркомы Калоши и симптомокомплексом, соотносимым со СПИДом (см. гл. 257), инфекция HTLV-III/LAV может быть ассоциирована и с другими заболеваниями. Вирус может инфицировать головной мозг, что приводит к тяжелым нейропсихическим процессам. Известны также случаи лимфоидных интерстициальных пневмонитов, связанных с инфекцией HTLV-III/LAV. При СПИДе повышена заболеваемость определенными формами В-клеточных лимфом. Более того, при инфекции, вызванной HTLV-III/LAV, возможно увеличение частоты заболевания болезнью Ходжкина и некоторыми видами карцином с преимущественной локализацией в области головы и шеи, а также клоакогенной сквамозно-клеточной карциномой. Причина учащения этих злокачественных опухолей еще неясна. HTLV-III/LAV не может служить непосредственной причиной их развития, так как в ДНК большей части опухолевых клеток не удается выявить вирусной нуклеотидной последовательности. В механизме развития В-клеточных лимфом HTLV-III, вероятно, также играет роль опосредующего фактора. При инфекции, обусловленной HTLV-III/LAV, возможно также развитие аутоиммунной тромбоцитопении и наследственных аномалий. Цитопатическое воздействие HTLV-III/LAV на Т4'-клетки. Инфицирование Т4 -клеток HTLV-III/LAV приводит к их преждевременной гибели. Известно, что гибель инфицированной клетки наступает в результате действия одного или нескольких генов HTLV-III/LAV после внедрения в клетку ДНК-провируса. In vitro индуцировать продуктивное вирусное инфицирование Т4 -клеток невозможно до тех пор, пока они не будут подвергнуты иммунной активации. При активации в инфицированных клетках происходит тот же процесс генной экспрессии, что и в неинфицированных клетках, однако отличие заключается в экспрессии первыми еще и вирусных генов. При этом больший, чем в норме, процент клеток подвергается терминальной дифференцировке, скорость которой выше, чем у интактных клеток. За развитие этих процессов, по-видимому, ответствен ген tat-III (см. рис. 293-2). Экспрессия tat может поочередно значительно усиливать транскрипцию других вирусных генов или же клеточных генов, ответственных за усиление терминальной дифференцировки. Гетерогенность HTLV-III/LAV. При молекулярном анализе разнообразных изолятов HTLV-III/LAV были выявлены отличия в последовательности нуклеотидов и в определенных участках генома, особенно в гене, кодирующем синтез белков оболочки. Вирусный геном изменяется в процессе последовательного инфицирования клеток, но эти изменения никогда не удается выявить в клетках, культивируемых в течение продолжительного периода. В связи с этим можно предположить, что они происходят при образовании ДНК-транскрипта вирусной РНК и/или рекомбинационном процессе, когда ДНК провируса интегрируется в ДНК клетки-хозяина. Изменения в участках вирусного генома могут в итоге привести к потере вирусной частицей своих инфекционных свойств. Предупреждение инфекций, обусловленных HTLV-III/LAV, и лечение больных. В предупреждении инфекций, вызванных HTLV-III/LAV, и лечении больных выделяют три проблемы. Во-первых, Т-клетки представляют собой основной тип клеток, ответственных за антивирусные действия, одновременно они же в первую очередь повреждаются вирусом. В целом во всех случаях, когда инфицирование происходит при непосредственном контакте «клетка—клетка», мало что можно сделать для усиления защиты от вируса. Во-вторых, серьезную проблему представляет гетерогенность оболочки вируса в разных изолятах HTLV-III/LAV, однако результаты недавно проведенного сравнения нуклеотидной последовательности, ответственной за синтез белков оболочки, в нескольких изолятах вируса свидетельствуют о том, что они обладают общими сохранными зонами этого гена, некоторые из которых должны быть иммуногенными. Таким образом, теоретически задача создания вакцины для выработки защитных антител представляется вполне разрешимой. В-третьих, поскольку инфицирование означает интеграцию вирусных генов в ДНК клеток, то эти гены передаются потомству поврежденной клетки и, следовательно, инфицирование продолжается постоянно. В США более 1 млн лиц инфицированы HTLV-III/LAV. Важно, чтобы они избегали инфицирования другими агентами, которые могли бы активировать уже инфицированные Т-клетки, что способствует распространению вируса и наступлению смерти. Разработан целый ряд антивирусных препаратов, ингибирующих обратную транскриптазу или воздействующих на оболочку вируса. Другой подход к лечению больных СПИДом основан на данных структурно-функциональных исследований вирусного генома и заключается в создании препаратов, подавляющих функцию или экспрессию гена tat-III. Лечение, по-видимому, следует продолжать в течение всей жизни больного. Для уменьшения токсического действия препаратов и снижения вероятности развития резистентности вируса необходимо применять их комбинации с учетом различий в механизме действия. Еще одним направлением в лечении может быть уничтожение инфицированных клеток. Гипотетически, если можно было бы добиться их полного удаления, то соответственно достигалось бы и полное излечение. На практике, однако, осуществить это невозможно, поскольку большая часть инфицированных клеток не экспрессирует вирусные протеины и, следовательно, ничем не отличается от здоровых клеток. СПИД представляет собой относительно новое инфекционное заболевание человека и характеризуется развитием тяжких осложнений, часто приводящих к смерти больного. Подобно инфицированию HTLV-I (и, вероятно, HTLV-II), инфицирование вирусом СПИДа лиц, проживающих в Африке, произошло от зеленых мартышек или родственных видов обезьян при прямом контакте либо опосредованно через промежуточных переносчиков с последующим распространением на лиц, проживающих в других регионах. HTLV-III/LAV сходен и с HTLV-I по механизму передачи, тропизму к Т4 -клеткам, поведению in vitro и гену tat. В отличие от HTLV-I и HTLV-II вирус СПИДа содержит по меньшей мере еще два дополнительных гена, оказывает выраженное цитопатическое действие, отличается большим структурным сходством с лентиретровирусами и в целом более высокой инфекционностью.
Дата добавления: 2015-02-02 | Просмотры: 1513 | Нарушение авторских прав |