|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Секреция
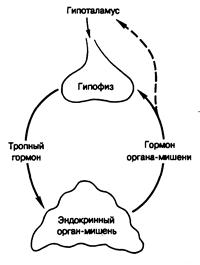
Биохимические механизмы, принимающие участие в секреторном процессе, исследованы не полностью. Полагают, что в одних случаях происходит превращение нерастворимых веществ в их растворимые производные (протеолиз тиреоглобулина с образованием тиреоидных гормонов); в других секреция обусловлена экзоцитозом запасных гранул (инсулин, глюкагон, пролактин, гормон роста). Наконец, секреция может отражать пассивную диффузию свежесинтезируемых молекул, например стероидных гормонов, по градиенту концентрации в плазму; в этих условиях скорость секреции гормона могла бы отчасти определяться скоростью кровотока в ткани. Из-за ограниченной способности к накапливанию большинство гормонов секретируется в плазму с той же скоростью, с какой образуется. Тропные гормоны гипофиза [ЛГ, адренокортикотропин (АКТГ), тиреотропин (ТТГ)] действуют на свои ткани-мишени, стимулируя одновременно и синтез, и секрецию гормонов этими тканями. Даже когда пептидные гормоны хранятся в гранулах, первоначальная секреция их сопровождается повышением скорости синтеза этих гормонов (например, при двухфазной секреции инсулина, вызываемой введением глюкозы). Секреция некоторых гормонов зависит от времени суток, сна или бодрствования, возраста и эмоционального состояния. Предполагают, что довольно часто наблюдается сопряжение между синтезом и секрецией. Быстрая регуляция секреции многих гормонов изучена плохо. Некоторые гормоны секретируются импульсно, т. е. в виде повторяющихся выбросов. Зависит ли такая интермиттирующая секреция от изменений скоростей синтеза, кровотока или каких-то других механизмов, неизвестно. Хотя физиологическое значение пульсирующей секреции не до конца ясно, изменение частоты или амплитуды гормональных выбросов в большой степени сказывается на эффектах гормонов. Так, импульсное введение рилизинг-гормона лютеинизирующего гормона (ЛГРГ) стимулирует секрецию ЛГ гипофизом, а введение тех же количеств ЛГРГ с постоянной скоростью (в течение определенного времени) оказывает противоположный эффект. Больше того, изменение частоты или амплитуды гормональных выбросов может характеризовать определенные патологические состояния. Так, нарушение суточного ритма секреции кортизола характерно для ранней стадии болезни Кушинга. Транспорт. Из мест синтеза к местам клеточного действия, метаболической инактивации и распада гормоны поступают с лимфой, кровью и внеклеточной жидкостью. Для большинства пептидных гормонов и аминов плазма, вероятно, является пассивным растворителем, а для стероидных и тиреоидных гормонов она служит источником специфических связывающих эти гормоны транспортных белков. Таким образом, чем менее гормон растворим в воде, тем более важна роль транспортных белков. Ни один из известных на сегодня транспортных белков не обладает в этом отношении исключительностью. Например, тестостерон может транспортироваться не только специфическим связывающим белком [тестостерон-эстрадполсвязывающий глобулин (ТЭСГ)], но и альбумином; тироксин транспортируется как преальбумином, так и тироксинсвязывающим глобулином (ТСГ). Гормон, связанный с белком (Г•Б), не может проникнуть в большинство внутриклеточных пространств и служит резервуаром, из которого свободный гормон (Г) путем диффузии поступает внутрь клетки: Г+Б Û Г•Б. Соотношение связанного и свободного гормона в плазме зависит от количества гормона, количества связывающего белка и сродства белка к гормону. Однако эффективный уровень свободного гормона в организме зависит и от других факторов. Например, при высокой скорости диссоциации гормона из комплекса со связывающим белком (большей, чем скорость капиллярного кровотока в данном органе) на свободную (функционально активную) фракцию гормона влияют как скорость капиллярного кровотока, гак и проницаемость мембран. Для оценки эндокринной функции большое значение имеет понимание отношений между свободным и связанным гормоном. Во-первых, свободной (диализуемой) фракции гормона in vitro обычно меньше, чем свободной фракции, существующей in vivo. Это объясняется тем, что часть гормона, находящаяся в комплексе со слабо связывающими его белками, такими как альбумин (в противовес той части, которая находится в комплексе со специфическими связывающими белками, обладающими высоким сродством к гормону), быстро отсоединяется от альбумина по мере того, как свободная фракция диффундирует из капилляров в ткани. Следовательно, гормон, связанный с альбумином in vivo. может функционировать как свободная фракция. При многих состояниях величина диализуемой фракции служит надежным показателем кажущейся свободной фракции in vivo. Однако в условиях гипоальбуминемии содержание свободной (диализуемой) фракции in vitro может увеличиваться, тогда как in vivo уровень свободного гормона снижается. Кроме того, в тех тканях, например, в печени, где белки (в том числе и комплексы гормонов с транспортными белками) подвергаются разрушению (в отличие от других тканей, где в клетки проникает только свободный гормон), количество поступающего в ткань гормона в меньшей степени зависит от величины свободной фракции последнего. Во-вторых, распределение гормонов между плазмой и тканью зависит от соотношения тканевых и плазматических связывающих белков. Поэтому истинные или кажущиеся уровни свободного гормона не отражают количество гормона в клетках. В-третьих, только свободный гормон взаимодействует с периферическими клетками и участвует в регуляторных механизмах образной связи, контролирующих скорость гормонального синтеза. Вследствие этого изменения количества транспортного белка в равновесных условиях не могут вызывать эндокринной патологии, если, конечно, не нарушены остальные звенья обратной связи в эндокринной системе. Например, резкое повышение или понижение уровня ТСГ (в силу генетических пли иных факторов) вовсе не обязательно будет сопровождаться изменением тиреоидного статуса. Так, внезапное увеличение уровня ТСГ приведет к снижению содержания свободного (диализуемого) и связанного с альбумином гормона; это должно обусловить повышение секреции ТТГ и продукции тироксина щитовидной железой, которая будет нарастать до тех пор, пока ТСГ снова не окажется насыщенным, а уровень свободного гормона вернется к норме, что в свою очередь нормализует уровень ТТГ и секрецию тиреоидных гормонов. В обратной ситуации снижение количества ТСГ временно повысит содержание свободного гормона, а секреция ТТГ и тироксина будет снижаться до тех пор, пока этот уровень не вернется к норме. Таким образом, можно сказать, что при изменении количества специфического белка, связывающего гормон с высоким сродством, может резко измениться уровень гормона, но само по себе это не может вызвать длительных симптомов избытка или недостаточности гормона, если только не нарушены регуляторные механизмы обратной связи, контролирующие синтез гормона. Однако в тех случаях, когда образование гормона не регулируется обычными механизмами обратной связи, изменение количества связывающего белка может послужить причиной эндокринной патологии. Например, у женщин уровень тестостерона непосредственно не регулирует его продукцию, и поэтому изменение количества ТЭСГ может обусловить хроническое изменение уровня свободного тестостерона. Распад и кругооборот. Уровень любого гормона в плазме (УП) зависит от двух факторов — скорости секреции (СС) гормона и скорости его метаболизма и экскреции, совместно называемой скоростью метаболического клиренса (СМК): УП=СС/СМК или СС=СМК•УП. Метаболический клиренс гормона осуществляется рядом механизмов. Небольшое количество интактного гормона выводится из организма с мочой и желчью. В тканях-мишенях, тканях, не являющихся мишенями (такие как печень и почки) или в тканях обеих групп гормон разрушается и инактивируется. Довольно часто метаболизм гормона облегчает его экскрецию, делая его способным растворяться в моче или желчи. Пептидные гормоны инактивируются, как правило, протеазами тканей-мишеней. Тиреоидные гормоны дейодируются, дезаминируются и деконъюгируют в основном в печени. Стероидные гормоны восстанавливаются, гидроксилируются и конъюгируют с остатками глюкуроновой и серной кислот. Иногда конъюгаты с желчными кислотами в желудочно-кишечном тракте гидролизуются и вновь всасываются в кровь. Механизмы разрушения разных гормонов имеют одну общую черту: катаболизм всех известных на сегодня гормонов может протекать по альтернативным путям. Из-за особенностей регуляторного механизма обратной связи изменение скорости распада гормона само по себе не может служить причиной эндокринной патологии, если только не нарушена обратная связь, которая регулирует синтез этого гормона. Например, при тяжелых заболеваниях печени и при микседеме нарушается деградация глюкокортикоидов в печени; в результате кругооборот кортизола замедляется, но его уровень в плазме не увеличивается, так как секреция АКТГ оказывается заторможенной. Таким образом, нормальный уровень свободного гормона поддерживается в результате снижения скорости секреции кортизола. Обратная ситуация наблюдается при ускорении распада глюкокортикоидов (как при тиреотоксикозе); в такой ситуации нормальный уровень гормона обеспечивается возрастанием его секреции. Хотя изменения скорости распада гормона сами по себе не приводят к его дефициту или избытку, они имеют большое значение для эндокринной фармакологии. Так, у больных с микседемой или патологией печени глюкокортикоиды даже в обычных дозах могут вызывать синдром Кушинга, поэтому их дозировку необходимо снижать. Напротив, при гипертиреозе дозы глюкокортикоидов следовало бы увеличивать. Кроме того, возникновение гипертиреоза у лиц с недостаточными резервами надпочечников могло бы (за счет ускорения катаболизма глюкокортикоидов) вызвать адреналовый криз. Таким образом, при нарушении или отсутствии нормальных сервомеханизмов, регулирующих синтез гормонов, изменение скорости их распада может либо утяжелять, либо вызывать эндокринную патологию. Регуляция продукции гормонов. Выше отмечалось, что уровень гормонов у здорового человека колеблется в результате изменения скорости их продукции, а последняя прямо или косвенно регулируется метаболической активностью самого гормона. Такая регуляция осуществляется за счет существования ряда петель обратной связи (рис. 320-1). В некоторых случаях необходимо, чтобы уровень гормона в крови был строго постоянным. Поэтому должны существовать какие-то сенсорные механизмы, следящие либо за уровнем самого гормона, либо за состоянием регулируемых им функций, таких как осмоляльность плазмы, концентрация глюкозы в крови, уровень кальция в плазме или содержание натрия в организме. Например, гормоны (кортизол, тироксин, половые стероиды), выделяющиеся под влиянием гипофизарных тропных гормонов, оказывают обратное действие на гипоталамо-гипофизарную систему, регулируя скорость собственной секреции. Подобно этому, секреция паратиреоидного гормона и инсулина зависит от обратных сигналов со стороны соответственно уровня кальция в сыворотке и глюкозы в крови. Системы обратных связей обычно более сложны, чем описанная схема; иногда они включают ряд промежуточных звеньев. В тех случаях, когда в роли обратного сигнала выступает непосредственно сам гормон (как, например, при действии тестостерона на гипофиз), его эффект обусловливается теми же клеточными механизмами, которые определяют его действие и в других тканях-мишенях.
Рис. 320-1. Гипофизарная регуляция таких эндокринных органов, как надпочечники, щитовидная железа или гонады, по механизму обратной связи.
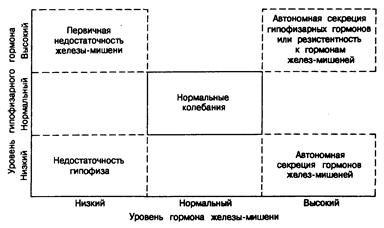
Обратная связь может быть как отрицательной, так и положительной. Примером положительной обратной связи служит стимуляция секреции Л Г эстрадиолом перед овуляцией. На регуляторные механизмы положительной или отрицательной обратной связи или на их реактивность могут влиять факторы негормональной природы и внешней среды. Характерная особенность систем обратной связи — быстрота функционирования. Действительно, в ответ на меняющиеся метаболические потребности большинство таких связей срабатывает за несколько минут или часов, обеспечивая гомеостаз в узких границах. Исключения связаны с регуляцией гаметогенеза в яичниках и семенниках (см. гл. 330 и 331). В обоих случаях в действие вступают сложные процессы дифференцировки. В состоянии равновесия эти системы функционируют так, что продукция сперматозоидов постоянно остается относительно стабильной, а овуляция протекает циклично. Однако для завершения сперматогенеза требуется примерно месяц, и поэтому изменения уровня ФСГ долгое время могут не сказываться на скорости продукции сперматозоидов. Тот факт, что секреция гормонов находится под регуляторным контролем, имеет важное клиническое значение. Во-первых, оценить клиническое значение уровня гормона в плазме можно только с учетом состояния соответствующих регуляторных факторов (рис. 320-2). Понять, о чем свидетельствует некоторое снижение уровня тестостерона, можно лишь при одновременном определении уровня ЛГ. Точно так же, интерпретировать те или иные уровни инсулина ч паратиреоидного гормона в плазме можно лишь при одновременном определении соответственно содержания глюкозы и кальция в плазме. Во-вторых, данные об одновременном повышении уровня гормональных пар (пара гормон — регуляторный фактор) при отсутствии признаков избытка гормона указывают на существование резистентности к последнему. Например, одновременно повышенное содержание в плазме глюкозы и инсулина характерно для инсулинорезистентности; одновременное повышение уровней ЛГ и тестостерона свидетельствует о резистентности к андрогенам и т. д. В-третьих, понимание механизмов регуляции секреции гормонов составляет основу различных динамических тестов на резервы и секрецию гормонов. Механизмы действия гормонов. Первый этап действия гормонов заключается в их взаимодействии со специфическими макромолекулами клетки, так называемыми гормональными рецепторами, расположенными либо на плазматической мембране клеточной поверхности, либо в цитоплазме. Гормоны, рецепторы которых расположены на поверхности клеток. Гормоны первого типа связываются поверхностными рецепторами, расположенными на плазматической мембране (рис. 320-3). Различают три вида взаимодействия гормонов с плазматической мембраной. При взаимодействии первого вида (Г, на рис. 320-3) гормонрецепторный комплекс, находящийся на поверхности клеток, вызывает образование так называемого второго посредника — циклического аденозин-3',5'-монофосфата (цАМФ), и последующие действия гормона опосредуются цАМФ (подробнее см. гл. 67). Этот механизм характерен для некоторых белковых гормонов и биогенных аминов. При взаимодействии второго вида (Г, на рис. 320-3) рецептор клеточной поверхности индуци
Рис. 320-2. Связь между уровнем гормона железы-мишени и уровнем тропного гормона в норме и при патологических состояниях (например, между ТТГ и тиреоидными гормонами, АКТГ и кортизолом, ЛГ и тестостероном).
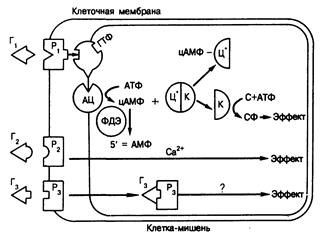
Рис. 320-3. Схема действия гормонов, рецепторы которых расположены на поверхности клетки. Обозначения: Г— гормон, Р — рецептор, К — каталитическая субъединица протеинкиназы, Ц — цАМФ-связывающая субъединица протеинкиназы, цАМФ-циклический АМФ, АЦ— аденилатциклаза, С — субстрат, СФ — фосфорилированный субстрат, ФДЭ — фосфодиэстераза.
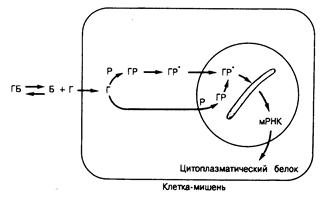
рует продукцию или высвобождение иных вторых посредников, например кальция. Этот механизм характерен для некоторых нейротрансмиттеров и РТГ. Механизм высвобождения кальция и его действия в такой системе неизвестен; возможно, действие кальция проявляется в его связывании с белком, регулирующим активность ферментов, — кальмодулином. При взаимодействии третьего вида (Г, на рис. 320-3) комплекс поверхностный рецептор — гормон интернализуется внутрь клетки, но последующие события остаются неясными. К последней категории гормонов относится инсулин (см. гл. 327). Из этих систем лучше изучены те, в которых вторым посредником служит цАМФ (см. рис. 320-3). Концентрация цАМФ в клетке регулируется двумя ферментами, обладающими противоположной активностью. Аденилатциклаза (АЦ), локализованная в плазматической мембране, превращает аденозинтрифосфат (АТФ) в цАМФ. Фосфодиэстераза (ФДЭ), находящаяся в основном в цитозоле клетки, инактивирует цАМФ, превращая его в 5'-аденозинмонофосфат (5'-АМФ). Гормоны (Г1), действующие на клеточную поверхность, образуют обратимые комплексы со специализированными белковыми рецепторами мембраны (Р1). Эти белки обладают высоким сродством к гормону, но имеют ограниченную емкость. Образование гормонрецепторного комплекса приводит к стимуляции аденилатциклазы. Комплекс Г1Р1 связывает N-субъединицу аденилатциклазы (которая связывает и ГТФ) и активирует каталитическую субъединицу АЦ, стимулируя тем самым синтез цАМФ. Фосфорилирующиеся ферменты, известные под названием протеинкиназ, играют, по-видимому, ключевую роль в общем процессе. Эти киназы (ЦК) состоят из каталитических (К) и регуляторных (Ц) субъединиц. Связывание цАМФ с Ц высвобождает К, что приводит к фосфорилированию различных белков (С), сопровождающемуся их активацией или инактивацией. Гормоны, рецепторы которых расположены внутри клетки. Стероидные и тиреоидные гормоны транспортируются в плазме, будучи связанными с белками-носителями (рис. 320-4). Белково-связанные гормоны (ГБ) находятся в динамическом равновесии с небольшими количествами свободных гормонов (Г), которые пассивно диффундируют в клетки, где они действуют принципиально иным образом, чем пептидные гормоны. В большинстве случаев основная секретируемая в плазму форма гормона (кортизол, прогестерон, альдостерон, эстрадиол) не подвергается дальнейшему метаболизму, и именно она обусловливает гормональный эффект в клетке-мишени. Другие гормоны (тироксин, тестостерон) подвергаются химическому превращению в более активные формы (трийодтиронин, дигидротестостерон). Гормон связывается специфическим рецепорным белком(Р) цитоплазмы, образуя гормонрецепторный комплекс (ГР). Последний в ходе недостаточно изученного зависимого от температуры процесса подвергается трансформации, образуя активированный комплекс (ГР'), способный связываться хроматином. В результате этого связывания образуются новые молекулы информационных РНК (мРНК) и усиливается синтез цитоплазматических белков. Последние в свою очередь опосредуют эффекты гормона. В некоторых случаях (трийодтиронин и отдельные стероиды) незанятые рецепторные белки локализуются преимущественно в ядрах; при этом свободный гормон проникает в ядро, где и образуется активный гормонрецепторный комплекс, аналогичным образом присоединяющийся к хроматину.
Рис. 320-4. Механизм действия гормонов, рецепторы которых расположены внутри клетки. Обозначения: Г — гормон, Б — транспортныи белок плазмы, Р — рецептор. Р• — активированнып рецептор. мРНК — информационная (мессенджер) РНК. Оценка гормональной функции. На практике эндокринный статус оценивают путем определения уровней гормонов в плазме, экскреции гормонов или некоторых из метаболитов с мочой, скорости секреции гормонов, проведения динамических тестов на резервы и регуляцию гормонов, исследования гормональных рецепторов и отдельных эффектов гормонов в тканях-мишенях или с помощью комбинации таких подходов. Каждая из этих методик оказывается полезной в конкретных клинических ситуациях. Уровень гормона в плазме. Содержание стероидных и тиреоидных гормонов в плазме колеблется от 1 нМ до 1 мкМ, а пептидных гормонов — от 1 пМ до 0,1 нМ. Применение новейших химических, хроматографических, радиорецепторных и радиоиммунологических методик для определения веществ, присутствующих в плазме в низких концентрациях, явилось одним из крупных достижений современной медицины. Для оценки гормонального статуса в большинстве клинических ситуаций достаточно однократного определения содержания гормонов, уровень которых в плазме относительно стабилен в разное время суток и в разные сутки (тироксин и трийодтиронин). Однако по ряду причин к результатам таких определений следует относиться с осторожностью. Во-первых, химические и радиоиммунологические методы позволяют получить правильное представление о содержании в плазме в данный момент только гормонов с относительно простой структурой (стероидные и тиреоидные гормоны). У более сложных пептидных гормонов структуры физиологически активных гормональных молекул в плазме могут существенно варьировать, причем с помощью специфических радиоиммунологических методик некоторые из них плохо поддаются определению. Например, стандартные радиоиммунологические методики определения ЛГ и паратиреоидного гормона могут подчас давать заниженные или завышенные результаты, характеризующие количество биологически активного гормона в плазме. В таких ситуациях для оценки эндокринного статуса можно применять радиорецепторные или биологические методы определения гормонов in vitro. Во-вторых, при определении гормонов, секреция которых имеет пульсирующий характер (ЛГ, тестостерон), нельзя быть уверенным в том, что результат однократного определения отражает средний уровень гормона в плазме. В этих случаях определение нужно проводить либо в нескольких пробах плазмы, отбираемых случайным образом, либо в аликвотах объединенных трех — четырех проб плазмы, отбираемых с 20—30-минутными интервалами. В-третьих, когда уровень гормона в плазме колеблется (например, суточные колебания концентрации кортизола), отбор проб плазмы можно приурочить к тому времени, которое позволяет точнее судить о гормональном статусе. Однако и при этом следует помнить, что уровень гормона в плазме может колебаться в течение суток только в определенные периоды жизни (содержание ЛГ в ранние стадии пубертата). Правильная интерпретация содержания гонадотропинов, прогестерона и эстрадиола в плазме крови женщин детородного возраста требует учета фазы овуляторного и менструального циклов, и иногда, чтобы получить поддающиеся интерпретации данные, приходится последовательно проводить анализы в течение многих дней. Уровень некоторых гормонов (таких как тироксин и тестостерон) зависит и от сезонных колебаний, но они обычно столь малы, что не влияют на интерпретацию отдельных результатов. Иногда колебания уровня гормонов обусловлены не какой-то явной ритмичностью, а обострениями и затуханиями патологического процесса. Так, для диагностики синдрома Кушинга или гиперпаратиреоза могут потребоваться повторные определения содержания кортизола или кальция и паратиреоидного гормона в течение многих месяцев. В-четвертых, если речь идет о стероидных и тиреоидных гормонах, которые присутствуют в плазме в основном в связанном с белками виде, определение общей концентрации их дает представление об эндокринном статусе только в той степени, в какой оно позволяет судить об уровне свободного, или несвязанного, гормона. На самом деле содержание свободных гормонов (как правило, 1% или меньше от общего их содержания) определяют лишь в немногих лабораториях. Так как количество свободного гормона зависит от количества и сродства связывающих транспортных белков и общего количества гормона, последнее отражает уровень свободного гормона лишь постольку, поскольку количество связывающего белка (белков) остается постоянным или колеблется лишь в узких пределах. При повышении содержания связывающего белка (ТСГ и ТЭСГ при беременности) или его снижении [наследственное снижение ТСГ и кортикостероидсвязывающего глобулина (КСГ)], чтобы судить об уровне свободного гормона, следует применять методы, позволяющие определять количества связывающего белка (поглощение Т, смолой для ТСГ или прямое определение ТСГ, ТЭСГ или КСГ). В-пятых, концентрация большинства гормонов в плазме среди здорового населения колеблется в широких пределах. Следовательно, у какого-либо человека уровень гормона может снижаться или возрастать даже вдвое (и это будет резким нарушением для данного человека), но все еще оставаться в так называемых нормальных пределах. Поэтому часто возникает необходимость одновременного определения уровня соответствующих гормональных пар (ЛГ и тестостерон, тироксин и ТТГ). Уровень тестостерона на нижней границе нормы на фоне повышенного содержания ЛГ в плазме указывает на недостаточность семенников, тогда как тот же уровень тестостерона при нормальной концентрации ЛГ свидетельствует о нормальном эндокринном статусе (см. рис. 320-2). Подобно этому, у женщин с повышенной продукцией тестостерона и вторичным снижением уровня ТЭСГ концентрация тестостерона в плазме может быть нормальной, несмотря на нарушение его продукции. Экскреция с мочой. Определение экскреции гормона или его метаболита с мочой, что отражает уровень данного гормона в плазме или скорость его секреции, обладает некоторыми преимуществами перед отдельным определением его уровня в плазме, так как дает представление о средней концентрации гормона в плазме за период сбора мочи. Действительно, уровень свободного кортизола в суточной моче может лучше отражать функцию коры надпочечников, чем результат однократного определения концентрации кортизола в плазме. Однако опять-таки необходимо учитывать определенные ограничения такого подхода. 1. Чтобы убедиться в правильности сбора мочи, всегда следует определять содержание в ней креатинина. Женщины экскретируют в сутки примерно 1 г, а мужчины 1,8 г креатинина. Различия в разные дни не должны превышать 20%. 2. Не при всех состояниях экскреция отдельных метаболитов отражает изменения в секреции гормона. Например, на образование 18-оксо-производного альдостерона могут влиять фармакологические средства, не меняющие секрецию гормона или его уровень в плазме. 3. Содержание гормонов в моче, очевидно, не отражает динамику тех из них (тироксин, трийодтиронин), которые экскретируются с желчью. Еще более важен тот факт, что пептидные гормоны, такие как гонадотропины, у разных лиц могут метаболизироваться по-разному, прежде чем попадут в мочу. Поэтому установить границы нормы для экскреции соответствующих метаболитов весьма трудно. 4. Гормоны, образующиеся в разных железах, могут экскретироваться в виде общих метаболитов. Так, 17-кетостероны мочи образуются из андрогенов как надпочечников, так и половых желез, и их определение поэтому мало что говорит о тестикулярной продукции андрогенов у мужчин. 5. На скорость экскреции гормонов с мочой могут влиять нарушения функции почек. Эти влияния удается отчасти нивелировать определением креатинина в моче, но в случае метаболитов или конъюгатов, образующихся в самих почках, их экскреция может меняться непропорционально снижению клиренса креатинина. Скорости секреции и продукции. Определение реальной скорости секреции гормона позволяет избежать многих неясных моментов, возникающих при измерении уровня гормона в плазме и его экскреции с мочой. Методика таких измерений включает введение радиоактивного гормона и учет разведения, которому подвергается метка вследствие смешивания с эндогенно секретируемым за определенное время нерадиоактивным гормоном. На практике выделяют из плазмы сам гормон, а из мочи — его специфический метаболит, очищают их до радиохимической гомогенности и полученный результат (в цифровом выражении) используют для расчета секретируемого за время исследования количества гормона. Если речь идет о гормонах, образующихся главным образом в периферических тканях (эстрадиол и дигидротестостерон у мужчин, трийодтиронин у мужчин и женщин), можно вводить меченые предшественники и для оценки общей скорости продукции измерять скорость их превращения в данные метаболиты. Возможен и иной подход к определению скорости секреции. Для этого нужно знать скорость клиренса гормона и средний его уровень к плазме. К сожалению, все эти методики сложны и трудоемки, требуют применения радиоактивных изотопов и могут выполняться лишь в немногих центрах. Дииамические тесты на резервы гормонов и гормональную рег у ляцию. При выраженной гипо- или гиперфункции эндокринной железы для постановки диагноза достаточно определить уровень гормона в крови или моче, особенно если тестирование обнаруживает сохранность обратных связей. Например, низкий уровень тестостерона в плазме па фоне высокого содержания в ней ЛГ указывает на первичную недостаточность тестикул. Однако в менее ясных случаях, чтобы оценить значение некоторого снижения уровня гормона, целесообразно использовать стимуляционные тесты. Точно так же для доказательства гиперфункции той или иной эндокринной железы применяют тесты на подавление (супрессивные). Все динамические тесты такого рода направлены на лучшую оценку состояния механизмов регуляции эндокринных желез по принципу обратной связи (см. рис. 320-1). В практике используют стимуляционные тесты двух типов. Первый заключается в блокаде продукции или действия эндогенного гормона (например, в блокаде продукции кортизола метирапоном или действия эстрадиола кломифеном) с последующей оценкой способности гипофиза реагировать увеличением эндогенной продукции тропного гормона и/ или реакции железы-мишени. В идеальном случае такие тесты позволяют проверить целостность всей замкнутой петли — гипоталамус— гипофиз —железа-мишень. При стимуляционных тестах другого типа вводят тропный гормон по определенной схеме и регистрируют реакцию железы-мишени (например, уровень кортизола до и после введения АКТГ). Стимуляционные тесты полезны в четырех случаях: для оценки гормонального статуса при трудности или ненадежности количественного определения уровня гормона в плазме (АКТГ); для оценки эндокринного статуса при «пограничных» значениях уровня гормона; для разграничения первичной и вторичной (гипофизарной) недостаточности эндокринной железы и для оценки резервов функции половых желез у лиц препубертатного возраста, когда трудно интерпретировать уровень гонадотропинов и половых стероидов в плазме. Супрессивные тесты применяют для диагностики гиперфункции эндокринных желез, когда известно, что гиперфункционирующая железа работает в условиях нарушения механизмов регуляции. Однако результаты супрессивных тестов могут быть недостаточно точными. Например, может измениться (возрасти) порог чувствительности гипофиза к гормону, подавляющему его функцию по механизму обратной связи (как, например, гипофизарная секреция АКТГ при болезни Кушинга), или секреция может быть автономной (та же секреция АКТГ при раке легкого). Принцип теста заключается во введении регулятора, действующего по механизму обратной связи, с оценкой степени снижения функции изучаемой железы (изменение захвата 131I после введения тиреоидных гормонов, изменение секреции кортизола после введения активных экзогенных глюкокортикоидов, снижение уровня гормона роста в плазме после введения глюкозы). Клиническое значение динамических тестов по определению эндокринной функции ограничено, так как на их результаты влияет множество дополнительных факторов. Возраст, сопутствующие болезни и лекарственные препараты — все это меняет реактивность желез внутренней секреции и снижает специфичность таких тестов. Рецепторы и антитела к гормоиам. Исследование гормональных рецепторов в биоптатах тканей-мишеней или в культуре фибробластов, выделенных из таких биоптатов, важно, например, для диагностики состояний резистентности к определенному гормону (рахит вследствие резистентности к витамину D, гипергликемия и гиперинсулинемия при инсулинорезистентности, мужской псевдогермафродитизм вследствие резистентности к андрогенам). Подобно этому, для оценки эндокринного статуса иногда полезно определить наличие антител к гормонам (например, антитела к тиреоидным гормонам могут вызывать гипотиреоз) или к железам (надпочечникам, гонадам, щитовидной железе). За некоторым исключением (антитела к тиреоидной ткани) такие исследования не получили широкого применения. Тканевые эффекты. Идеальным гормональным тестом служит, вероятно, определение конечного результата действий гормона на его периферические ткани-мишени. Например, доказательство способности максимально концентрировать мочу при пробе с сухоядением свидетельствует об интактности гипоталамических регуляторных механизмов, о нормальной способности задней доли гипофиза секретировать вазопрессин, об интактности вазопрессиновых рецепторов и о функционировании пострецепторных механизмов действия этого гормона. В оптимальном случае такой тест дает представление о работе всей цепи секреции ч действии гормона. На практике, однако, многие из этих тестов несовершенны. Например, даже при нормальной секреции вазопрессина собственно почечная патология может обусловливать постоянно низкую осмоляльность мочи и, таким образом, искажать результаты функционального теста на действие вазопрессина. В других случаях такие тесты трудноосуществимы и дают искаженные результаты из-за различных причин (например, основной обмен возрастает при лихорадке даже в случае нормальной функции щитовидной железы). В этой ситуации показана идентификация других маркеров действия гормонов на отдельные ткани. Клинические синдромы. Эндокринопатии могут быть обусловлены недостаточностью гормона, его избытком или резистентностью к нему, а также нарушениями нескольких эндокринных осей, часто существующими у одного и того же больного. Состояния дефицита. За немногим исключением (кальцитонин), недостаточность гормона обусловливает патологическую симптоматику. Изучение симптомов патологии, возникающих при недостаточности или отсутствии гормона, сыграло важную роль в развитии эндокринологии как науки. В дальнейшем были предприняты попытки экстрагировать соответствующие гормоны из нормальных эндокринных тканей, охарактеризовать их химическую природу (и в конце концов синтезировать их) и вводить в организм для возмещения дефицита. Обычное лечение больных с гипотиреозом введением тиреоидных гормонов по своей эффективности, вероятно, не уступает любым лечебным мероприятиям. Поскольку клинические состояния, связанные с гормональной недостаточностью, можно воспроизвести у экспериментальных животных путем разрушения или удаления той или иной эндокринной железы, получены обширные сведения о патофизиологии таких состояний (сахарный диабет, гипофизарная и надпочечниковая недостаточность, гипотиреоз и гипогонадизм). Во многих случаях известны причины, приводящие к недостаточности органов эндокринной системы. Это инфекции (недостаточность надпочечников при туберкулезе), инфаркты (послеродовая недостаточность гипофиза) и гибель тканей от других причин (сахарный диабет вследствие панкреатита), опухоли (хромофобные аденомы гипофиза), аутоиммунные процессы (тиреоидит Хашимото), неадекватность диеты (гипотиреоз вследствие дефицита йода) и наследственные нарушения (гипофизарная карликовость). При некоторых формах сахарного диабета причиной может служить наследственная предрасположенность, обусловливающая повышенную чувствительность поджелудочной железы к различным разрушающим ее ткань факторам (см. гл. 327). При других формах эндокринной недостаточности причина нарушения остается неизвестной (обычная микседема и врожденная анорхия). Избыток гормонов. За немногими исключениями (тестостерон у мужчин, прогестерон у мужчин и женщин) избыток гормона вызывает патологическую симптоматику. Известны четыре основные причины, приводящие к избытку гормонов. В первом случае избыточное количество гормона продуцирует железа, которая и в норме служит местом его образования (гипертиреоз, акромегалия, болезнь Кушинга). Это обусловлено нарушением или обходом регуляторных механизмов обратной связи, которые в норме контролируют продукцию гормона. Но основная причина заболевания часто остается неизвестной, поскольку экспериментальных моделей таких состояний у животных получить не удается. Во втором случае при избытке гормонов их продуцируют ткани (обычно злокачественные), которые в норме не являются эндокринными органами (например, продукция АКТГ овсяноклеточным раком легких, секреция тиреоидных гормонов овариальной струмой). Такая ситуация описана для многих гормонов (см. гл. 303). В третьем случае избыток гормонов обусловлен гиперпродукцией гормона в периферических тканях из присутствующих в крови предшественников (например, гиперпродукцией эстрогенов при поражениях печени, когда предшественник андростендион вместо обычного места своего катаболизма в печени попадает во внежелезистые места образования эстрогенов). Кроме того, избыток гормонов слишком часто обусловливается ятрогенными причинами (например, осложнения глюкокортикоидной терапии формируют большую клиническую проблему) (см. гл. 325). Избыток гормона может быть и следствием нескольких причин. Например, тиреотоксикоз может развиться в результате гиперпродукции ТТГ (редко), действия негипофизарных тиреоидстимулирующих факторов, аутоиммунной гиперфункции щитовидной железы, выхода предобразованного гормона из тиреоидной ткани при ее воспалении или избытка гормона нетиреоидного происхождения, как при передозировке тиреоидных гормонов или овариальной струме (см. гл. 324). Поэтому одной из наиболее важных проблем клинической эндокринологии является выяснение причины состояний, обусловленных избытком конкретного гормона. Продукция аномальных гормонов. В некоторых случаях эндокринное заболевание может быть вызвано аномалией гормонов. Одна из форм сахарного диабета обусловливается мутацией одиночного гена, что приводит к продукции аномальной молекулы инсулина, которая не действует, поскольку не связывается с инсулиновым рецептором. В других случаях в кровь попадают предшественники гормонов или неокончательные формы пептидных гормонов, что часто наблюдается при так называемой эктопической продукции гормонов опухолями (см. гл. 303). Кроме того, с гормональными рецепторами могут связываться иммуноглобулины, имитирующие тем самым эффекты гормонов, например тиреоидстимулирующие иммуноглобулины при гипертиреозе (см. гл. 324) или антитела к инсулиновым рецепторам, обладающие некоторым инсулиноподобным влиянием (гл.327). Резистентность к гормонам. О том, что к эндокринопатии может привести отсутствие реакции тканей на нормальные (или повышенные) количества гормона, свидетельствовали случаи псевдогипопаратиреоза, обусловленного периферической резистентностью к действию паратиреоидного гормона (см. гл. 67 и 336). Эта концепция имела далеко идущие последствия. Во-первых, она послужила главным стимулом изучения внутриклеточных механизмов действия гормонов. Во-вторых, обнаруживались все новые и новые формы резистентности к гормонам, так что в настоящее время известны болезни, связанные с резистентностью к большинству гормонов. Часто такая резистентность имеет генетические причины. В-третьих, резистентность к гормонам может обусловливаться многими причинами, включая нарушения рецепторных и пострецепторных механизмов их действия, появление антител к гормонам и их рецепторам и отсутствие клеток-мишеней. В-четвертых, в настоящее время установлено, что рецепторные нарушения играют роль в патогенезе и неэндокринных заболеваний, таких как злокачественная миастения и семейная гиперхолестеринемия. Общей чертой состояний, обусловленных резистентностью к гормонам, является нормальное или повышенное содержание гормона в крови при наличии признаков недостаточности гормонального эффекта (см. рис. 320-1). Это объясняется тем, что секреция большинства гормонов регулируется механизмами обратной связи и недостаточность действия гормона обычно приводит к повышению его продукции. Однако резистентность к гормону необязательно в равной мере проявляется во всех его тканях-мишенях. Например, может существовать избирательная резистентность гипофиза к тиреоидным гормонам, а при одной из форм резистентности к андрогенам действие последних в тестикулах нарушается в большей степени, чем в других тканях-мишенях. Выяснение патогенеза таких избирательных дефектов, несомненно, должно помочь пониманию факторов, определяющих природу восприимчивости разных тканей к гормонам. Болезни, вызывающие множественные поражения эндокринных органов. Существование болезней, нарушающих функции сразу нескольких органов эндокринной системы, известно со времени описания в 19-м веке пангипопитуитаризма. Такие заболевания могут иметь разные причины, включая аутоиммунные ферменты (аутоиммунная полигландулярная дисфункция, или синдром Шмидта), рецепторные нарушения (резистентность к гонадотропинам и тиреотропину при псевдогипопаратиреозе), опухоли (множественная эндокринная неоплазия —МЭН) и наследственные дефекты неясной этиологии (липодистрофии) (см. гл. 334). Они характеризуются состоянием как гипо-, так и гиперфункции эндокринных желез, а некоторые клинические синдромы могут встречаться при нескольких полиэндокринных патологиях (феохромоцитома при МЭН II и МЭН III, сахарный диабет при синдроме Шмидта и при липодистрофии). Поскольку каждая эндокринопатия, протекающая в таких сочетаниях, может встречаться и сама по себе, то при обследовании эндокринных больных особое внимание необходимо обращать на полигландулярные синдромы. Это особенно важно потому, что лечение одной железы может привести к ухудшению состояния другой (хирургические операции, такие как тиреоидэктомия, могут ухудшать течение нераспознанной феохромоцитомы), а также потому, что при некоторых семейных синдромах необходимы систематические поиски признаков патологии у потенциально пораженных членов семьи.
Дата добавления: 2015-02-02 | Просмотры: 1291 | Нарушение авторских прав |