|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ТЕРМІНИ I ВИЗНАЧЕННЯДля успішного виробництва ліків необхідно правильно вживати і розуміти терміни, які повинні точно відбивати зміст і не припускати подвійного тлумачення. У цьому розділі подано основні (базові) терміни, якими найбільш широко користуються в навчальній, довідковій та спеціальній літературі, а також у виробничій діяльності (при впорядкуванні нормативно-технічної документації та ін.). Наведені в цьому розділі визначення можуть відрізнятися в інших документах, або терміни можуть мати інше значення. Наприклад, Настанова 42-01-2001 «Лікарські засоби. Належна виробнича практика» наводить таке визначення серії: Серія — певна кількість вихідної сировини, пакувальних матеріалів або
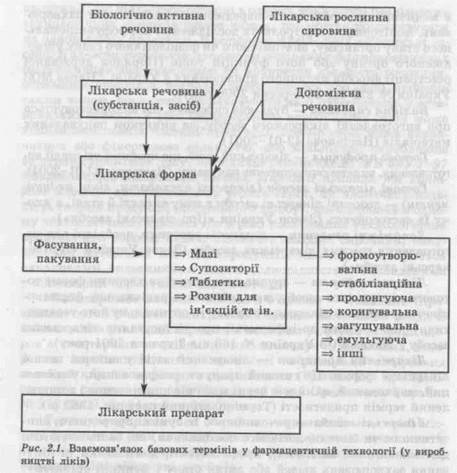
продукції, що піддається обробці в одному або в низці послідовних технологічних процесів таким чином, що можна розраховувати на однорідність продукції. Настанова 42-02-2002 «Лікарські засоби. Належна виробнича практика активних фармацевтичних інґредієнтів» визначає серію як конкретну кількість речовини, отриманої внаслідок технологічного процесу або серії процесів таким чином, що можна розраховувати на її однорідність у встановлених межах. У разі безперервного виробництва серія може відповідати певній частині продукції. Розмір серії може визначатися або фіксованою кількістю, або кількістю, виробленою за певний проміжок часу. Методичні рекомендації MB 64У-1-97 «Виробництво лікарських засобів. Належні правила та контроль якості» використовують термін серія, як визначену кількість готової продукції (лікарського засобу), що одержана в одному технологічному процесі або в ряді послідовних технологічних процесів при обробці певної кількості вихідної сировини, пакувальних матеріалів або напівпродуктів, яка характеризується однаковими показниками якості (однорідністю), закладеними у відповідній нормативній документації. Міністерство охорони здоров'я України — головний (провідний) орган у системі центральних органів виконавчої влади із забезпечення реалізації державної політики у сферах охорони здоров'я, санітарного та епідемічного благополуччя населення, створення, виробництва, контролю якості та реалізації лікарських засобів і виробів медичного призначення (Положення про Міністерство охорони здоров'я України / Указ Президента України № 918/2000 від 24 липня 2000 року). Державна фармакопея України — правовий акт, який містить загальні вимоги до лікарських засобів, фармакопейні статті, а також методики контролю якості лікарських засобів (Закон України «Про лікарські засоби»). Державний реєстр лікарських засобів України — нормативний документ, який містить відомості про лікарські засоби, дозволені для виробництва й застосування в медичній практиці (Закон України «Про лікарські засоби»). Активний фармацевтичний інґредієнт (лікарськаречовина, діюча речовина) — будь-яка речовина (чи суміш речовин), що призначена для використання у виробництві лікарського препарату і яка при використанні у виробництві лікарського засобу стає його активним інґредієнтом. Такі речовини виявляють фармакологічну чи іншу безпосередню дію; їх застосовують для лікування, діагностики чи профілактики захворювання, для зміни стану, структур або фізіологічних функцій організму, для догляду, обробки, а також для полегшення симптомів (Настанова 42-02-2002). Вироби медичного призначення — вироби медичної техніки, матеріали, медичні вироби, обладнання тощо, які застосовуються в медичній практиці для попередження і діагностики захворювань, моніторингу, контролю та дослідження морфофункціональ-ного стану організму, анатомічного чи фізіологічного стану ушкодженого органу або його функцій тощо (Порядок державної реєстрації виробів медичного призначення в Україні / Наказ МОЗ України № 229 від 26 вересня 2000 року). Вихідна сировина — будь-яка сировина, що використовується при виготовленні лікарського засобу, за винятком пакувальних матеріалів (Настанова 42-01-2001). Готова продукція — лікарський засіб, що пройшов усі стадії виготовлення, включаючи остаточне пакування (Настанова 42-01-2001). Готові лікарські засоби (лікарські препарати, ліки, медикаменти) — дозовані лікарські засоби в тому вигляді й стані, в якому їх застосовують (Закон України «Про лікарські засоби»). Допоміжні речовини — додаткові речовини, необхідні для виготовлення готових лікарських засобів (Закон України «Про лікарські засоби»). Лікарська форма — зручва для вживання хворими форма готового лікарського засобу, яка забезпечує раціональну фармакокінетику готового лікарського засобу та оптимальну його терапевтичну дію (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Лікарський препарат — лікарський засіб у вигляді певної лікарської форми. Це готовий продукт, розфасований, упакований, маркований, який має певне медичне призначення і встановлений термін придатності (Термінологічний словник, 1982 p.). Лікарські засоби — речовини або їх суміші природного, синтетичного чи біотехнологічного походження, які застосовуються для запобігання вагітності, профілактики, діагностики та лікування захворювань людей або зміни стану і функцій організму. До лікарських засобів належать: діючі речовини (субстанції); готові лікарські засоби (лікарські препарати, ліки, медикаменти); гомеопатичні засоби; засоби, які використовуються для виявлення збудників хвороб, а також боротьби із збудниками хвороб або паразитами; лікарські косметичні засоби; лікарські домішки до харчових продуктів (Закон України «Про лікарські засоби»). Лікарські засоби-генетики — лікарські засоби, здатні замінити новий лікарських засіб після закінчення терміну дії патенту (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Лікарська рослинна сировина — свіжі чи висушені лікарські рослини та їхні частини (Настанова 42-01-2001). Взаємозв'язок основних (базових) термінів і понять, наведених на рис. 2.1, відбиває найбільш характерні показники технологічних процесів виробництва ліків.
Аналітична нормативна документація (АНД) — матеріали щодо методів аналізу якості лікарського засобу, а також інша документація (фармакопейні статті), що дає змогу контролювати його якість (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 p.). Біодоступність — рівень та ступінь усмоктування субстанції з готової лікарської форми, що визначається графіком «концентрація — час» при його системній циркуляції чи виділенні із сечею (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Біоеквівалентність — порівняльна характеристика двох лікарських засобів за однакових умов, яка підтверджує їх фармацевУ тичну та біологічну еквівалентність щодо ефективності та безпечності після використання в однакових молярних дозах (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Біологічно активна добавка — речовини або їх суміші, що використовуються для надання раціону харчування спеціальних дієтичних чи лікувально-профілактичних властивостей, вміст яких не перевищує рекомендовану дозу активної речовини. Для вітамінів та мінеральних елементів допускається перевищення фізіологічної потреби не більше ніж у три рази (ГН 4.4.8.073-2001). Блок технологічний — апарат або група (з мінімальним числом) апаратів, які в заданий час можуть бути відключені (ізольовані) від технологічної системи без небезпечних змін режиму, що призводять до розвитку аварії в суміжному апараті або системі (НАОП 1.3.00-1.01-88). Валідація — дії, які відповідно до принципів належної виробничої практики доводять, що певна методика, процес, обладнання, сировина, діяльність або система дійсно дають очікувані результати (Настанова 42-01-2001). Вентиляційне повітря — повітря з відповідним ступенем очищення, що надходить до приміщення через вентиляційну систему (MB 64У-1-97). Виробнича інструкція — нормативний документ, що має статус стандарту підприємства, який регламентує певну частину виробничого процесу (MB 64У-1-97). Виробнича санітарія — система організаційних і технічних заходів для запобігання або зменшення впливу на працівників небезпечних виробничих чинників (ГОСТ 12.1.005-76). Виробнича технологічна нормативна документація — документи, що регламентують вимоги до технологічного процесу, у тому числі до допоміжних робіт і виробничого контролю. Вони включають виробничу рецептуру і технологічні інструкції (допускається їх об'єднувати в один документ — технологічний регламент або в основну виробничу інструкцію), інструкції з пакування та відповідні методики (стандартні робочі методики) (Настанова 42-01-2003). Виробниче приміщення — замкнутий простір у спеціально призначених будинках і спорудах, в яких постійно (по змінах) або періодично (протягом робочого дня) здійснюється трудова діяльність людей (ДСТ У 2293-93). Вихід очікуваний — кількість речовини (чи відсоток від теоретичного виходу), очікувана на будь-якій відповідній стадії технологічного процесу і ґрунтується на даних, отриманих раніше в лабораторії при дослідно-промисловому або промисловому виробництві (Настанова 42-02-2002). Вихід теоретичний — кількість, яка визначена на підставі кількості речовини, що використовується, і могла бути вироблена на будь-якій відповідній стадії технологічного процесу за відсут-
ності будь-яких втрат або відхилень в умовах реального технологічного процесу (Настанова 42-02-2002). Відходи виробництва — залишки сировини, матеріалів, напівпродуктів та їх похідні, що утворюються в енергетиці, промисловості, сільському господарстві, на транспорті, будівництві та інших галузях в процесах виробництва продукції, переробки сировини та проведення інших робіт, які втратили повністю або частково вихідні споживчі характеристики, а також готова продукція, не використана за основним призначенням (ДСТ У 2195-93). Відділ якості — організаційна одиниця, що є незалежною від виробництва і виконує обов'язки як із забезпечення якості, так і з контролю якості. Це можуть бути або окремі служби забезпечення та контролю якості, або одна особа чи група осіб залежно від масштабу та структури організації (Настанова 42-02-2002). Вторинна (зовнішня) упаковка — контейнер чи інша форма упаковки, в яку вміщують лікарський засіб у первинній упаковці (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 рання 2001 року). Доклінічне вивчення лікарського засобу — хімічні, фізичні, біологічні, мікробіологічні, фармакологічні, токсикологічні та інші експериментальні наукові дослідження з метою вивчення специфічної дії та безпечності лікарського засобу (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Досьє виробничої дільниці (Site Master File) — документ, що підготовлений виробником і містить спеціальну та фактичну інформацію про дотримання вимог GMP при виробництві і(або) контролі фармацевтичної продукції на даній дільниці, а також про будь-які тісно взаємопов'язані роботи в сусідніх спорудах і тих, що примикають (ГНД 09.001-98). Еубіотики — бактеріальні препарати, що регулюють діяльність мікрофлори шлунково-кишкового тракту (ГН 4.4.8.073-2001). Загальноприйнята назва лікарського засобу — міжнародна непатентована назва, рекомендована або запропонована Всесвітньою організацією охорони здоров'я (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Карантин — статус вихідної сировини, пакувальних матеріалів, проміжної, нерозфасованої чи готової продукції, ізольованої фізично або іншими ефективними засобами, поки очікується рішення про видачу дозволу на їхній випуск або про відмову в ньому (Настанова 42-01-2001). Клас чистоти повітря — ступінь чистоти повітря, який визначається кількістю частинок і життєздатних мікроорганізмів в одиниці об'єму повітря (ГНД 07.006-98). Клінічні випробування — це встановлення або підтвердження ефективності та безпечності лікарського засобу, яке проводиться у лікувально-профілактичних закладах, уповноважених на це Міністерством охорони здоров'я України за направленням Державного фармакологічного центру (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Контамінація (забруднення) — небажане внесення домішок хімічної чи мікробіологічної природи або чужорідних речовин у(на) вихідну сировину, проміжну продукцію чи готову продукцію під час технологічного процесу, відбору проб, пакування або перепакування, зберігання або транспортування (Настанова 42-02-2002). Ламінарний потік повітря — паралельні потоки повітря, які рухаються із однаковою заданою швидкістю всередині обмеженого простору (MB 64У-1-97). Листок-вкладиш в упаковці — стисла інформація, призначена для пацієнта. Розміщується на паперовому^носії і вкладається в упаковку (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Маркування — інформація на первинній (внутрішній) або вторинній (зовнішній) упаковці (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Матеріали — будь-який вид продукції, яка використовується у виробництві лікарського засобу, за винятком сировини, напівпродуктів і проміжних продуктів (MB 64У-1-97). Матеріальний баланс — співвідношення між кількістю вихідної сировини, матеріалів, напівпродуктів і проміжних продуктів, що використовуються у виробництві, та кількістю фактично одержаної готової продукції, відходів і втрат (MB 64У-1-97). Мікробне забруднення — кількість життєздатних мікроорганізмів, які містяться в одиниці об'єму повітря (ГОСТ P 50766-95). Назва лікарського засобу — визначається назвою, присвоєною лікарському засобу, і може бути придумана виробником, загальноприйнятою або науковою поряд з назвою торговельної марки або фірми-виробника (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Належна виробнича практика (НВП, GMP) — частина системи забезпечення якості, яка гарантує, що лікарські засоби виробляються та контролюються у відповідності до обов'язкових принципів, норм і правил, а також реєстраційної та ліцензійної нормативної документації (MB 64У-1-97). Напівпродукт — продукція, яка одержана підприємством-ви-робником від постачальника і пройшла одну або декілька стадій обробки (у постачальника), необхідних для виробництва готової продукції (у споживача). Напівпродукт для постачальника є готовою продукцією (MB 64У-1-97). Наркотичні засоби — включені до Переліку речовини природного чи синтетичного походження, препарати, рослини, що ста-
новлять небезпеку для здоров'я населення в разі зловживання ними (Закон України «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»). Наркотичні лікарські засоби — лікарські засоби, віднесені до наркотичних відповідно до законодавства (Закон України «Про лікарські засоби»). Номер серії — характерна комбінація цифр і(або) букв, яка специфічно ідентифікує серію (Настанова 42-01-2001). Нормативний документ — документ, який встановлює правила, загальні принципи або характеристики, що стосуються різних видів діяльності або їх результатів (ДСТ У 1.03-93). Нутрицевтики — біологічно активні добавки, що призначені для профілактики дефіциту есенціальних речовин (незамінних чинників харчування) в організмі і поділяються на дві групи — ті, що призначені для раціоналізації харчування та ті, що призначені для поповнення нутрієнтів, синтез яких в організмі послаблений з тих чи інших причин (ферментопатії, хронічні захворювання тощо) (ГН 4.4.8.073-2001). Оснащена чиста кімната (приміщення) — «чиста» кімната, будівництво якої завершено, і яка має робочі комунікації, обладнання, але не має обслуговуючого персоналу (ГНД 07.006-98). Отруйні лікарські засоби — лікарські засоби, віднесені до отруйних Міністерством охорони здоров'я України (Закон України «Про лікарські засоби»). Пакувальний матеріал — всякий матеріал, що використовують при пакуванні лікарського засобу, крім будь-якої транспортної тари для транспортування або відвантаження (Настанова 42-01-2001). Пакування — усі операції, включаючи фасування і маркування, які необхідно пройти нерозфасованій продукції, щоб стати готовою продукцією (Настанова 42-01-2001). Парафармацевтики — біологічно активні добавки, де вміст біологічно активних речовин не перевищує їх терапевтичних доз, ефект дії яких при тривалому вживанні впливає на структуру та функції ушкоджених органів (ГН 4.4.8.073-2001). Первинна (внутрішня) упаковка — ємкість або інша форма упаковки, що безпосередньо контактує з лікарським засобом (Вимоги до інформації про застосування лікарського засобу / Наказ МОЗ України № 163 від 3 травня 2001 року). Перелік наркотичний засобів, психотропних речовин і прекурсорів (Перелік) — згруповані в списки наркотичні засоби, психотропні речовини і прекурсори, включені до таблиць I—IV (Перелік наркотичних засобів, психотропних речовин і прекурсорів / Постанова Кабінету Міністрів України № 770 від 6 травня 2000 року) згідно з законодавством України та міжнародними договорами, згода на обов'язковість яких надана Верховною Радою України. Перелік затверджується Кабінетом Міністрів України за поданням спеціально уповноваженого органу виконавчої владц/ в галузі охорони здоров'я і публікується в офіційних друкованих виданнях (Закон України «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»). Переробка — повторна обробка всієї або частини серії продукції неприйнятної якості на певній стадії технологічного процесу, для того щоб її якість могла стати прийнятною за допомогою однієї або декількох додаткових операцій (Настанова 42-01-2001). Перехресна контамінація — забруднення речовини або продукції іншою сировиною або продукцією (Настанова 42-02-2002). Повітряний шлюз — це обмежений простір з двома або декількома дверима між двома або декількома приміщеннями, наприклад різних класів чистоти, який призначений для контрольованого керування потоком повітря між цими приміщеннями при відкриванні дверей. Повітряні шлюзи прййначені і використовуються для переміщення персоналу, обладнання і продукції між приміщеннями (MB 64У-1-97). Прекурсори — речовини та їх солі, що використовуються при виробництві наркотичних засобів і психотропних речовин, включених до Переліку (Закон України «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»). Проміжна продукція — частково оброблена сировина, яка має пройти наступні виробничі етапи до того, як вона стане нерозфа-сованою продукцією (Настанова 42-01-2001). Протокол серії — усі документи, які послідовно висвітлюють історію кожної серії готової продукції (виробництво, контроль і реалізацію), а також усі інші обставини, що можуть мати значення для її якості (MB 64У-1-97). Психотропні речовини — включені до Переліку речовини природного чи синтетичного походження, препарати, природні матеріали, здатні викликати стан залежності та справляти депресивний або стимулювальний вплив на центральну нервову систему або викликати порушення сприйняття, або емоцій, або мислення, або поведінки і становлять небезпеку для здоров'я населення в разі зловживання ними (Закон України «Про обіг в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів»). Радіоактивні лікарські засоби — лікарські засоби, які застосовуються в медичній практиці завдяки їх спроможності до іонізуючого випромінювання (Закон України «Про лікарські засоби»). Реєстраційна технологічна нормативна документація — документи, що є частиною реєстраційного досьє та описують технологічний процес, включаючи виробничий контроль і за необхідності (на вимогу відповідних уповноважених органів) допоміжні роботи (Настанова 42-01-2003). Реєстраційне посвідчення — документ, який видається замовнику, як дозвіл для медичного застосування лікарського засобу в Україні (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року).
Реєстраційний номер — кодова позначка, яка присвоюється лікарському засобові при державній реєстрації і зберігається за лікарським засобом незмінною на весь період перебування лікарського засобу на фармацевтичному ринку України (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ M03 України № 220 від 19 вересня 2000 року). Серія — визначена кількість вихідної сировини, пакувальних матеріалів або продукції, яка піддається обробці в одному або в низці послідовних технологічних процесів таким чином, що може розраховувати на однорідність продукції (Настанова 42-01-2001). Сильнодіючі лікарські засоби — лікарські засоби, віднесені до сильнодіючих Міністерством охорони здоров'я України (Закон України «Про лікарські засоби»). Стадія технологічного процесу — сукупність технологічних операцій, що приводить до одержання проміжної або готової продукції (на кінцевій стадії), яка може бути охарактеризована кількісно і якісно (MB 64У-1-97). Стерильність — відсутність життєздатних мікроорганізмів (MB 64У-1-97). Термін придатності лікарських засобів — час, протягом якого лікарський засіб не втрачає своєї якості за умови зберігання відповідно до вимог нормативно-технічної документації (Закон України «Про лікарські засоби»). Технічний регламент — нормативний документ, в якому визначено характеристики продукції або пов'язані з нею процеси і методи виробництва (MB 64У-1-97). Технологічна інструкція — документ, що належить до категорії виробничих інструкцій і містить відомості про порядок проведення технологічного процесу (MB 64У-1-97). Технологічна операція — операція з виконання певного виду робіт і(або) обслуговування окремих видів обладнання, яка є частиною стадії технологічного процесу (MB 64У-97). Технологічний процес (виготовлення) — усі операції, пов'язані з виготовленням лікарського засобу, які починаються з одержання сировини, продовжуються обробкою та пакуванням і завершуються одержанням готової продукції (Настанова 42-01-2003). Технологічний регламент виробництва лікарського засобу — нормативний документ, в якому визначено технологічні методи, технічні засоби, норми та нормативи виготовлення лікарського засобу (Закон України «Про лікарські засоби»). Умови зберігання лікарського засобу — умови, відповідно до яких повинен зберігатися лікарський засіб. Додатково вказують умови та термін зберігання після початку застосування долікарського засобу, що може змінювати свої властивості після порушення первинної упаковки (Вимоги до інформації про застосування лікарського засобу / Наказ M03 України № 163 від 3 травня 2001 року). Упаковка "in bulk" — будь-який лікарських засіб, який пройшов усі стадії виробництва, за винятком остаточного пакування (Порядок проведення експертизи матеріалів на лікарські засоби... / Наказ МОЗ України № 220 від 19 вересня 2000 року). Функціонуюча чиста кімната (приміщення) — «чиста» кімната в режимі нормальної роботи, яка має робочі комунікації, обладнання і персонал, який виконує звичайні робочі операції в чистій кімнаті (приміщенні) (ГНД 07.006-98). Чиста зона — зона, в якій контролюється навколишнє середовище на наявність частинок і мікроорганізмів, що контаміну-ють, побудована й експлуатується таким чином, щоб зменшити проникнення, утворення і зберігання контамінантів усередині зони (Настанова 42-01-2001). Чиста кімната (приміщення) — приміщення, в якому контролюється концентрація частинок і яке має одну фо декілька «чистих» зон (ГНД 07.006-98). Штриховий код EAN — числовий код, представлений комбінацією послідовно розташованих паралельних штрихів та проміжків між ними, розміри та розташування яких встановлені певними правилами, і присвоюється одиницям обліку (товару) відповідно до норматичвних документів національної нумерувальної організації (ДСТ У 3147-95. Коди та кодування інформації. Штрихове кодування. Маркування об'єктів ідентифікації. Форма та розташування штрихових позначок EAN на тарі та товарній продукції. Загальні вимоги). Якість лікарського засобу — сукупність властивостей, які надають лікарському засобові здатності задовольняти споживачів відповідно до свого призначення і відповідають вимогам, установленим законодавством (Закон України «Про лікарські засоби»). Зміст інших термінів тлумачиться в окремих главах, при розгляді конкретного матеріалу. Дата добавления: 2016-03-26 | Просмотры: 629 | Нарушение авторских прав |