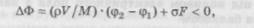|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГІДРОФОБНА ХРОМАТОГРАФІЯМетод гідрофобної хроматографії застосовують для розділення БАР на основі гідрофобних властивостей, характерних для біологічних об'єктів. В основі механізму селективності при гідрофобній хроматографії лежить виявлення так званого гідрофобного ефекту, а також модуляція електровалентних взаємодій, унаслідок зменшення локальної діелектричної сталої середовища при введенні неполярних радикалів або зниженні активності розчинника. Гідрофобна хроматографія реалізується у вигляді декількох різних процесів. Найчастіше сорбція амфільних сполук гідрофоб-
ними сорбентами здійснюється з розведених водних розчинів при низьких значеннях pH середовища (2,0—4,0), а елюація — зниженням так званої елюатропної сили рухомої фази, що досягається зміною pH, зменшенням полярності елюенту (при додаванні спиртів, детергентів та інших органічних модифікаторів). Цей вид хроматографії одержав назву зворотнофазної (ЗФХ). При введенні в розчин амфільних сполук, здатних вступати у взаємодію з менш роздільними гідрофобними компонентами, останні все ж можна розділити. Таким методом на неполярних сорбентах удається розділити навіть іонізовані сполуки, якщо додати в розчин протилежно заряджені амфільні сполуки, здатні утворювати іонні пари з досліджуваними компонентами. Цей вид хроматографії був названий іон-парною зворотнофазною хроматографією. Гідрофобна взаємодія реалізується також і при так званій ви-солювальній хроматографії (BX), яку часто називають хроматографією гідрофобних взаємодій, основний принцип якої полягає в сорбції амфільних сполук із водних розчинів при великій концентрації солей з подальшою елюацією сольовими розчинами з більш низькою іонною силою або водою. Іноді елюацію здійснюють таким способом, що одночасно зі зменшенням концентрації солі підвищують концентрацію гідрофобного витисника. Як у зво-ротнофазній, так і висолювальній хроматографії можуть використовуватися ті самі типи сорбентів із пришитими неполярними радикалами. 8.6.1. СОРБЕНТИ ДЛЯ ГІДРОФОБНОЇ ХРОМАТОГРАФІЇ При проведенні гідрофобної технології слід враховувати фізико-хімічні параметри сорбентів: пористість, питому поверхню, гідрофільні і гідрофобні властивості, хімічну стабільність, інертність, проникність. Усім цим вимогам відповідають зворот-нофазні гідрофобні сорбенти і макропористі гетерогенні полімерні сорбенти типу солоза K 30/40, K 20/40, K 10/40, КГ 8/40, гідрофобні властивості яких виражені більш слабко, ніж у зворотно-фазних сорбентів. Поверхня кремнеземних сорбентів містить велику кількість силанольних (SiOH) і силоксанових груп (Si—0—Si), a також невелику кількість домішок оксидів металів (табл. 8.2). Найбільшу хімічну однорідність мають аеросилогелі (силохроми), одержані спіканням частинок непористого високодисперсного силіцію ді-оксиду — аеросилу. Різні модифікації методів ЗФХ широко застосовують для очищення пептидів, таких, як окситоцин, ліпресин, АКРГ і його по- Таблиця 8.2 Деякі типи кремнеземних сорбентів для ЗФХ біологічно активних речовин
хідних, пептидного гормону росту — соматотропіну, пептидних антибіотиків, лейкоцитарного інтерферону, для розділення висо-комолекулярних білків (хімотрипсиногену, феритину та ін.). Використання гідрофобної хроматографії зручне і при роботі з висококонцентрованими розчинами. Так, розчин амонію сульфату в концентраціях, дещо нижчих за необхідні для висолювання білка, сприяє зв'язуванню білків із гідрофобними гелями. Висока концентрація солі знижує розчинність білків і збільшує їх здатність взаємодіяти з неполярною поверхнею сорбенту. Фракціонування зв'язаних білків часто досягається зниженням полярності елюенту (наприклад, за допомогою поліетиленгліколю).
Таблиця 8.3 При використанні Іон-парні агенти іон-парних агентів дося-
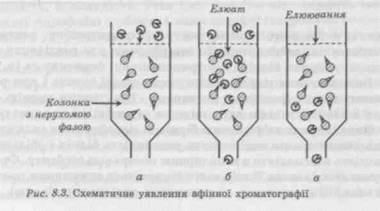
гається додаткове посилення селективності зво-ротнофазних адсорбентів при розділенні білків, олігопептидів та інших БАР. У табл. 8.3 наведений список катіонних і аніонних амфільних сполук, що використовуються як іон-парні агенти. При доборі умов розділення суміші білків при ЗФХ обов'язково враховують pH розчину, в'язкість і температуру. 8.7. АФІННА ХРОМАТОГРАФІЯ Цікавим хроматографічним методом є афінна хроматографія, заснована на нативній специфічності деяких біопо-лімерів, особливо якщо вони містяться в культуральній рідині в невеликих концентраціях — менше 1 мкг/мл. У цьому методі хороше розділення досягається за рахунок специфічної взаємодії між іммобілізованим агентом і розчиненою речовиною. Між афінною хроматографією і іншими більш традиційними методами адсорбційної або іонообмінної хроматографії існують значні відмінності. У традиційних хроматографічних методах спочатку адсорбуються всі компоненти суміші, а їх розділення здійснюється на стадії десорбції за допомогою, наприклад, заміни концентрації елюенту або концентрації солей у елюенті, або поступового підвищення pH елюенту. Навпаки, специфічність афінної хроматографії визначається в основному на стадії сорбції (рис. 8.3). Тому в афінній хроматографії через колонку доцільно
пропускати розчин суміші, яка розділяється протягом досить тривалого проміжку часу, поки не буде досягнуте насичення нерухомої фази, тому що в ній адсорбуються практично тільки сполуки, що виділяються. Таким чином, проведення розділення БАР в афінній хроматографії наближається до звичайної сорбції в нерухомому шарі аж до насичення шару адсорбенту і різко відрізняється від звичайного розділення багатокомпонентної суміші, яку вводять у колонку одноразово у вигляді концентрованого розчину. У цьому методі хороше розділення досягається за рахунок специфічної взаємодії між іммобілізованим агентом і розчиненою речовиною. Показано три стадії: уведення суміші речовин а, розділення б; елюювання, зв'язане з нерухомою фазоюкомпонента суміші в. 8.7.1. СОРБЕНТИ ДЛЯ АФІННОЇ ХРОМАТОГРАФІЇ Сорбентами для афінної хроматографії, як правило, є полімери, що використовуються для гельпроникної хроматографії після цілеспрямованої модифікації (агарози, поліакриламіди, целюлози, пористі стекла). Найважливіший параметр при модифікації вихідних матриць — об'ємна концентрація, що відповідає угрупованню^ і яке, як правило, вибирається емпірично. Другий найважливіший параметр _ стабільність нанесеного афінату в процесі сорбції — елюа-ції. Якщо афінатами є білки, наприклад, поліклональні або моно-клональні антитіла, білкові і пептидні інгібітори, то стабільність шару афінату можна підвищити, проводячи додаткову міжмолекулярну зшивку. Концентрацію зшиваючого агента (наприклад, глу-тарового альдегіду) слід вибирати з урахуванням потреби уникнути істотної зміни конформації зшитих білків, що часто призводить до втрати афінату. При виборі вихідного сорбенту доводиться приділяти увагу скороченню розмірів доступних зон у порах після введення в них протяжливих афінатів. Тому матриці для біоспецифічної хроматографії з об'ємними афінатами повинні мати діаметри пор, які перевищують у 3—5 разів суму хроматографічних діаметрів макромолекул комплексів антиген—антитіло, білок—інгібітор і т. д. При використанні білків як афінатів слід враховувати гетерогенність сорбційних центрів, зумовлену такими чинниками, як гетерогенність білків до приєднання, вплив протеаз і денатурації, зміна структури і властивостей афінатів у процесі приєднання, а також у процесі розділення. Цей чинник виявляється особливо суттєвим з погляду впливу навантаження на колонку як при сорбції, так і при виборі умов десорбції. Суть методу біоспецифічної хроматографії полягає в тому, що між одним або обмеженим числом білків-ферментів із множини
наявних у суміші, яка фракціонується, і полімерним сорбентом утворюється досить стабільний зв'язок, у результаті чого ці білки з розчину переходять на нерозчинний сорбент, що підвищує його селективність. Висока селективність біоспецифічних сорбентів забезпечується тим, що як ліганди використовуються речовини, які специфічно взаємодіють з активним центром ферменту, що виділяється. Центром зв'язування служать субстрати, що приєднуються до полімерних матриць, їх аналоги, оборотні інгібітори, коферменти, антитіла та інші речовини, так звані ліганди. Таблиця 8.4 Приклади спорідненості біологічних молекул
За своєю природою афінна хроматографія є варіантом адсорбційної хроматографії і її основних закономірностей, близьких зво-ротнофазній та іншим видам адсорбційної хроматографії. Використовуючи рівняння
можна показати, що утримування БАР відбувається тільки за умови [Р0] > KD, коли концентрація іммобілізованого афінату [Р0] більше константи дисоціації комплексу фермент—афінат, наприклад, відносне утримування Ve = VQ = 10 при [PJ = 1 ммоль/л можливо при розмірі константи дисоціації KD * 10"4 моль/л. Очевидно, що при використанні афінатів з більшою величиною KD необхідно підвищувати концентрацію іммобілізованого афінату. Навпаки, при використанні афінатів із дуже малими величинами KD можна одержати ефективно утримувальні сорбенти навіть при невеликих концентраціях афінатів.
Другим компонентом біоспецифічного сорбенту є полімерна матриця, до якої приєднується ліганд. Матрицею може бути будь-який полімер, що у тій або іншій мірі задовольняє такі вимоги: — великопористість гелевої структури; — гідрофільність, що забезпечує добру взаємодію її з водою і відсутність неспецифічного зв'язування білків з гідрофобними центрами; — відсутність в структурі заряджених груп; — здатність полімера легко активуватися певними хімічними агентами. Зазначеним вимогам відповідають: синтетичні полімери — поліакриламіди, сферони, а також великопористе скло і силікагелі. Звичайно хроматографічний процес складається з послідовно мінливих етапів сорбції, видалення несорбованих білків і елюації сорбованих ферментів. Великі перспективи відкриває використання багатоклональ-них антитіл для приготування афінних гелів. Досить 4—5 антитіл, щоб приготувати 1 л афінного гелю. Такі гелі успішно використовують для виділення із середовища культивування тваринних клітин, наприклад, гормону росту людини — самототропіну та інтерферону. Спрямований синтез біоспецифічних сорбентів і вибір режимів афінної хроматографії дозволяє домогтися таких високих ступенів очищення БАР, які недосяжні для інших хроматографічних прийомів. За одну стадію ступінь очищення може досягати 102—103 разів. 8.8. ЕЛЕКТРОФОРЕЗ
Електрофорезом називають розділення БАР завдяки різній швидкості її переміщення в електричному полі. Постійна швидкість U досягається частинкою із зарядом q, у рідкому середовищі під впливом електричного поля з напруженістю E, визначається балансом Оскільки взагалі кожний білок має свій власний, результуючий заряд, то накладення електричного поля призводить до того, що різні білки рухаються з різними швидкостями. Таким чином суміш декількох білків можна розділити на індивідуальні компо-
ненти. За допомогою зміни рН можна регулювати електрофоретичну рухомість білка. Якщо p/ окремого білка менше рН середовища, то його заряд і швидкість будуть негативними. Навпаки, білки з pI > рН рухатимуться в позитивному напрямі. Цей принцип покладений в основу одного з методів визначення pJ білків та інших речовин; у градієнті рН p/ білка дорівнює рН, при якому його електрофоретична рухомість Ue дорівнює нулю. У методі електрофорезу в потоці рідка фаза рухається перпендикулярно напряму електричного поля, що дозволяє здійснювати безперервне розділення. При електрофорезі в гелі на рух молекул БАР впливають процеси адсорбції і десорбції, а також опір дифузії. КРИСТАЛІЗАЦІЯ Процес утворення і росту кристалів із розчинів і газової фази називають кристалізацією. Зазвичай речовини мають кристалічні ґратки строго визначеної конфігурації, за винятком поліморфних речовин. Ряд речовин утворюють кристалогідрати, причому кількість включених молекул води залежить від температури. Для утворення кристалів із розчинів необхідне пересичення, зумовлене різницею вихідної концентрації ап і рівноважної концентрації насичення (граничної розчинності Ап). Кристалізація відбувається, коли перехід речовини з рідкого у твердий стан супроводжується зменшенням вільної енергії системи Ф, тобто:
де p — густина зародка кристала; V і F — його об'єм і поверхня; M — його молекулярна маса; ф2 і фх — хімічні потенціали вихідної і нової фаз; а — міжфазний поверхневий натяг. Для одержання крупнокристалічного порошку кристалізацію ведуть при малому пересиченні, у розчин уводять кристали для затравки, дрібні кристали видаляютьу процесі кристалізації, кристалічний продукт повторно обробляють у насиченому розчині (при цьому дрібні кристали розчиняються), уводять у розчин сторонні домішки, підвищують температуру (обмежено). Методи кристалізації: випарювання розчинника (ізотермічний), охолодження гарячих розчинів (ізогідричний), одночасне охолодження і випарювання (комбінований), додавання в розчин інших речовин, які знімають розчинність (висолювання), виморожування. Схеми кристалізації: одноразова (з повним поверненням маточного розчину і періодично повним зливанням, із частковим його поверненням, із частковим поверненням після додаткового упарювання і кристалізації); дворазова з такими ж маніпуляціями маточним розчином, причому на злив подають маточний розчин після першого кристалізатора, а після другого — насичений маточний розчин повертають у перший кристалізатор. У фармацевтичній промисловості кристалізацією виділяють тверді речовини з їх розчинів, розділяють суміші речовин на фракції та очищають їх від домішок. Для дуже глибокого очищення термолабільних речовин слід було б використовувати зонну плавку, для розділення евтектичних розплавів або речовин з низькими коефіцієнтами розподілу — екстракційну кристалізацію. При розділенні евтектичних і азеотропних розплавів доцільно поєднати процеси кристалізації і ректифікації. Дата добавления: 2016-03-26 | Просмотры: 745 | Нарушение авторских прав |