|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
МЕТОДИ КОНТРОЛЮ ЯКОСТІ ПАРЕНТЕРАЛЬНИХ ЛІКАРСЬКИХ ЗАСОБІВРідкі лікарські засоби для парентерального застосування зазвичай контролюють за такими показниками якості: опис, ідентифікація, прозорість, кольоровість, pH, супровідні домішки, об'єм, що витягається, стерильність, пірогени або бактеріальні ендотоксини, аномальна токсичність, механічні включення, кількісне визначення антимікробні консерванти. Для рідких лікарських засобів для парентерального застосування у вигляді в'язких рідин додатково контролюють густину. Для рідких лікарських засобів для парентерального застосування у вигляді суспензій додатково контролюють розмір частинок, однорідність вмісту (на випадок суспензій в одноразових контейнерах), стійкість суспензій.
У порошках для ін'єкцій або внутрішньовенних інфузій додатково контролюють такі показники якості: час розчинення, втрату за масою при висушуванні або воду, однорідність вмісту або однорідність маси. Для проведення випробувань «Прозорість», «Кольоровість», «рН» при контролі порошків для ін'єкційних або внутрішньовенних інфузійних лікарських засобів використовують розчин лікарського засобу в тому розчиннику і в тій концентрації, які зазначені в інструкції для застосування, якщо немає інших зазначень в окремій статті. Прозорість. Розчини мають бути прозорими ДФУ (вид. I, п. 2.2.1) у порівнянні з водою P або відповідним розчинником, якщо немає інших зазначень в окремій статті. Кольоровість. Забарвлення лікарських засобів для парентерального застосування визначають шляхом порівняння з еталонами відповідно до вимог статті «Визначення ступеня забарвлення рідин» ДФУ (вид. I, п. 2.2.2) або до зазначень окремої статті. Об'єм, що витягається. Визначення проводять відповідно до вимог статті «Об'єм, що витягається» ДФУ (вид. I, п. 2.9.17). Однорідність вмісту. Порошки для ін'єкційних або внутрішньовенних інфузійних лікарських засобів, а також однодозові суспензії для ін'єкцій мають відповідати вимогам статті «Однорідність вмісту діючої речовини в одиниці дозованого лікарського засобу» ДФУ (вид. I, п. 2.9.6), якщо немає інших зазначень в окремій статті. Стерильність. Випробування на стерильність проводять використовуючи метод мембранної фільтрації або метод прямого висівання (ДФУ, п. 2.6.1) Пірогени. Випробуванню на наявність пірогенів мають підлягати всі лікарські засоби для парентерального застосування незалежно від дози, об'єму і шляхів введення, використовуваних у клініці. Випробування на наявність пірогенів проводять відповідно до вимог статті «Пірогени» ДФУ (вид. I, п. 2.6.8) або «Бактеріальні ендотоксини» ДФУ (вид. I, п. 2.6.14). Якщо зазначено випробування на бактеріальні ендотоксини, то випробовування на пірогени не проводять, якщо відсутні інші зазначення в окремій статті. Аномальна токсичність. Випробування на аномальну токсичність проводять відповідно до вимог статті «Аномальна токсичність» ДФУ (вид. I, п. 2.6.9). Механічні включення. Випробування проводять відповідно до вимог статті «Механічні включення» ДФУ (вид. I, п. 2.9.19— 2.9.21). Для більш об'єктивної оцінки якості розчину за цим параметром були розроблені інші методи:
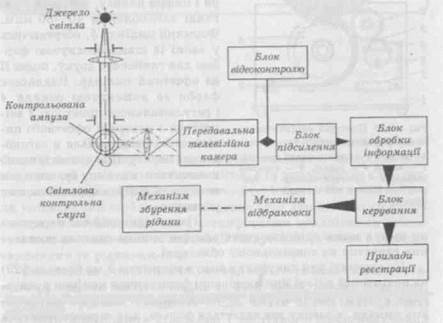
— візуально-оптичний, побудований на використанні проекторів, збільшувальних лінз, поляризаційного світла і т.д.; — оптичний, з автоматичною реєстрацією фотоелементами поглинання або розсіювання прохідного світла; — мембрано-мікроскопічний; — проточний (рис. 19.24). Рис. 19.24. Будова установки для об'єктивного контролю чистоти розчину в ампулах (схема) Стійкість суспензії та інші показники. Суспензії для парентерального застосування після струшування до одержання однорідної суспензії мають зберігати однорідність не менше 5 хв, якщо немає інших зазначень в окремій статті. Суспензія має вільно проходити в шприц крізь голку № 0840, якщо немає інших зазначень в окремій статті. Розмір частинок для суспензій котролюють за методиками, зазначеними в окремій статті. Кількісне визначення. Вміст визначуваних речовин в рідких лікарських засобах для парентерального застосування виражають у грамах або міліграмах в 1 мл препарату, якщо немає інших зазначень в окремій статті. Вміст визначуваних речовин у порошках для ін'єкцій або внутрішньовенних інфузій в однодозових контейнерах виражають у грамах, міліграмах або одиницях дії (ОД) в одній дозі, якщо немає інших зазначень в окремій статті. Після отримання задовільних результатів контролю контейнери з ПЛЗ маркують і упаковують.
Нанесення напису на ампули роблять на напівавтоматі (рис. 19.25.). У бункер 7 завантажують ампули і барабаном подачі 8 направляють до офсетного циліндра, на якому нанесені літери і цифри напису, втиснені у вигляді заглиблення 40—50 мкм. Формний циліндр 5, обертаючись у ванні із швидкосохнучою фарбою для глибокого друку, подає її на офсетний циліндр. Надлишок фарби за допомогоюракеля 4 і регулювального пристрою 2 знімається з поверхні офсетного циліндра 6 і залишається в заглибленнях напису. При контакті напис наноситься на ампулу, швидко висихає; й ампули передаються на упаковку. На сьогоднішній час маркування ампул може здійснюватись використанням самонаклеюваль-них етикеток на спеціальному обладнані. На автоматі для пакування ампул місткістю 5 мл (модель 529) на полімерній плівці при нагріванні формуються комірки пуансонами і стиснутим повітрям. 3 живильника в комірки потрапляють ампули, а зверху накладається фольга, яка термосклеюється під дією преса. 3 загальної стрічки вирізаються готові упаковки; вони надходять у нагромаджувач. На автоматі для пакування ампул місткістю 1 мл (модель 570) відбувається одночасно упаковування і маркування. Плівка поліхлорвінілу розм'якшується нагрівником, комірка формується вакуумом при одночасному маркуванні ампул, які завантажуються в комірки, і відбувається термосклеювання з верхнім покривним матеріалом. На упаковку гарячим тисненням наноситься серія, термін придатності препарату; готова упаковка вирізається і потрапляє в нагромаджувачі. Є автомати для пакування ампул у картонні коробки по 10 штук. Безперечно, що промислове виробництво парентеральних лікарських засобів є дуже перспективним, а наукові дослідження, спрямовані на створення нових препаратів і розробку сучасних технологій та виробничого устаткування, мають актуальне значення. Серед різноманітного асортименту лікувальних засобів, які використовує сучасна наукова медицина, лікарські форми для очей посідають особливе місце, а їх виробництво є предметом окремого розділу фармацевтичної технології. Це пояснюється як унікальними особливостями органа зору людини (своєрідність будови і властивостей), так і специфічними механізмами всмоктування, розподілення та взаємодії лікарських речовин з різними тканинами та рідинами ока. Вразливість очних тканин, велика кількість захворювань органів зору людини (абсцеси повіки та очної ямки, аніома, блефарит, глаукома, трахома, катаракта і ціла низка інших захворювань) зумовили необхідність створення і постійного вдосконалювання препаратів, які застосовують в офтальмологічній практиці. Не менш важливим є завдання створення простої, зручної, естетичної, інформативної та економічно-рентабельної упаковки очних лікарських засобів, яка дозволить упродовж тривалого часу зберігати їх у стерильному й хімічно незмінному стані, а в момент використання забезпечувати швидкість і простоту введення. Дата добавления: 2016-03-26 | Просмотры: 783 | Нарушение авторских прав |