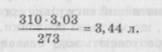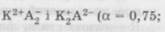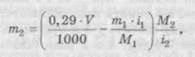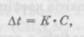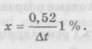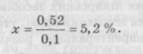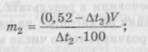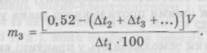|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Методи видалення пірогенних речовинІснують три основні методи депірогенізації, а саме: — хімічні; — ензиматичні; — фізичні. Хімічні методи видалення пірогенів ґрунтуються на використанні хімічних речовин, таких як: водню пероксид, натрію гіпо-хлорид, калію перманганат, розчини 0,1 моль/л натрію гідроксиду або кислоти хлороводневої. Розчини, що містять пірогени, нагрівають при 100 °С протягом 2 год із добавкою 0,1 моль водню перекису або при температурі 116 °С протягом 20 хв із добавкою 0,04 моль водню пероксиду. Для видалення пірогенів пропонується також обробляти розчини я-хіноном і антрахіноном, що утворюють із пірогенами комплексні сполуки. Для знищення пірогенних речовин можна використовувати підігрів розчину для ін'єкцій з розчином 0,1 моль/л натрію гідроксиду або розчином 0,1 моль/л кислоти хлороводневої (при pH = 4,0) протягом 1 год. При цьому відбувається гідролітичне розщеплення пірогенів з утворенням моносахаридів, які не мають пірогенних властивостей. Витрата кислоти і лугу при цьому дуже велика, через це цей метод не вважається економічно доцільним. Крім того, завдяки можливій взаємодії компонентів хімічний і ензиматичний методи малоприйнятні для промислового виготовлення розчинів для ін'єкцій. Фізичні методи. Фізичні методи ґрунтуються на явищі адсорбції пірогенів вугіллям активованим, каоліном, азбестом, целюлозою тощо. Кількість пірогенних речовин зменшується після обробки вугіллям активованим при струшуванні протягом 15 хв, при цьому ефективність очищення залежить від природи пірогенних речовин. Гранульоване вугілля менш ефективне. Вугілля, застосоване для очищення розчинів, має бути дуже ретельно очищеним, добре промитим водою, не містити пірогенів і висушеним при температурі 250 °С протягом 2 год. Однак обробка розчинів вугіллям активованим не завжди приводить до повної депірогенізації. Крім того, цей метод не можна застосовувати для очищення розчинів лікарських речовин, які легко адсорбуються вугіллям
(наприклад солей алкалоїдів), або тих, які легко окиснюються (кислота аскорбінова). Ряд авторів рекомендують для очищення від пірогенів використовувати іонообмінні смоли (наприклад для амінокислот), вважаючи, що вони більш ефективні, ніж вугілля активоване. Депіроге-нізацію води можна здійснити фільтруванням через бактеріальний фільтр Зейтца. Рекомендується, щоб діаметр пор фільтра Зейтца не перевищував 2,4 мкм. Фільтр Зейтца затримує пірогенні речовини з розчину на 99,5 %, навіть коли вони знаходяться в значній кількості. Обробка розчину вугіллям активованим із подальшим фільтруванням через фільтр Зейтца забезпечує найбільш повне видалення пірогенних речовин. Для видалення пірогенних речовин із розчинів амінокислот, які застосовують для внутрішньовенного вливання, їх стерилізація проводиться при температурі 120 °С протягом 2—3 год в атмосфері азоту. До фізичних методів видалення пірогенів із розчинів слід віднести знищення їх за допомогою ультразвуку з частотою 2 МГц і інтенсивністю 2 Вт/см2 протягом 10 хв. При цьому досягається повна руйнація пірогенних речовин. Державним науковим центром лікарських засобів разом із відділом біохімічних методів очищення води HAH України (Ф. A. Ko-нєв, T. П. Скубко, П. I. Гвоздяк) запропонований оригінальний фільтр для одержання апірогенної води. Дія фільтра побудована на затриманні мікроорганізмів діелектричними матеріалами в електричному полі, силові лінії якого спрямовані перпендикулярно до руху потоку стерилізованої рідини. Термін використання води для ін'єкцій регламентується 24 годинами з часу одержання і за умови її зберігання в закритих збірниках. При більш тривалому зберіганні вода може поглинати з повітря вуглекислий газ і кисень, може взаємодіяти з матеріалом використаної посудини, викликаючи перехід іонів важких металів, і є середовищем для розмножування мікроорганізмів. Тому найкращим є використання свіжоприготовленої води, яку іноді безпосередньо після дистиляції кип'ятять протягом 30 хв. Більш надійне зберігання гарантується спеціальними системами, виконаними з інертного матеріалу, в яких вода має знаходитися при високій температурі й у постійному русі для уникнення забруднення мікроорганізмами і пірогенами. 19.7.3. НЕВОДНІ РОЗЧИННИКИ Для приготування ін'єкційних лікарських форм, крім води для ін'єкцій, використовують також неводні розчинники. Застосування цих розчинників дозволяє одержати розчини з не- розчинних або важкорозчинних у воді речовин, усунути гідроліз, одержати розчини лікарських речовин пролонгованої дії. Неводні розчинники мають різну розчинювальну здатність, антигідроліз-ні, стабілізувальні і бактерицидні властивості. Однак багато з них не можуть бути використані для одержання стерильних розчинів унаслідок фармакологічної активності, токсичності, іноді гемолітичної дії. У зв'язку з цим до неводних розчинників висуваються такі вимоги: вони не повинні мати гостру і хронічну токсичність, викликати місцеву подразливу дію; повинні мати високу розчинювальну здатність із лікарськими речовинами; бути хімічно і біологічно сумісними; стійкими при стерилізації; мати низьку в'язкість. Крім того, температура кипіння має бути не більше 100 °С, температура замерзання — не вище 5 °С. За хімічними властивостями неводні розчинники діляться на декілька груп: жирні олії, одноатомні і багатоатомні спирти, ете-ри й естери, аміди, сульфони і сульфоксиди. Для приготування ін'єкційних розчинів застосовуються неводні розчинники, як індивідуальні, так і змішані: водно-гліцеринові, водно-пропіленові, спирто-водно-гліцеринові та ін. Дуже широко застосовуються суміші жирних олій із бензил-бензоатом, етилолеатом. Змішані розчинники мають більшу розчинювальну здатність, ніж кожен розчинник окремо. Таке явище називається співрозчиненням, а розчинники — співрозчинника-ми. Нині співрозчинники широко використовуються для одержання ін'єкційних розчинів важкорозчинних речовин. Неводні розчинники застосовуються для приготування ін'єкційних лікарських форм, що містять гормони, вітаміни, антибіотики, камфору, барбітурати, сірку, солі меркурію та ін. Олії рослинні. Олії рослинні є неводними розчинниками, застосовуваними для приготування ін'єкційних препаратів, і після води — найпоширенішими розчинниками. Рослинні олії — це естери ненасичених жирних кислот, суміші фосфатидів, вільних жирних кислот та інших речовин. Жирна олія містить ліпази, які при наявності найменшої кількості води викликають омилення масел з утворенням вільних жирних кислот, тому масла повинні бути цілком зневоднені. Продукти, що утворюються, можуть взаємодіяти з багатьма лікарськими і допоміжними речовинами, змінюючи їхні властивості, крім того, кислі олії подразнюють нервові закінчення і можуть викликати больові відчуття. Це прозорі, слабко забарвлені маслянисті рідини, малов'язкі, без запаху або зі слабким запахом, нерозчинні у воді, малорозчинні в спирті, легкорозчинні в ефірі, хлороформі, петролейному етері. Олії для стерильних розчинів повинні бути отримані методом холодного пресування зі свіжого насіння.
При аналізі жирних олій визначають їх колір, смак, запах, розчинність і числові показники. Жирні олії не повинні містити білків і мінеральних домішок, мати кислотне число не більше 2,5; вміст мила в них повинен складати не більше 0,001 % і т. д. До вад масляних розчинів слід віднести їх відносно високу в'язкість, болісність ін'єкцій, погане розсмоктування і можливість утворення гранулем на місці введення. Для зменшення в'язкості в деяких випадках додають етиловий або етилгліколевий етер. Розчинність деяких речовин в оліях збільшують додаванням спів-розчинників або солюбілізаторів (бензилового спирту, бензил-бензоату), які одночасно підвищують і стабільність масляних розчинів. В основному жирні олії застосовують для внутрішньом'язових ін'єкцій і досить рідко — для підшкірних. Найбільш широко використовуються олії персикова, мигдалева, маслинова, соняшникова, соєва та ін. Вони мають бути рафінованими й дезодорованими. Персикова олія використовується для приготування ін'єкційних розчинів вітамінів (ергокальциферолу, ретинолу ацетату), гормонів (прогестерону, сінестролу, тестостерону пропіонату тощо), камфори, кризанолу, а також суспензій (бійохінолу). Менш поширеною є олія маслинова і застосовується для виготовлення 2 % -вого розчину сінестролу. Усі олії, призначені для приготування ін'єкційних розчинів, необхідно піддавати попередній стерилізації при температурі 120 °С протягом 2 год. Спирти одно- і багатоатомні. Одноатомні і багатоатомні спирти застосовуються як неводні розчинники в багатьох країнах світу. Вони змішуються з водою, менш в'язкі, ніж олії, і здатні розчиняти багато лікарських субстанцій. 3 одноатомних спиртів найбільшого поширення набув спирт етиловий, із багатоатомних — пропіленгліколь, гліцерин і полі-етиленгліколь. Спирт етиловий при підшкірному введенні викликає біль, а потім анестезію; крім того, він має власну фармакологічну дію, тому й не може застосовуватися в нерозведеному стані. Через добру розчинність у ньому різних органічних речовин спирт етиловий часто застосовується як компонент багатьох розчинів для ін'єкцій. Як співрозчинник в суміші з водою він застосовується для одержання ін'єкційних розчинів гідрокортизону, низки серцевих препаратів: дигітоксину (50 % спирту), мефеназину (25 % спирту), дигоксину (10 % спирту) і т. ін. Спирт етиловий використовується як співрозчинник і консервант 2—30 %-вої концентрації при виготовленні розчинів серцевих глікозидів: конвалатоксину, целаніду, еризиміну і строфан- тину K. Спирт етиловий включений до складу змішаних розчинників (використовуваних для приготування ін'єкційних розчинів) у Міжнародну фармакопею (вид. 2) і фармакопеї ряду закордонних країн. Спирт етиловий може застосовуватися як так званий проміжний розчинник. Цей технологічний прийом використовується для приготування розчинів деяких протипухлинних препаратів, нерозчинних ні у воді, ні в оліях. 3 цією метою препарати розчиняють у мінімальній кількості спирту етилового, змішують із олією маслиновою (утворюється емульсія), потім спирт відганяється під вакуумом і утворюється масляний розчин. При виготовленні деяких розчинів для ін'єкцій використовується спирт бензиловий 1—10 %-вий як співрозчинник. 3 цією ж метою в технології ін'єкційних розчинів використовується і пропіленгліколь (у суміші з водою і додаванням спирту етилового або бензилового). Він є добрим розчинником для сульфаніламідів, барбітуратів, антибіотиків та інших лікарських речовин. Його використовують при одержанні мікрокристалічної суспензії гідрокортизону ацетату 2,5 %-вого. Як солюбілізатор і стабілізатор рекомендований спирт полівініловий для одержання деяких водних суспензій. Пропіленгліколь (пропандіол-1,2) — прозора, безбарвна в'язка рідина, що поглинає вологу з повітря. Пропіленгліколь є добрим розчинником для сульфамідів, барбітуратів, вітамінів А і D, антибіотиків, анестезину, алкалоїдів у формі основ і багатьох інших лікарських речовин. Пропіленгліколь як розчинник самостійно застосовується обмежено, наприклад, у препаратах хінідину. Найчастіше використовують у вигляді 40—70 % -вих водних розчинів, а також у суміші з іншими співрозчинниками (спиртом етиловим, етаноламіном, поліетиленгліколями). Розчини, що містять до 50 % пропіленгліколю, використовуються для внутрішньовенних, понад 50 % — для внутрішньом'язових ін'єкцій. Пропіленгліколь сприяє пролонгуванню дії ряду лікарських препаратів. Гліцерин — прозора в'язка рідина з високою температурою кипіння, змішується з водою і спиртом. Він має високу гігроскопічність і може вбирати до 40 % води. Гліцерин у концентрації до 30 % використовується як співрозчинник в сумішах з водою або спиртом етиловим. В ін'єкційних препаратах вітчизняного виробництва 10 %-вий гліцерин застосовується як співрозчинник у розчинах целаніду, віпраксину, мезатону, фетанолу, дибазолу.
Для одержання розчинів лікарських речовин, що легко гідролізуються, запропонований сорбіт і маніт 60 %-вої концентрації У воді. Поліетиленгліколі (ПЕГ), які одержуються поліконденсацією етиленоксиду і етиленгліколю, відповідають загальній формулі: Н—(ОСН2—СН2)п—ОН, де n може змінюватися від 2 до 85 і вище. ПЕГ розрізняються за середньою молекулярною масою. ПЕГ 200, 300, 400, 600 в'язкі, безбарвні, прозорі, помірно гігроскопічні рідини зі слабким характерним запахом. Вони нейтральні, фізіологічно індиферентні, розчинні у воді і спирті, стійкі при зберіганні і не піддаються гідролізу. Як розчинники для парентеральних препаратів застосовуються низькомолекулярні поліконденсати, що знаходяться за нормальних умов у рідкому стані. Найчастіше використовується полі-етиленоксид ПЕО 400 як добрий розчинник сульфаніламідів, анестезину, камфори, бензойної і саліцилової кислот, фенобарбіталу. Запропоновано також спосіб приготування розчинів антибіотиків у стерильному розчині ПЕО 400. ПЕО використовується для одержання розчинів для ін'єкцій похідних сарколізину, що мають виражену протипухлинну активність. ПЕГ здатні розчиняти.багато лікарських речовин. У концентрації до 70 % застосовуються для внутрішньом'язових і внутрішньовенних ін'єкцій. Внутрішньом'язове введення їх легко переноситься, і розчинники виводяться з організму хворого протягом 24 год, причому 77 % видаляється упродовж 12 год. ПЕГ 200 пропонується використовувати для приготування розчинів ванкоміцину, фенобарбіталу, натрію аскорбінату. ПЕГ 400 використовується в препаратах дигоксин, біоміцин, левоміцетин, пеніцилін та ін. Прості і складні етери. Етери і естери є менш в'язкими, ніж олії, і мають добру розчинювальну здатність, найчастіше використовуються при приготуванні ін'єкційних розчинів. До них належать етилові естери олеїнової, лінолевої, ліноленової кислот, октиловий естер левуленової кислоти та ін. Бензилбензоат. Бензилбензоат (бензиловий естер бензойної кислоти) — безбарвна масляниста рідина, практично нерозчинний у воді, змішується із спиртом етиловим. Значно збільшує розчинність в оліях важкорозчинних речовин із класу стероїдних гормонів. Крім того, бензилбензоат запобігає кристалізації речовин із масел у процесі зберігання. Суміші бензилбензоату з олією персиковою (10—50 %) не виявляють токсичної дії. Глікофурол — поліетиленгліколевий естер тетрагідрофурфу-рилового спирту. Безбарвна рідина, розчинний в метанолі, етанолі і гліцерині; змішується з водою в будь-якому співвідношенні. Використовують глікофурол у розчині ацетилхоліну і роніколу. Ізопропілміристат як розчинник складається з ізопропілмі-ристату і ізопропілових естерів інших насичених кислот. Він використовується як індиферентна основа при введенні естрогенів. Етилолеат — синтетичний естер. Це продукт естерифікації кислоти олеїнової спиртом етиловим. Ясно-жовта масляниста рідина, нерозчинний у воді; змішується зі спиртом, ефіром, оліями. Вживання етилолеату замість олій дає можливість виключити ряд технологічних операцій у процесі приготування розчинів: попереднє зневоднювання олій і їх стерилізацію, а також спростити операції фільтрації й ампулування. Він має ряд переваг у порівнянні з оліями: змішується зі спиртом, ефіром, не викликає побічних явищ, має постійний хімічний склад і меншу в'язкість (так, в'язкість олії маслинової при температурі 20 °С дорівнює 8,03 сПа • c, в'язкість етилолеату при тій же температурі — 0,62), а також більшу стабільність при тепловій стерилізації (150°С протягом 1 год). Завдяки меншій у порівнянні з рослинними оліями в'язкості етилолеат швидше адсорбується тканинами, є більш зручним розчинником. Етилолеат добре розчинює кислоту саліцилову, анестезин, пеніцилін, низку інших антибіотиків, холестерин, вітаміни, стероїдні гормони, камфору та ін. Установлено, що при внутрішньом'язо-вому введенні препарату на етилолеаті на відміну від рослинних олій спостерігається його швидке й повне розсмоктування. Однак наявність подвійного зв'язку в хімічній будові етилолеату сприяє його швидкому окисненню. Для запобігання цього процесу запропоновано додавати до нього антиоксиданти (а-токо-ферол, бутилокситолуен та інші) і проводити стерилізацію в атмосфері інертного газу. Як розчинник для ін'єкцій етилолеат включений у Міжнародну фармакопею (вид. 2), за якою дозволяється використовувати етилолеат замість рослинної олії. Етилолеат вживається також як добавка до масляних розчинів для збільшення розчинності і зниження їхньої в'язкості. Діоксани й діоксолани — це продукти взаємодії гліцерину з карбонільними сполуками в присутності дегідратуючого агента. Найменш токсичний представник цієї групи 2,2-диметил-4-мета-нол-1,3-діоксолан. Ця сполука відома під назвою солькеталь, глі-церол-диметилкеталь та ін. Солькеталь — безбарвна рідина, стабільна при зберіганні, стійка до дії лугів, змішується з водою, спиртом й іншими органічними розчинниками. У присутності розчинів сильних кислот гідролізується з утворенням ацетону і гліцерину.
Сполука відносно нешкідлива, не подразнює оболонки і тканини. Солькеталь використовується при виробництві парентеральних розчинів тетрацикліну. Гліцероформаль — продукт конденсації гліцерину з формальдегідом і сумішшю 25 % 3-окси-метил-1,3-діоксолану і 75 % 5-ок-сидіоксолану. Гліцероформаль — безбарвна речовина з невисокою в'язкістю, необмежено змішується з водою, малотоксичний. Аміди. Розчинники, що належать до групи амідів, у препаратах для ін'єкцій використовуються в концентрації від 5 до 50 %, часто в сполученні з пропіленгліколем, етаноламіном. №,№-диметилацетамід — прозора нейтральна рідина з температурою кипіння 165,5 °С і густиною 0,493. Для приготування ін'єкційних розчинів левоміцетину, окситетрацикліну, тетрацикліну використовують 50 % -вий водний розчин диметилацетаміду. Він має протизапальну дію. N-Ь-оксіетиллактамід карбоксамід кислоти молочної — безбарвна прозора сиропоподібна рідина, змішується з водою. Вживається у вигляді 50 %-вих водних розчинів, має стабільність, не подразнює тканини. Використовується в ін'єкційних розчинах тетрацикліну, причому дія препарату пролонгується на добу. Сульфоксиди і сульфони. Серед розчинників класу сульфоксидів і сульфонів найбільш цікавий диметилсульфоксид і сульфо-лан, для яких характерна висока розчинювальна здатність. Вони мають незначну токсичність, змішуються з багатьма розчинниками. Пропонуються для приготування багатьох ін'єкційних препаратів. Диметилсульфоксид дуже гігроскопічна рідина; при 20 °С вбирає близько 70 % води, малотоксичний. Сульфолан — тетрагідротіофен-1,1-діоксид, тетраметилен-сульфон висококиплячий органічний розчинник із великою діелектричною проникністю. 19.8. ПРИГОТУВАННЯ РОЗЧИНІВ ДЛЯ ІН'ЄКЦІЙ Технологія ін'єкційних препаратів — це складне багатостадійне виробництво, що включає як основні, так і допоміжні процеси. Виготовлення розчинів для ін'єкцій проводять у спеціальних приміщеннях А або C класу чистоти з дотриманням усіх правил асептики. Приготування водних або нев'язких розчинів для ін'єкцій проводять масооб'ємним методом, із використанням реакторів, що герметично закриваються і оснащені оболонкою і перемі-шувальним пристроєм. У тих випадках, коли густина розчинника значно відрізняється від густини води, використовують масовий метод, при якому і лікарську речовину, і розчинник беруть за масою. Розчинення повільно- або важкорозчинних лікарських речовин проводять при нагріванні і перемішуванні. Стадія приготування розчину включає такі операції: розчинення, ізотонування, стабілізацію, уведення консервантів, фільтрування. Залежно від властивостей лікарських речовин деякі з операцій можуть бути виключені, наприклад ізотонування, стабілізація, уведення консервантів. 19.8.1. ІЗОТОНУВАННЯ ІН'ЄКЦІЙНИХ РОЗЧИНІВ Серед ін'єкційних розчинів особливу групу складають ізотонічні, під якими розуміють розчини з осмотичним тиском, рівним осмотичному тискові рідин організму (плазми крові, лімфи, спинномозкової рідини і т. д.). Осмотичний тиск розчинів є наслідком теплового руху молекул розчиненої речовини, що прагне зайняти якомога більший об'єм. Він в організмі підтримується на постійному рівні дією саморегуляторів. Осмотичний тиск плазми крові в нормі тримається на рівні 725,2 кПа, або 7,4 атм. Розчини з меншим осмотичним тиском називаються гіпотонічними, з великим — гіпертонічними. При введенні великої кількості розчинів у вигляді внутрішньо-судинних ін'єкцій осмотичний тиск рідин організму порушується. Пояснюється це тим, що клітинні оболонки, маючи властивість напівпроникності, пропускають воду і заважають проникненню багатьох розчинених у ній речовин. У зв'язку з цим, якщо клітина ззовні оточена розчином з іншим осмотичним тиском, ніж тиск усередині клітини, то відбувається рух води в клітину або з клітини до вирівнювання концентрації, тобто спостерігається явище осмосу. При введенні в кров гіпертонічного розчину (P н > P е ині клітини^ — вода виходить із клітини. Вона зводнюється, і наступає явище плазмолізу, при якому еритроцити зморщуються. При введенні гіпотонічного розчину (P < P:.,.) с " ^ J v р-ну усередині клітини' рідина надходить усередину клітини до моменту вирівнювання концентрації. Клітина розбухає, клітинна оболонка при цьому може лопнути, а клітина загинути. Це явище називають лізис, а для еритроцитів — гемоліз. Крім того, внутрішньом'язове і підшкірне введення неізотоно-ваних розчинів викликає біль, причому він тим сильніший, чим різкіша осмотична різниця. Тому при внутрішньосудинному застосуванні деяких ін'єкційних розчинів необхідне їх ізотонування.
Ізотонічні концентрації лікарських речовин у розчинах можна розрахувати такими методами: — метод, побудований за законом Вант-Гоффа; — кріоскопічний метод, побудований за законом Рауля; — метод еквівалентів лікарських речовин за натрієм хлориду. За кордоном користуються також графічним методом розрахунку ізотонічних концентрацій, що дозволяють за розробленими номограмами швидко, але з деякою наближеністю визначити кількість натрію хлориду, необхідну для ізотонування розчину лікарської речовини. Метод, побудований за законом Вант-Гоффа. Відомо, що 1 моль будь-якої недисоціюючої речовини займає у водному розчині при 0°С і тискові 101,3 кПа (760 мм. рт. ст.) 22,4 л. Тобто розчин, який містить в об'ємі 22,4 л 1 моль розчиненої недисоціюючої речовини при 0 °С, має осмотичний тиск 98 кПа. Для того щоб у такому розчині осмотичний тиск підняти до тиску кров'яної плазми (7,4 атм), необхідно замість 1 моль недисоціюючої речовини розчинити 7,4 моль;або 1 моль цієї ж речовини розчинити у відповідно меншій кількості води: 22,4/7,4 = 3,03 л. В отриманий результат необхідно внести поправку, тому що він правильний лише для 0 °С (або 273 K за школою абсолютної температури), а температура тіла складає 37 °С (або 310 K). Тому 1 моль речовини слід розчиняти не в 3,03 л, а в дещо більшій кількості води:
Кількість молей речовини за цих умов буде складати в 1 л розчину 1: 3,44 = 0,29. Інакше кажучи, щоб приготувати 1 л ізотонічного розчину, необхідно взяти 0,29 моль лікарської речовини (не-електроліту) і, розчинивши у воді, довести об'єм розчину до 1 л: m - 0,29M, або 0,29 - m/M, де m — кількість речовини, необхідна для приготування 1 л ізотонічного розчину, г; 0,29 — чинник ізотонії речовини-неелектроліту; M — молекулярна маса цієї лікарської речовини. Користуючись цією формулою, можна розрахувати ізотонічні концентрації розчинів. Наприклад: глюкози С6Н1206 — 0,29-180=52,2 г/л, або 5,22 %; гексаметилентетраміну (CH2)6N4 — 0,29 • 140=40,6 г/л, або 4,06 %. Чинник ізотонії простіше виводиться з рівняння Клапейрона—Менделєєва: PV = nRT, де P — осмотичний тиск кров'яної плазми, атм; V — об'єм розчину, л: n — число молей розчиненої речовини; R — газова стала, виражена для цього випадку в атмосферо- літрах, рівна 0,082; T — абсолютна температура, K. Звідси: n - PV/RT = (7,4 • l)/(0,082 • 310) = 0,29. Наведені розрахунки достовірні, якщо їх проводять для не-електролітів, тобто для речовин, що не розпадаються при розчиненні на іони. Для електролітів потрібно враховувати, що вони дисоціюють у водних розчинах, і їхній осмотичний тиск буде тим більшим, чим вищий ступінь дисоціації. Наприклад, речовина в розчині дисоційована на 100 % NaCl = Na+ + C1". У цьому разі число елементарних частинок, що чинять тиск, збільшується вдвічі. Якщо розчин натрію хлориду містить у 1 л 0,29 моль NaCl, то він має осмотичний тиск не 7,4 атм, а в 2 рази більше. Отже, чинник ізотонічності 0,29 до електролітів не застосовується. Він має бути зменшеним від ступеня дисоціації. Для цього в рівняння Клапейрона—Менделєєва вводиться коефіцієнт ізотонічності (і), який показує, у скільки разів збільшується число частинок унаслідок дисоціації. Таким чином, це рівняння приймає вигляд: PV = nRTi; n = PV/RTi, звідки m = 0,29M/i. Коефіцієнт і залежить від ступеня та характеру електролітичної дисоціації і може бути виражений рівнянням: і = 1 + a(n - 1) де а — ступінь електролітичної дисоціації; n — число елементарних частинок, що утворюються з однієї молекули при дисоціації. Для різних груп електролітів коефіцієнт і може бути підрахований таким способом: 1. Для бінарних електролітів з однозарядними іонами типу К+А" (а = 0,86, n - 2): і = 1 + 0,86(2 - 1) = 1,86.
2. Для бінарних електролітів із двозарядними іонами типу i=l + 0,50(2 - 1) = 1,5. 3. Для тринарних електролітів типу і = 1 + 0,75(3 - 1) = 2,5. 4. Для слабких електролітів (кислота борна, кислота лимонна i = 1,1. Іноді ізотонічність розчинів досягається за допомогою введення інших фармакологічно індиферентних речовин. Це буває в тих випадках, коли основна речовина не забезпечує ізотонічності розчину, тоді вдаються до допомоги натрію хлориду, натрію сульфату або натрію нітрату і розраховують за формулою:
де М2 — молекулярна маса додаткової речовини; і2 — ізотонічний коефіцієнт додаткової речовини; тх — кількість основної речовини, г; іг — ізотонічний коефіцієнт основної речовини; Ml — молекулярна маса основної речовини. При складі ін'єкційного розчину з трьох і більше компонентів спочатку розраховують, який об'єм можуть ізотонувати зазначені кількості всіх речовин. Потім визначають за різницею кількість додаткової речовини, щоб приготовлений розчин був ізотонічним. Осмотичний тиск багатокомпонентного розчину за законом Даль-тона складається з парціальних осмотичних тисків окремих компонентів. Ізотонічні концентрації можуть бути розраховані і за кріоскопічним методом, побудованим за законом Рауля. Закон Рауля визначає залежність температури замерзання розчину від концентрації електролітів у ньому. Зниження точки замерзання прямо пропорційне кількості речовини, розчиненої в цій кількості розчинника: де At — депресія (зниження температури замерзання) розчину, °С; K — кріоскопічна константа розчинника; C — концентрація речовини, моль/л. Ізотонічні розчини речовин замерзають при одній і тій же температурі, тобто мають однакову температуру депресії. Температура депресії сироватки крові — 0,52 °С і, якщо приготовлений розчин буде мати депресію 0,52 °С, то він буде ізотонічний сироватці крові. Для розрахунку необхідно знати константи депресії, наприклад, 1 %-вих розчинів лікарських речовин. Шукану концентрацію ізотонічного розчину знаходять за формулою:
Наприклад, для глюкози (депресія 1 % -вого розчину дорівнює 0,1 °), тоді
Загальною формулою для розрахунків є:
де т1 — кількість речовини, необхідна для ізотонування, г; V — об'єм, мл; Мх — депресія 1 %-вого розчину лікарської речовини. При розрахунку багатокомпонентних систем користуються такими формулами: — при двох компонентах пропису:
— при числі компонентів у прописі більш двох:
Найбільш простим є метод розрахунку за ізотонічними еквівалентами натрію хлориду. Ізотонічним еквівалентом речовини за натрію хлоридом називається кількість натрію хлориду, що утворює в однакових умовах осмотичний тиск, рівний осмотичному тискові 1 г цієї лікарської речовини. Наприклад, 1 г глюкози безводної за осмотичним ефектом еквівалентний 0,178 г натрію хлориду. Це означає, що 1 г глюкози безводної і 0,178 г натрію хлориду ізотонують однакові об'єми водних розчинів. Або, якщо, наприклад, еквівалент натрію броміду
за натрію хлоридом дорівнює 0,62, то це означає, що 1 г натрію броміду i0,62 г натрію хлориду в однакових об'ємах розчинів створюють однакові осмотичні тиски. Знаючи еквівалент лікарської речовини за натрію хлоридом, можна визначити його ізотонічну концентрацію в розчинах. У спеціальних таблицях наводяться ізотонічні еквіваленти за натрію хлоридом для лікарських речовин. У разі, коли еквівалент лікарської речовини невідомий, необхідно користуватися іншими методами розрахунку. Дата добавления: 2016-03-26 | Просмотры: 837 | Нарушение авторских прав |