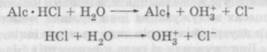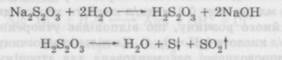|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Механізм дії стабілізаторівСтабілізація розчинів солей слабких основ і сильних кислот. До цієї групи належать розчини солей алкалоїдів азотистих і синтетичних азотистих основ, що займають чільне місце в асортименті ін'єкційних розчинів. Залежно від сили основи розчини мають нейтральну або слабокислу реакцію. Остання пояснюється гідролізом солі, який супроводжується утворенням сла-бодисоційованої основи і сильнодисоційованої кислоти, тобто наявністю іонів гідроксонію OHg. Це явище підсилюється при тепловій стерилізації. Збільшення надлишків іонів OHg (тобто вільної кислоти) знижує ступінь дисоціації води і приглушує гідроліз, викликаючи зсув рівноваги вліво:
Зменшення концентрації іонів OHg у розчині внаслідок лужності скла зрушує рівновагу вправо. Нагрівання розчину під час стерилізації збільшує ступінь дисоціації води, а підвищення pH розчину за рахунок вилужування скла викликає посилення гідролізу солі, що призводить до нагромадження в розчині важкорозчинної азотистої основи. У розчинах солей дуже слабких основ, малорозчинних у воді, незначне підвищення pH призводить до утворення осаду. Це спостерігається в розчинах стрихніну нітрату, папаверину гідрохло-риду, дибазолу та ін. При значних збільшеннях pH розчину (силь-нолужне скло) іноді спостерігається виділення сильних вільних основ, наприклад новокаїну. Якщо основи алкалоїдів є сильними або добре розчинними у воді, то при підвищенні pH виділення осаду не відбувається (основи — ефедрину, кодеїну, пілокарпіну). Іноді вільна основа не випадає в осад, тому що здатна реагувати з лугом з утворенням розчинних продуктів (морфіну, апоморфіну, адреналіну). Крім того, у слаболужному середовищі ці розчини піддаються окисненню зі зміною забарвлення (розчин морфіну жовтіє, апоморфіну — зеленіє, адреналіну — рожевіє). Якщо алкалоїд або синтетична азотиста основа мають естерні або лактонні угруповання (атропін, скополамін, новокаїн, дикаїн), то при нагріванні слаболужних або нейтральних розчинів відбувається омилення естеру або лактону, яке супроводжується зміною фармакологічної дії. Так, після стерилізації розчинів новокаїну появляється вільна n-амінобензойна кислота, завдяки чому pH розчину зміщується в кислу сторону. При зменшенні pH до 8 одиниць кількість новокаїну, що розклався, у розчині збільшується до 11 %. У літературі наводяться дані про наявність аніліну в розчинах новокаїну після стерилізації, що пояснюється декарбоксилу-ванням я-амінобензойної кислоти. Застосування новокаїну з домішкою аніліну викликає підвищену болісність. Аналогічні процеси утворення анілінових похідних відмічені також для дикаїну. Вищезазначені зміни викликають необхідність стабілізації розчинів багатьох азотовмісних алкалоїдів і основ. Більшість із них стабілізують додаванням розчину 0,1 моль/л кислоти хлоро-водневої, що нейтралізує луг, який виділяється склом, і зміщає pH розчину в кислу сторону. Це створює умови, що перешкоджають гідролізу, омиленню естерів, окиснюванню фенольних і альдегідних груп. Кількість кислоти, необхідна для стабілізації розчину, залежить від властивостей лікарської речовини. Найчастіше додають 10 мл розчину 0,1 моль/л кислоти хлороводневої на 1 л стабілізаційного розчину, що відповідає утворенню розчину 0,001 моль/л кислоти (pH = 3...4). Ця кількість розчину 0,1 моль/г кислоти хлороводневої рекомендована для атропіну сульфату, стрихніну нітрату, апоморфіну гідрохлориду, кокаїну гідрохло-риду, дибазолу, дикаїну та ін.
Для одержання стійкого розчину новокаїну гідрохлориду для ін'єкцій із 0,5—2,0 %-вою концентрацією необхідно додавання розчину 0,1 моль/л кислоти хлороводневої до pH = 3,8...4,5, що відповідає 3,4—9,0 мл розчину 0,1 моль/л кислоти на 1 л розчину препарату. Для приготування стабільного розчину новокаїну (1—2 %-вого) на ізотонічному розчині натрію хлориду слід додати 5 мл розчину 0,1 моль/л кислоти хлороводневої на 1 л. Для стабілізації розчинів речовин із естерним угрупованням (атропін, новокаїн та інші) запропоновано зменшення кількості розчину 0,1 моль/л кислоти хлороводневої до 3—4 мл на 1 л розчину. Це пов'язано з тим, що підкислювання розчинів місцевих анестетиків призводить до зменшення їхньої фармакологічної активності. При зниженні pH розчинів від 5 до 3,2 одиниць активність новокаїну падає у 8 разів. 1—5 % -ві розчини морфіну гідрохлориду стабілізують додаванням 10—20 мл розчину 0,1 моль/л кислоти хлороводневої на 1 л. Як зазначалося раніше, морфіну гідрохлорид та інші алкалоїди з вмістом фенольних гідроксилів при нагріванні, особливо в слабо-лужному середовищі, окиснються. Тому для одержання стійких розчинів необхідне додавання антиокисників (антиоксидантів), тобто речовин, що перешкоджають окисненню. Додаванням антиоксидантів стабілізують розчини адреналіну гідротартрату і гідрохлориду, норадреналіну гідротартрату, етилморфіну гідрохлориду. Стабілізація розчинів солей слабких кислот і сильних основ. У водних розчинах солі слабких кислот і сильних основ легко гідролізуються, створюючи слаболужну реакцію середовища. Це призводить до утворення важкорозчинних сполук і покаламут-ніння розчину або випадання осаду, що неприпустимо для ін'єкційних розчинів. Гідролітичні процеси підсилюються в кислому середовищі, яке створюється за рахунок розчинення у воді карбону діоксиду. Для заглушення реакції гідролізу додають розчин 0,1 моль/л натрію гідроксиду або натрію гідрокарбонату. Приготування розчину натрію нітриту проводять із додаванням 2 мл розчину 0,1 моль/л натрію гідроксиду на 1 л (pH - 7,5...8,2). Більш стійкі розчини натрію тіосульфату, натрію кофеїн-бен-зоату і теофіліну. Розчин натрію тіосульфату має середовище, близьке до нейтрального, і при незначному зниженні pH розкладається з виділенням сірки:
Стабільні розчини одержують додаванням 20,0 г натрію гідрокарбонату на 1 л (pH — 7,8...8,4). При виготовленні розчинів нат- рію кофеїн-бензоату слід додавати 4 мл розчину 0,1 моль/л натрію гідроксиду на 1 л (pH = 6,8...8,6). Еуфілін як комплексна сіль дуже слабкої кислоти (теофілін) і слабкої основи (етилендіамін) легко розкладається в кислому середовищі; додавання сильного лугу до розчину еуфіліну також призводить до розкладання солі. Для одержання стійкого розчину використовується еуфілін ґатунку «для ін'єкцій» із підвищеним вмістом етилендіаміну (18—22 % замість 14—18 %). Вода для ін'єкцій має бути звільнена від карбону діоксиду кип'ятінням. За необхідності оптимальне значення pH розчину підтримують за допомогою буферних розчинів; однак застосування їх обмежене, тому що чимало з них реагують із лікарськими речовинами в розчині. Буферами і буферними розчинами називаються розчини, здатні зберігати майже постійне значення pH при додаванні до них кислоти або лугу в незначних кількостях. Вплив поверхнево-активних речовин на кінетику хімічних реакцій. Зміна pH середовища — не єдиний спосіб захисту лікарських речовин від гідролізу. Останнім часом з'явилися роботи з вивчення впливу поверхнево-активних речовин (ПАР) на кінетику хімічних реакцій. Показано, що неіоногенні й аніонактивні ПАР гальмують, а катіонактивні ПАР прискорюють процес гідролізу цілого ряду лікарських речовин. Встановлено, що за присутності ПАР зменшення або збільшення швидкості реакції зумовлене утворенням міцелоасоціатів молекул ПАР. Міцели ПАР мають великі колоїдні розміри і мають більшу об'ємну місткість. У порожнини міцел під дією сил міжмолекулярного притягання можуть проникати відносно невеликі молекули лікарської речовини. Молекули з гідрофобними властивостями проникають вглиб міцели. Гідрофільна молекула займає положення між окремими молекулами міцели. Гідрофільна молекула лікарської речовини приєднується до зовнішньої, найбільш гідрофільної частини міцели. Комплексні сполуки, що утворюються, мають більшу стійкість, ніж лікарські речовини. У зв'язку з цим використовують ПАР для заглушення гідролізу лікарських речовин, наприклад анестетиків, антибіотиків та ін. У кожному конкретному випадку використання стабілізаторів вимагає ретельного вивчення при введенні їх до складу ін'єкційного розчину. За кордоном стабільні розчини теофіліну для ін'єкцій одержують додаванням амінопропіленгліколю або диметиламінопропілен-гліколю (0,75—1,5 г на 1 г теофіліну). Високомолекулярні сполуки (BMC) також використовують для стабілізації натрієвих солей барбітурової кислоти. Для стабілізації фенобарбіталу натрієвої солі, етамінал-натрію застосовують поліетиленгліколь, розчини барбамілу пропонують стабілізувати додаванням 5 % твіну-80. Використовуються й інші шляхи, що дозволяють підтримувати pH у розчині без помітних коливань. Через те що ампульне скло викликає зміну pH розчинів, то для підвищення хімічної стійкості ампул використовують силіконові покриття внутрішньої поверхні ампул або захищають скло пластичною масою. Однак силіконізовані й пластмасові ампули дотепер не знайшли широкого застосування в нас у країні. Стабілізація розчинів легкоокиснюваних речовин. Присутність кисню, що знаходиться в розчиненому стані й у газовому просторі над розчином в контейнері, є однією з основних причин окисню-вання лікарських речовин у розчинах. Окисненню піддаються багато лікарських речовин: похідні ароматичних амінів і фенотіазину, алкалоїди й азотисті сполуки з фенольними оксигрупами й аміногрупами, ряд вітамінів, а також інші сполуки з рухливим атомом гідрогену. У процесі окис-нення утворюються неактивні, а іноді й отруйні продукти. Швидкість окисних процесів залежить від концентрації оксигену, температури, pH середовища, наявності каталізаторів, агрегатного стану, концентрації речовин у розчині тощо. Дуже важливим чинником, що впливає на швидкість окисню-вання, як і на процес гідролізу, є концентрація водневих іонів, яка може змінюватися під впливом різних марок ампульного скла. Скло, використане для виготовлення ампул, значно впливає на стабільність лікарських речовин при зберіганні. Для одержання стабільних парентеральних розчинів з легкоокиснюваними речовинами доцільно використовувати первинну тару 1-го класу скла. Дата добавления: 2016-03-26 | Просмотры: 943 | Нарушение авторских прав |