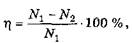|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
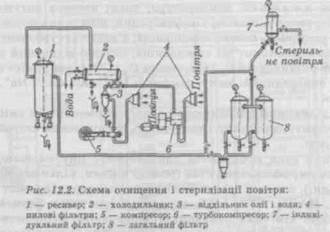
Системи очищення повітряДля забезпечення киснем культури мікроорганізмів в умовах аеробного процесу при глибинній ферментації через одиницю об'єму живильного середовища за 1 хв необхідно продути 0,5—2 об'єми повітря. Його треба очистити від механічних частинок, мікроорганізмів і хімічних речовин перед введенням у ферментатор. Для очищення повітря зазвичай застосовують фільтрацію (рис. 12.2). Повітря подають у систему під тиском 0,2 МПа. Для створення тиску найчастіше використовують турбо- або поршневі компресори. Перед подачею в компресор повітря очищується від грубих частинок на масляних фільтрах. У ферментаторі воно проходить
через фільтри: спочатку через загальний, потім через індивідуальний. Ці фільтри виконують функцію холодної стерилізації повітря. Фільтри заповнюють гранульованим зернистим або волокнистим фільтрувальним матеріалом, використовуючи гранульоване вугілля і скловату, діаметр волокон яких 18 мкм. Останнім часом почали використовувати спеціальне бактерицидне волокно. Товщина фільтрувального шару зазвичай складає 0,4—0,75 м. Індивідуальні фільтри часто заповнюють скловатою або бавовняною ватою, активованим вугіллям. Тривалість експлуатації фільтрів 1—1,5 год при температурі 120— 126 °С. Після стерилізації їх сушать у потоці сухого повітря протягом 2—3 год. Фільтрувальний матеріал в індивідуальних фільтрах заміняють через 1—2 місяці, у загальних — через 6—8 місяців. Затримуюча спроможність фільтра:
де N^ — кількість мікроорганізмів у потоці атмосферного повітря, що наступає; N2 — теж саме на виході з фільтру. Як фільтрувальний матеріал можуть бути використані і спеціально виготовлені пластинки, наприклад полівінілові, завтовшки 1—2 мм із порами певного розміру. В обслуговуванні пластинчасті фільтри простіші, ніж фільтри із скловолокном. Системи контролю і керування Щоб процес ферментації зробити керованим, оператор має постійно отримувати інформацію про хід розвитку біологічного агента і динаміки середовища культивування. Основні показники, що характеризують ферментаційний процес такі:
Фізичні показники: температура; тиск; введена потужність; частота обертання мішалки; піноутворення; швидкість потоку газу (повітря); швидкість потоку середовища; в'язкість; турбулентність. Хімічні показники: pH середовища; окисно-відновний потенціал; вміст розчиненого 02 і С02; вміст 02 і С02 у газі; вміст вуглецю; вміст попередника: азоту, фосфору; Mg2+, K+, Ca2+, Na+, Fe2+, SO2- тощо. Найважливішим показником процесу ферментації є вміст біомаси, субстрату, продукту і відсутність забруднення сторонньою мікрофлорою. Фізичний стан продуцента характеризує питома швидкість росту, його морфологічний стан (розмір клітин, кількість клітин, що діляться,), а також багато біохімічних показників (вміст PHK, ДН, НАД, НАДН, ATP, AMP, активність ключових ферментів). Більшість хімічних показників визначають, періодично відбираючи пробу, фізичні показники — постійно за допомогою вмонтованих у ферментатор датчиків.
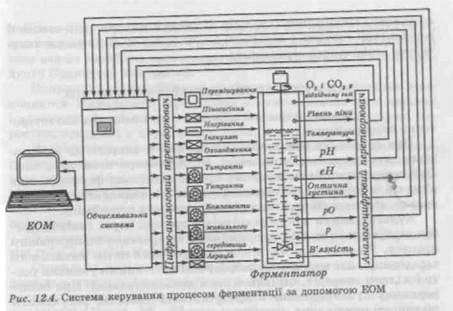
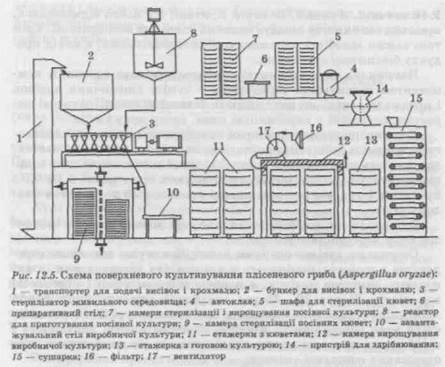
Для біотехнічних процесів істотне значення має не тільки температура і pH середовища, але й вміст розчиненого кисню. Для визначення pH і розчиненого кисню застосовують стерильні електроди, вмонтовані безпосередньо у ферментатор. Для визначення розчиненого кисню застосовують амперметричні срібно-свинцеві або срібно-золоті електроди. Істотний вплив на хід процесу ферментації має ступінь піноутворення субстрату. Для субстратів, що дуже піняться, використовують автоматизовані системи піногасіння, що включають як хімічні, так і механічні засоби (рис. 12.3). Сучасний біотехнічний процес немислимий без застосування ЕОМ для керування процесом ферментації: підтримка оптимальної величини pH, температури, піноутворення, частоти обертання мішалки, кількості розчинного кисню, швидкості подачі субстрату тощо (рис. 12.4). 12.3.3. ГЛИБИННИЙ АЕРОБНИЙ ПЕРІОДИЧНИЙ ПРОЦЕС Цей відносно сучасний метод має великі переваги впорівнянні з більш ранніми методами поверхневого культивування. Застосування глибинного методу дозволяє підвищити ефективність використання виробничих площ, збільшити масштаби виробництва, механізувати трудомісткі роботи і майже цілком автоматизувати технологічний процес одержання біопродукту. Крім того, вихід продукту підвищується, а небезпека зараження зменшується, хоча технології поверхневого способу культивування більш економні, оскільки при його застосуванні собівартість продукту і витрата електроенергії значно менші. Більшість промислових ферментацій здійснюють періодичним способом. При глибинному способі культивування розмноження посівного матеріалу зазвичай відбувається у дві стадії: у цеху чистої культури та у відділенні інокуляції. Кількість живильного середовища в апараті не повинна перевищувати 60 % від загального об'єму. Якщо культуру в інокулятор вносять із колб, то кількість посівного матеріалу складає приблизно 0,1 % від об'єму середовища. Така невелика кількість посівного матеріалу вимагає тривалого періоду інокуляції (2—4 доби). Для посівних ферментаторів використовують 10—12 % інокуляту від загального об'єму середовища, тому за тривалістю приготування посівного матеріалу треба стежити, щоб в апараті був оптимальний режим культивування. Три рази в сушці збирають зразки для мікробіо- логічного і біохімічного аналізів. Посівний матеріал для основної ферментації готують у кількості 5—20 % від об'єму використовуваного живильного середовища. 12.3.4. ГЛИБИННИЙ БЕЗПЕРЕРВНИЙ ПРОЦЕС Процес ферментації може бути гомогенно або гетерогенно безперервним. При гомогенно безперервному процесі в апараті, де відбувається інтенсивне перемішування, усі параметри незмінні в часі. При гетерогенно безперервному процесі декілька ферментаторів з'єднані в батарею. Живильне середовище надходить у перший апарат, готова культуральна рідина витікає з останнього. Культивування мікроорганізмів у протоці через систему трубок відбувається також за принципом гетерогенно безперервного процесу. У цьому разі має місце безперервний потік живильного середовища, але клітини не забезпечені постійними умовами росту (скільки апаратів, стільки й умов культивування). При безперервному культивуванні мікроорганізмів важливо регулювати швидкості притікання живильного середовища і витікання куль-туральної рідини, щоб запобігти вимиванню культури із системи. У стерильних умовах безперервний проточний метод забезпечує зберігання культури у фізіологічно активному стані тривалий час. Безперервний процес можна використовувати в тому разі, якщо культура при тривалому вирощуванні не втрачає здатності до синтезу (мутації, реверсії). При розробці методу безперервного культивування мікроорганізмів необхідно встановити оптимальний склад середовища, швидкість подавання живильного середовища, температуру, pH, аерацію тощо. 12.3.5. ТВЕРДОФАЗНА ФЕРМЕНТАЦІЯ Культивування на поверхні твердого середовища, як правило, здійснюють у зволоженому твердому, сипучому або пастоподібному середовищі, вологість якого становить 30—80 %. Якщо субстрат сипучий, то його окремі тверді частинки добре контактують із повітрям. Ріст мікроорганізмів у цьому разі відбувається головним чином на поверхні твердих частинок, а також у порах, заповнених водою або повітрям. Забезпечення мікроорганізмів киснем утруднюється із зволоженням шару субстрату. Перемішування шару не допускається, якщо культивуються міцеляльні мікроорганізми. Інша проблема при твердофазній ферментації — відведення теплоти і підтримка сталої тёмператури в усьому ферментаційному середовищі. Метод твердофазної ферментації широко використовують в Японії для виробництва грибкових ферментів кислоти лимонної. У Німеччині, Франції, Великій Британії від нього відмовилися, оскільки він вимагає занадто великих площ для експлуатації. Крім того важко запобігти зараженню мікроорганізмами, а вихід продукту біосинтезу невеликий. Наприклад, у виробництві грибкової амілази головним компонентом живильного середовища є суміш пшеничних висівок і крохмалю, іноді до них додають білкові відходи, солодові паростки, одержані у виробництві пива, соєву муку і т. ін. Для вирощування виробничої культури компоненти живильного середовища змішують, розподіляють тонким шаром у кюветах, зволожують міцеляльним розчином, який містить невелику кількість кислоти хлороводневої, стерилізують при тискові 0,15 МПа протягом 1 год або гострою парою протягом 30 хв, а потім охолоджують. В охолоджене до 35 °С живильне середовище вносять суспензію спор Aspergillus oryzae. Стерильне, засіяне спорами Aspergillus oryzae живильне середовище в кюветах поміщають у камери для вирощування, в які подають очищене повітря, з певною температурою і відносною вологістю. Через 30—36 год інкубації для культури гриба Aspergillus oryzae в цих камерах при температурі 30 °С розвивається маса споротвірного міцелію. Масу знімають, висушують і здрібнюють для одержання сирої амілази або екстрагують для одержання очищеної амілази. Схема вирощування культури Aspergillus oryzae наведена на рис. 12.5. Технологічний процес поверхневого культивування цієї культури складається із семи стадій: 1. Введення (одержання і підтримка росту) чистої культури в лабораторних умовах. 2. Приготування посівного матеріалу у відділенні чистої культури. 3. Підготовка живильного середовища. 4. Вирощування виробничої культури. 5. Здрібнення готової культури. 6. Сушіння. 7. Розфасовка і упаковка готової продукції. Описана схема поверхневого культивування вимагає значних затрат ручної праці. Більш сучасний варіант, запропонований для великотоннажного виробництва поверхневих культур плісеневих грибків, передбачає використання механізованих установок для вирощування із рознімними касетами і автоматичним розвантаженням. При цьому виникає можливість вирощувати за добу 1,2 т культури грибка. Така автоматизована система конструкції РНДІФС (рис. 12.6) існує на Вишньоволоцькому заводі ферментних препаратів, який здійснює випуск лікарського ферментного препарату ораза з поверхневої культури грибка Aspergillus oryzae.
Підготовлене, простерилізоване і засіяне культурою грибка Aspergillus oryzae живильне середовище завантажується в камери вирощування і по рельсах подається у відділення вирощування, через дифузори до камер подається кондиціоноване повітря. Ae-рування культури здійснюється через вертикальні канали, що знаходяться між кюветами, і через отвори в стінках кювет. Система аерації розрахована на рециркуляцію та очищення потоку повітря, підсмоктування свіжого повітря і підтримку умов, що запобігають підсиханню культури, яка вирощується. Процес культивування проводять протягом 42—46 год. Після цього проводять розвантаження камер вирощування на вібраційному столі, відділивши попередньо вертикальну стінку кювети. Звільнена від культури камера переміщається по рельсах у відділення промивки, потім у стерилізатор і на вібраційний стіл для нового завантаження. Використання механізованої лінії з вирощування культури грибка Aspergillus oryzae дає можливість підтримувати високий рівень стерильності, що дуже важливо для цілеспрямованого синтезу амілази. У разі потреби можна оперативно локалізувати й ізолювати інфікований матеріал, виключаючи небезпеку зараження супутньою мікрофлорою інших камер. Вирощену поверхневу культуру грибка передають на стадію екстракції, минаючи операцію сушіння, здрібнювання і фасування, які мають місце при серійному виробництві «амілорозину — П». 12.3.6. ГЛИБИННА ФЕРМЕНТАЦІЯ Промисловий спосіб глибинної ферментації — складний багатоступінчастий процес, який включає декілька технологічних стадій. Нижче наведено основні з них. 12.3.6.1. ПЩГОТОВКА СЕРЕДОВИЩА ДЛЯ КУЛЬТИВУВАННЯ ПРОДУЦЕНТА ФЕРМЕНТУ I ПОСІВНОГО МАТЕРІАЛУ (I СТАДІЯ) Приготування і стерилізація живильного середовища. Живильні середовища готують у спеціальних реакторах із міЩалками. Реактори, ферментатори, трубопроводи, арматуру найчастіше виготовляють із нержавіючої сталі, особливу увагу
звертають на зручність для стерилізації живильних середовищ, які використовують як для приготування чистої культури, так і в цехах основної ферментації. Середовище готують у сировинному або рецептурному цехах періодичним або безперервним методом, в окремих випадках приготування і стерилізацію його здійснюють у ферментаторі. На сучасних заводах застосовують безперервний метод приготування. Для цього використовують два резервуари: в один уводять вихідні речовини, а з іншого рідина витікає в змішувач безперервної дії. А потім за допомогою насоса подається в колону для стерилізації, одночасно з якою використовуються парові інжектори, або теплообмінник — труба в трубі. При роботі з вертикально встановленою стерилізаційною колоною живильне середовище підводять знизу в простір між трубами. У верхню частину колони подають пару під тиском 0,3— 0,4 МПа. Швидкість потоку середовища вибирають таку, щоб кожна частинка живильного середовища знаходилася в зоні прогрівання відповідний час. Якщо для стерилізації середовищ застосовують відносно високу температуру (135 °С і вище) і об'єм витримування не перевищує декілька десятків літрів, замість резервуарів використовують систему вертикально закріплених труб. Теплообмінники пластинчастого типу використовують для нагрівання і охолодження середовища, процес стерилізації в них легко автоматизується. Вибір апаратури, технології приготування і стерилізації живильного середовища залежить від кількості і виду компонентів, які попередньо розчиняють у підігрітій або гарячій воді. Якщо за ступенем розчинності і стерилізації це можливо, то всі компоненти розчиняють в одному розчині та в певній послідовності. У противному разі їх розчиняють по окремих групах вихідних речовин, виходячи з їхніх фізико-хімічних властивостей, стерилізують і з'єднують у змішувачі. Якщо середовище стерилізують у невеликих кількостях, весь об'єм середовища доводять до температури 120 °С безпосередньо у ферментаторі або спеціальних котлах-стерилізаторах, витримують протягом 30—60 хв (залежно від об'єму середовища і його складу) при 120 °С, а потім охолоджують до 27—30 °С. Приготування посівного матеріалу. Штами-продуценти ферментів підприємства мікробіологічної або хіміко-фармацевтичної промисловості отримують з академій і університетів України і країн СНД у пробірках на зрізах агару або в ампулах. Кожна культура має паспорт із докладним описом морфології, характеристики середовища для культивування і збереження. Перед початком технологічного процесу культуру розмножують у стерильних умовах на оптимальному складі середовища і при дотриманні режиму вирощування (pH, температура, тривалість). 3 поверхні зрізу агару її стерильно переносять у колбу місткістю 100—200 мл та інкубують у термостаті. Тривалість кожної стадії вирощування 24 год. Подальше розмноження посівного матеріалу зазвичай проводять у два етапи: в цеху чистої культури та у відділі інокуляції. Апарати першого етапу вирощування часто називають іноку-ляторами, другого — посівними ферментаторами. 12.3.6.2. ОСНОВНА ФЕРМЕНТАЦІЯ. РОЗВИТОК ОРГАНІЗМУ-ПРОДУЦЕНТА ФЕРМЕНТУ У ФЕРМЕНТАТОРАХ (II СТАДІЯ) Для стерильної основної ферментації широко використовують апарати об'ємом до 100 м3. Перед заповненням основного ферментатора середовищем його і систему трубопроводів промивають водою, стерилізують гарячою парою під тиском, після чого заповнюють охолодженим живильним середовищем. Посівний матеріал для основної ферментації готують у кількості 5— 20 % від об'єму використовуваного середовища. Процес розвитку мікроорганізму у ферментаторах проходить при суворому контролі всіх стадій, точному виконанні регламенту, умов розвитку організму-продуцента ферменту. Особлива увага приділяється підтримці заданої температури культивування, активної кислотності, pH середовища, ступеня аерації і швидкості обертання мішалки. Враховується споживання організмом основних поживних компонентів (джерела вуглецю, азоту та інших видів сировини), пильно контролюється утворення ферменту. Особливу увагу при розвитку продуцента у ферментаторах звертають на процес піногасіння. При продуванні повітря через культуру мікроорганізму часто відбувається сильне утворення піни, що суттєво порушує перебіг всього процесу розвитку продуцента ферменту у ферментаторі. Основна причина появи великої кількості піни — наявність білкових речовин у середовищі і його висока в'язкість, зумовлена накопиченням біомаси. Для боротьби з піноутворенням у ферментаторах використовують різні ПАР: рослинні олії (соєву, соняшникову), тваринний жир (лярд, кашалотовий жир), а іноді й мінеральні масла (вазелінове, парафінове), спирти і вищі жирні кислоти. Часто як піногас-ники використовують спеціально синтезовані речовини (силікони, діазобутал-карбаміл та інші сполуки). Багато речовин (олії, жири, спирти та ін.) — піногасників споживаються продуцентами ферментів як додаткові джерела вуг-
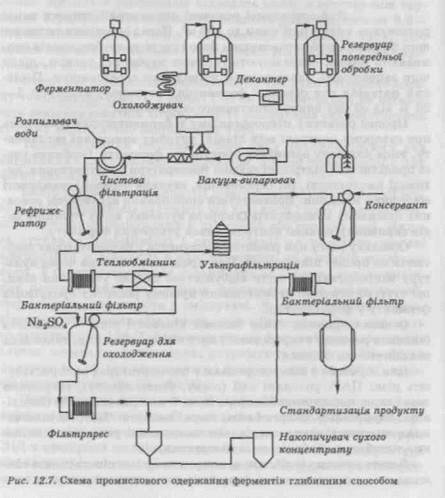
лецевого живлення. При цьому часто спостерігається підвищення виходу ферменту. Однак внесення піногасника знижує швидкість розчинення кисню, що у свою чергу може негативно вплинути на розвиток мікроорганізму і його біосинтетичну активність. Іноді використовуються механічні способи піногасіння (відсмоктування піни через спеціальні труби, руйнація бубльбашок піни сильними струменями рідини, пари або газу і аеродинамічні). Ферментацію припиняють, коли в середовищі накопичується максимальна кількість корисного продукту. По закінченні процесу культуральну рідину охолоджують до 5—10 °С для забезпечення стабільності продукту і запобігання росту інших мікроорганізмів і перекачують у резервуари, з яких вона поступово подається на подальшу переробку (рис. 12.7). 12.3.6.3. ПОПЕРЕДНЯ ОБРОБКА КУЛЬТУРАЛЬНОЇ РІДИНИ До складу культуральної рідини входять залишки використаного живильного середовища, синтезовані метаболіти і клітинна маса продуцента. Для виділення продуктів біосинтезу використовують сепаратори, осаджувальні центрифуги, фільтрпреси, вакуум-барабанні фільтри, ротаційно-вакуумні фільтри, відстійники. Вибір обладнання залежить від масштабу ферментації, типу клітин, властивостей культуральної рідини, місця локалізації ферментів (у клітині, клітинній стінці, культуральній рідині). Стадія попередньої обробки культуральної рідини в деяких технологіях виробництва ферментів включає операцію руйнації клітин і клітинних стінок за допомогою гомогенізаторів високого тиску, ультразвуку, хімічною обробкою (електроліти, поліелект-роліти, луги) і ферментаційні методи. Біомасу грибків звичайно збирають прямим центрифугуванням культуральної рідини або сепаруванням. Бактеріальні клітини вимагають попередньої обробки культуральної рідини шляхом флокуляції у крупніші коагулюючі скупчення для збільшення ефективності їх поділу в центрифузі. При нейтральній реакції середовища бактеріальні клітини в культуральній рідині мають негативний заряд, обумовлений фосфатними або карбоксильними групами клітинної стінки. Флоку-люючі агенти (амонію сульфат, кальцію хлорид) нейтралізують заряд і сприяють утворенню великих агрегатів клітин, які легко осідають із культуральної рідини. Після попередньої обробки культуральну рідину центрифугують або декантують. Альтернативою центрифугуванню служить фільтрація. Для фільтрації невеликих об'ємів культуральної рідини використовують нутч- і друк-фільтри, вакуум-барабанні і ротаційно-вакуумні фільтри. Прес-фільтри застосовують для обробки великих об'ємів рідини. 12.3.6.4. ВИДІЛЕННЯ ТА ОЧИЩЕННЯ ФЕРМЕНТУ Стадія виділення і хімічного очищення включає низку процесів: від обробки нативного розчину до сушіння готового продукту. Звичайно після центрифугування біомасу отримують у вигляді густої рідини або пасти із вологістю 70—85 %. Клітинну масу промивають, фільтрують, сушать, гідролізують, екстрагують із неї
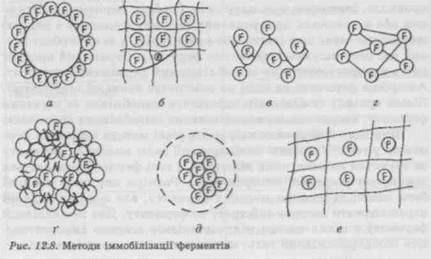
необхідний фермент. Якщо ферменти знаходяться в розчині, біомасу використовують після відділення як побічний продукт, а потрібну речовину виділяють із розчину різними методами: осадженням, фільтрацією, екстракцією тощо. Для одержання високоочищеного ферменту застосовують висолювання, діаліз, електродіаліз, мембранну фільтрацію, гель-фільтрацію, іонообмінну хроматографію, афінну хроматографію, різні методи сорбції. Концентрування розчинів, які містять ферменти, здійснюється ліофілізацією, вакуум-випарюванням, виморожуванням. 12.3.6.5. ОДЕРЖАННЯ ГОТОВОЇ ПРОДУКЦІЇ (V СТАДІЯ) Після виділення і хімічного очищення ферменту його необхідно висушити — видалити з отриманого препарату вільну і зв'язану воду. Оскільки ферменти в основному термолабільні, для їх висушування необхідно застосовувати методи, які не призводять до втрати біологічної активності. На сучасному етапі промислового одержання ферментів, використовують різні методи зневоднення препаратів. Широкого поширення набуло ліофільне сушіння ферментів, що здійснюється при порівняно низьких температурах (від -10 до -15 °С). При роботі із значними об'ємами розчину, що містить ферменти, проводять висушування із застосуванням розпилювальних сушарок. Однією з важливих операцій хімічного очищення ферментів є кристалізація. Залежно від хімічної будови ферменту і його фізико-хімічних властивостей застосовують такі методи кристалізації: випарювання розчинника (ізотермічний), охолодження гарячого розчину (ізогідричний), одночасне охолодження і випарювання (комбінований), додавання в розчин інших речовин, які знижують розчинність (висолювання), виморожування. Після висушування препарат, якщо він нестійкий, необхідно змішувати із стабілізатором або з наповнювачем (крохмалем, декстринами, неорганічними нейтральними сполуками, тальком тощо). 12.3.7. ІММОБІЛІЗАЦІЯ I СТАБІЛІЗАЦІЯ ФЕРМЕНТІВ Іммобілізація ферментів — це підвищення їхньої стабільності. Як відомо, у клітинах ферменти знаходяться частіше в «незв'язаній» формі, тобто прикріплені до певних структур і локалізовані в органелах. Тому ферменти характеризуються нестабільністю у разі дії низки фізичних і хімічних чинників і можуть інактивуватися. Це має місце і при одержанні ферментів мікробіологічним шляхом, тому після досягнення у ферментаторі максимальної активності ферментів необхідно якнайшвидше провес- ти їх виділення. Причиною зниження активності можуть бути протеази, які виділяються в середовище при автолізі клітин продуцента або в мікроорганізми, що утилізують фермент. При використанні ферментних препаратів для каталізу різних реакцій вільні ферменти досить чутливі до температури, pH середовища, наявності різних речовин. Дію цих чинників може денатурувати білок. Крім того, вільні ферменти можуть бути використані лише одноразово, їхня вартість досить висока. Досягнення молекулярної біології сприяли детальному вивченню будови багатьох ферментів. Був розкритий амінокислотний склад багатьох ферментних білків, їх просторова конфігурація, виявлені активні центри, значення різних функціональних груп у виявленні каталітичної активності ферменту. Це дозволило створити теоретичну базу для виробництва ферментів пролонгованої дії або, як їх називають, іммобілізованих, фіксованих, або зв'язаних ферментних препаратів. Сутність іммобілізації ферментів — прикріплення їх в активній формі до нерозчинної основи, включення в гель або в напівпроникну мембранну систему. Методи іммобілізації ферментів можна розділити на дві групи: включення в гель мікрокапсули і зв'язування з носієм адсорбційним або ковалентним зв'язком. Найчастіше використовувані методи іммобілізації показані на рис. 12.8. Схеми б і д стосуються першого методу, інші — другого. Допускається прикріплення ферментів тільки за допомогою функціональних груп, які не входять до активного центра і не беруть участь в утворенні фермент-субстратного комплексу. Носій ферменту, або матриця, може мати вигляд зернистого матеріалу, волокнистої структури, пластинчастої поверхні, плівок або тканин,
порожнистих волокон, трубочок, капсул тощо. Має значення розмір частинок носія, важливо, щоб він мав велику поверхню, тому рекомендується використовувати невеликі частинки діаметром 0,1—0,2 мм. Носій ферменту може бути як природною (нативною) речовиною, так і синтетичним полімером. Для іммобілізації широко застосовують целюлозу і її похідні — кислу карбоксиметилце-люлозу і ацетилетилцелюлозу та ін. У воді целюлоза набухає, і її гідроксильні групи приєднують ділянки молекул ферменту. Із синтетичних носіїв можна назвати карбоксильні або сульфоксильні хлориди у вигляді полімерних іонообмінних смол, діазотований поліаміностерин, нітратні кополімери кислоти метакрилової та ін. Процес іммобілізації ферментів можна продемонструвати на прикладі зв'язування глюкоамілази з носієм ацетилетилцелюлози. Носій спочатку витримують протягом доби в очищеній воді для набухання. Потім при перемішуванні до ацетилетилцелюлози, що набухла, додають спочатку натрій-ацетатний буфер (pH = 5,53), потім — розчин очищеного ферменту. Після перемішування вносять поперечно-зшивальний агент — глутаровий альдегід, який утворює амідний зв'язок між аміногрупою носія і карбоксильною групою ферментного білка. Через кілька годин отриманий препарат промивають послідовно натрій-ацетатним буфером і розчином натрію хлориду для видалення сорбованого на носії білка. Іммобілізований у такий спосіб фермент зберігають під шаром води або буфера при температурі 3—5 °С. Ферменти можна прикріплювати до поверхні носія шляхом сорбції до іонітів: до катіонів (які містять активні кислотні групи) або до аніонітів (які містять переважно основні групи). Як сорбенти — носії ферментів часто використовують гель алюмінію гідроксиду або кальцію фосфату, діатоміт, модифікований крохмаль, бентоніти, кізельгур та ін. Сорбцію ферментів здійснюють або в колонках пропусканням розчину ферменту з певною швидкістю через шар іоніту, або в реакторах, в яких сорбент певний час перемішують із розчином ферменту. Отриманий продукт потім використовують як іммобілізований ферментний препарат. Адсорбція ферменту на носії не забезпечує тривалої стабілізації. Більш тривалу стабілізацію забезпечує іонообмінне зв'язування ферменту, наприклад, на модифікованих іонообмінних целюлозах. Широкого поширення набувають різні методи вміщення ферментів у гель. У процесі полімеризації гелю молекули ферменту зв'язуються на невеликих відстанях, і тоді фермент виявляється замкнутим усередині комірки гелю. Розміри пор гелю повинні бути менші за розміри молекул ферменту, але вони не повинні перешкоджати доступу субстрату до ферменту. Для іммобілізації ферменту з цілих клітин мікроорганізмів широко використовують поліакриламідний гель, кальцію альгінат, крохмаль та ін. Нині розроблено методи іммобілізації багатьох ферментів. Деякі з них наведені нижче.
Як бачимо з цих прикладів, один і той же фермент можна іммобілізувати кількома методами. Так, лактатдегідрогеназу можна ввести в гель, прикріпивши до носія поперечним зшиванням; аспарагіназу — прикріпити до носія сорбційним шляхом або хімічним (ковалентним) зв'язком і т. ін. Нині налагоджено промисловий метод фізичної іммобілізації ферментів — включення ферменту у мікрокапсули і волокна. В обох методах фермент залишається у своєму звичайному водному оточенні, це забезпечує зберігання його активності і специфічності. При мікрокапсулуванні крапельки водного розчину ферменту диспергують (розпиляють) в органічному розчиннику, і на межі поділу фаз виникає оболонка (мембрана) за рахунок міжфа-зної полімеризації або зниження розчинності близького за походженням полімеру, який спочатку був присутній в одній із фаз. Як і в разі включення в гель, мембрана мікрокапсули проникна для низькомолекулярних субстратів, але непроникна для ферменту. Розміри капсул складають десятки або сотні мікрон, і вони легко відокремлюються від розчину фільтруванням. Дуже поширений метод іммобілізації — включення ферменту у волокна. Спочатку одержують емульсію водного розчину ферменту (або суспензію сухого ферменту) в органічному розчиннику, який містить полімер, здатний утворювати волокна. Найчастіше використовують триацетат целюлозу, а також нітроцелюлозу, етилцелюлозу тощо. Потім цю емульсію продавлюють через тонкі отвори в інший розчинник, який спричиняє коагуляцію полімеру. Утворюються волокна, які містять мікрокрапельки (близько 1 мікрона) водного розчину ферменту. Іммобілізація завжди пов'язана із втратою частини активності ферменту, оскільки при зв'язуванні молекули ферменту з носієм може бути порушений вільний доступ субстрату до активного центра, або деякі реакцій-ноздатні групи активного центра використовуються для зв'язування ферменту з носієм. Крім того, при іммобілізації у ферменту може змінитися конформація молекули з втратою активності або відбудеться часткова денатурація молекули. Незважаючи на втрату від 10 до 90 % активності ферментів при іммобілізації, а також на деяке зменшення швидкості реакції внаслідок утруднення дифузіїсубстрату, іммобілізовані ферменти мають значні технологічні переваги порівняно з незв'язаними. Дуже важливо те, що іммобілізовані ферменти можна відокремити від продуктів реакції і використовувати багаторазово та що фермент не забруднює продукт. При іммобілізації стає можливим змінювати і цілеспрямовано модифікувати властивості ферменту. I, нарешті, іммобілізовані ферменти звичайно більш стабільні до дії температури і pH середовища. 12.3.8. ІНГІБІТОРИ ФЕРМЕНТІВ Існують речовини різної хімічної природи, здатні гальмувати перебіг біохімічних реакцій, в яких фермент є каталізатором. Гальмування може бути як оборотним, так і необерне-ним. Інгібітори відповідно поділяють на оборотні і необернені. При дії оборотних інгібіторів активність ферменту можна відновити видаленням інгібітору, наприклад, із використанням селективних мембран або діалізу. При дії оборотних інгібіторів активність ферменту не відновлюється. Коли інгібітор за своєю структурою подібний до біоспецифічно-го субстрату конкретного ферменту, відбувається його приєднання до активної ділянки каталізатора. Інгібітор заважає приєднанню субстрату, гальмування припиняється. При неконкурентному інгібуванні інгібітор приєднується не там, де зв'язується субстрат, і від внесення надлишку субстрату фермент не звільнюється. У разі неконкурентного інгібування фермент—фермент може одночасно зв'язуватися як з інгібітором, так і з субстратом. Існують інгібітори і змішаної дії, що залежить від структурних особливостей інгібітору і ферменту. Змішаний тип інгібування може виникати і в разі, коли інгібітор з'єднується не з вихідним фермент-суб-стратним комплексом, а з проміжними продуктами, що утворюються в процесі реакції. Інгібіторами ферментів є солі важких металів, речовини, які специфічно впливають на сульфгідрильні угруповання ферментного білка (органічні сполуки меркурію, арсен), специфічні білки рослин, мікроорганізмів і тварин, полісахариди, антибіотики, таніни та ін.
і курильні (інгаляційні) збори. Збори для внутрішнього застосування бувають в'яжучі, жовчогінні, потогінні, гіркі (апетитні), грудні, заспокійливі, проносні, вітрогінні, вітамінні і т. ін. Збори для зовнішнього застосування поділяють на збори для полоскань, для припарок або пом'якшувальні, для ванн тощо. Курильні збо-ри використовуються для безпосереднього введення диму, який містить леткі діючі речовини, в легені. Збори (Species) — це суміші різаної або грубоздрібне-ної рослинної лікарської сировини (крім рослин, що містять сильнодіючі речовини), до яких іноді додають солі, ефірні масла або інші речовини. У перекладі з латинського слово «збір» означає «рід», «вид» (певний вид або суміш різних видів лікарських рослин). Людина ще з глибокої давнини мала значний запас відомостей про лікарські властивості різних рослин і широко застосовувала їх. Збори зберегли своє значення дотепер завдяки наявності в рослинній сировині діючих речовин в нативному вигляді, простоті приготування і застосування, доступності сировини. Вадами зборів є: незавершеність лікарської форми (хворий має приготувати чай, полоскання і т. ін.) і неточність дозування (для недозованих зборів). При заводському виробництві є можливість подальшого удосконалення цієї лікарської форми: поліпшення якості подрібнення та однорідності змішування; усунення основної вади зборів — неточності дозування при застосуванні. Дата добавления: 2016-03-26 | Просмотры: 829 | Нарушение авторских прав |