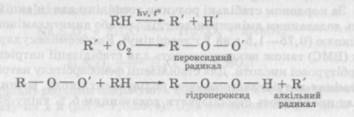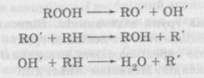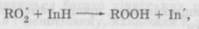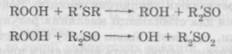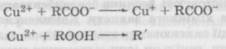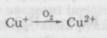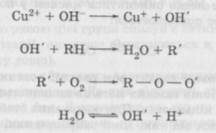|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Теорії окисно-відновних процесівМеханізм окисно-відновного процесу розкритий у пе-рекисній теорії О. H. Баха, I. О. Енглера і теорії розгалужених ланцюгів M. M. Семенова. Відповідно до теорії ланцюгових реакцій, окиснення розвивається завдяки взаємодії молекул вихідної речовини з вільними радикалами, які утворюються під впливом ініціюючих чинників. Вільний радикал починає ланцюг окисних перетворень. Він реагує з киснем, утворюючи пероксидний радикал, який у свою чергу, взаємодіючи з іншими молекулами легкоокиснюваних речовин, утворює проміжний продукт гідропероксид і новий вільний радикал:
Гідропероксид розпадається з утворенням вільних радикалів, які продовжують окиснення нових молекул лікарської речовини. Процес приймає характер ланцюгових реакцій. У ході окиснення може відбутись розгалуження ланцюгової реакції, у результаті чого утвориться складна суміш продуктів окиснення:
Виходячи з вищесказаного, процес окиснення можна сповільнити, якщо ввести: — речовини, які миттєво реагують з алкільними радикалами; — сполуки, які миттєво реагують із пероксидними радикалами, що знизить швидкість утворення гідропероксидів і генерування радикалів; — речовини, що руйнують гідропероксиди з утворенням молекулярних продуктів, які не утворюють вільних радикалів. Потрібно відзначити, що у фармацевтичній технології інгібітори, які переривають ланцюгову реакцію, не застосовуються, тому що вони ефективні тільки при повній відсутності кисню. Механізм дії антиоксидантів. Важливе значення мають стабілізатори, які дозволяють охороняти лікарські речовини від небажаної дії кисню, так звані антиокисники або антиоксиданти (AO). За механізмом захисту чутливих лікарських речовин розрізняють три групи антиоксидантів: 1. Власне AO, які інгібують окислення, реагуючи з вільними радикалами, перериваючи ланцюгову реакцію. Вони в основному використовуються для стабілізації масляних розчинів. 2. Відновники, що мають більш високу здатність до окиснення і, зв'язуючи кисень, запобігають небажаним процесам в розчинах. 3. Негативні каталізатори, або антикаталізатори,— речовини, які утворюють комплексні сполуки з іонами важких металів, що провокують окисно-відновні процеси. За походженням інгібітори окиснення поділяються на природні та синтетичні. Природні антиоксиданти виділяють із різних частин рослин. За хімічною будовою більшість застосовуваних на практиці природних AO належить до похідних поліфенолів. За розчинністю AO класифікуються: — на розчинні у воді; — розчинні в маслах. Вимоги до A0, що застосовуються у виробництві фармацевтичних препаратів: 1. Нешкідливість у застосовуваних дозах, відсутність подразливої дії, алергічних реакцій як самих AO, так і продуктів їхнього метаболізму й інших інґредієнтів, що утворюються при взаємодії з ними. 2. Ефективність при низькій концентрації. 3. Добра розчинність у продуктах, які підлягають захисту від окиснення. Характеристика групи відновників. Відновники, або прямі антиоксиданти, поділяються на декілька груп: 1. Речовини, що перешкоджають утворенню активних ради
де InH — антиоксидант із рухливим атомом гідрогену; In' — малоактивний радикал антиоксиданту. До найбільш ефективних засобів цієї групи належать фенол, амінофеноли, анальгін, параамінофенол, нафтоли, ароматичні аміни. 2. Речовини, що руйнують гідропероксиди. Вони не зупиня Органічні сполуки, які містять сульфур, — сильні відновники, завдяки швидкому окисненню сірки. Механізм їхньої дії:
Негативною рисою цієї групи сполук є леткість і їх розкладання при стерилізації, які дещо зменшуються в середовищі інертних газів (азоту тощо). 3. Речовини, що обривають ланцюг окиснювання за реакцією Якщо молекула антиоксиданту містить декілька функціональних груп, він може виявитися інгібітором змішаного типу, наприклад, реагувати з ROOH і R02. У той же час та сама група може реагувати з різними частинками, наприклад, феноли здатні взаємодіяти з пероксидними й алкільними радикалами. До агентів-відновників також належать алкоголі і еноли (хло-робутанол, кислота аскорбінова тощо). Ці речовини мають низький редокс-потенціал (наприклад, кислота аскорбінова — 0,34), тобто мають більшу інтенсивність окисно-відновних процесів і тому окиснюються швидше, ніж лікарські речовини, зв'язуючи кисень у розчині й у повітряному просторі над ним. Однак для стабілізації розчину кислоти аскорбінової необхідний антиоксидант із ще більш низьким редокс-потенціалом, наприклад, натрію сульфіт (0,19). У багатьох наукових працях останніх років узято під сумнів цей механізм дії антиоксидантів. Сучасне уявлення дії інгібіторів окиснення пов'язують і з їх здатністю реагувати з вільними радикалами або перешкоджати розкладанню гідропероксидів на вільні радикали. Характеристика негативних каталізаторів. Антикаталізатори — речовини, здатні утворювати міцні внутрішньокомплексні водорозчинні сполуки з великим числом катіонів, які можуть переходити в ін'єкційний розчин із скла ампул, апаратури або бути присутніми в лікарській речовині як домішки. Як відомо, дуже впливає на процес окиснювання лікарських речовин наявність слідів важких металів, які є каталізаторами процесів окиснення. Іони важких металів (Fe3; Cu+2; Mn+2 та ін.), беручи участь у ланцюговій окисно-відновній реакції, здатні відривати електрони від присутніх разом із ними в розчинах різних іонів, переводячи останні в радикали:
Утворений радикал може реагувати з киснем, створюючи пе-роксидний радикал, який далі братиме участь у ланцюговій реакції за наведеною раніше схемою. Частково відновлений при цьому іон металу може легко окиснитися киснем у початкову форму, після чого процес повторюється:
Саме ланцюговим характером реакції пояснюється, що каталітичний вплив іонів важких металів виявляється при наявності їх у дуже малих кількостях. Для одержання стабільних розчинів важливо позбутися від них. Нині запропоновані методи очищення від важких металів фільтрацією через шар вугілля активованого і натрієвої форми окисненої целюлози, а також утворенням неактивних комплексів при максимальному координаційному числі металів або у вищому його валентному стані. Для стабілізації легкоокиснюваних речовин використовують такі комплексони: ЕДТА — кислота етилендіамінтетраоцтова, трилон Б — динатрієва сіль кислоти етилендіамінтетраоцтової, тетацин-кальцій, кальцій-динатрієва сіль кислоти етилендіамінтетраоцтової, що добре розчинні у воді, термостійкі. Механізм стабілізувальної дії пов'язаний із переведення катіонів важких металів у комплексні, практично недисоціюючі сполуки, неактивні відносно гідропероксиду. Подібну ознаку мають гідрохінон, маніт, гліцерин, 8-оксихінолін та ін. Комплексони є непрямими антиоксидантами. Стабілізація масляних розчинів. Наявність кисню повітря призводить до самовільного окиснення, або аутоокиснення, багатьох лікарських речовин, що особливо характерно для жиророзчинних сполук. Для стабілізації масляних розчинів добавляють жиророзчинні антиоксиданти: бутилокситолуен (БОТ), бутилоксіанізол (БОА), а-токоферол, пропілгалат, аскорбілпальмітат, кислоту нор-дигідрогваяретову, кверцетин і їх синтетичні суміші. Ефективність антиоксидантів цієї групи залежить від вихідної концентрації гідропероксидів та інших продуктів окиснення масляних розчинів. Запропоновано надійний спосіб для їх видалення введенням в масло (олію) вторинних і третинних амінів гідрохлоридів і гідробромідів із подальшою термообробкою (попередньою стерилізацією), який призводить до майже повної руйнації гідропероксидів. Подібну дію виявляють і деякі лікарські речовини — аміназину гідрохлорид, димедрол у концентраціях 10~3—10"4 моль/л. Для стабілізації масляних розчинів гормональних препаратів останнім часом використовують розчини бензилбензоату. Інші способи хімічного захисту. Комплексна стабілізація. Швидкість реакції окиснювання значною мірою залежить від значення pH розчину, оскільки іони гідроксилу можуть проявляти каталітичну дію. Це пояснюється тим, що іон гідроксилу під впливом слідів важких металів може перетворюватися в радикал, який бере участь у ланцюговій реакції окиснювання:
Тому для уповільнення процесів окиснення до багатьох розчинів легкоокиснюваних речовин для утворення оптимального значення pH додають буферні суміші або розчин кислоти хлоровод-невої. Спроможність окиснення (самоокиснення) лікарських речовин знижується зі зменшенням концентрації кисню в розчиннику і над розчином. Тому розчинники при використанні для виробництва ін'єкційних розчинів мають звільнятись від кисню кип'ятінням або насиченням карбону діоксидом чи азотом. Ще одним із методів стабілізації легкоокиснюваних речовин може бути використання таких високомолекулярних речовин (BMP), як поліглюкін, пропіленгліколь, поліетиленоксид із низькою молекулярною масою та ін. У середовищі цих речовин сповільнюється окиснення, що пояснюється проникненням низькомолекулярної лікарської речовини всередину молекули BMC i, отже, зменшенням їхньої реакційної здатності. Окиснення може бути зменшене за рахунок усунення дії світла і температури. Швидкість проходження деструктивних процесів у лікарських препаратах збільшується під дією ультрафіолетового випромінювання. Енергія випромінювання активує молекули або атоми речовини, що, у свою чергу, викликає розвиток хімічних реакцій, які можуть перебігати в газах, твердих речовинах і розчинах. При поглинанні речовиною світлового випромінювання певної довжини хвилі може відбуватися прискорене розкладання лікарських препаратів. Іноді приготування деяких лікарських засобів (наприклад розчину фенотіазіну) доцільно проводити в червоному світлі або при зберіганні використовувати ампули зі світлозахисного скла. Швидкість розкладання залежить також від агрегатного стану речовини. Відомо, що розкладання речовин у сухому вигляді відбувається значно повільніше порівняно зі швидкістю розкладання речовин у розчинах. Більш концентровані розчини окис-нюються повільніше, ніж розведені. Розповсюдженим технологічним способом одержання стабільних водних розчинів для ін'єкцій є переведення нерозчинної активної речовини у фізіологічно прийнятні розчинні солі або комплексні сполуки. Велике значення має синергізм інгібіторів, коли дія декількох речовин перевершує суму ефекту кожної зокрема. Синергізм може бути при спільному введенні інгібітору, що перериває ланцюг окиснювання, і інгібітору, який руйнує гідропероксиди. Можлива поліфунціональність стабілізатора, що може гальмувати окиснення як за рахунок виникнення пероксидного радикала, так і його розкладання. Застосування консервантів також сприяє підвищенню стабільності багатьох парентеральних препаратів. Використання консервантів у виробництві препаратів парентерального призначення. Однією з причин зниження якості лікарських засобів є їх мікробна контамінація в процесі виробництва або застосування, що можё призвести до зниження терапевтичного ефекту препаратів або розвитку у хворого різного роду захворювань. У зв'язку з цим парентеральні лікарські форми
можна застосовувати тільки при відсутності в них мікроорганізмів, тобто стерильними. Введення консервантів у розчини проводиться в тому разі, коли зберігання стерильності гарантувати не можна. Антимікробні речовини, що використовуються для консервації ліків, мають забезпечувати безпеку хворого і відповідну якість лікарського препарату. Виходячи з цього, до консервантів висувають такі вимоги: — широкий спектр антимікробної дії при низьких концентраціях; — висока розчинність; — сумісність із більшістю лікарських і допоміжних речовин, пакувальними матеріалами; — стабільність у широкому інтервалі pH і температури середовища упродовж терміну придатності лікарського препарату;
— відсутність впливу на органолептичні властивості лікарського препарату; — відсутність здатності утворення мікроорганізмів стійкої форми. Консерванти не повинні знижувати фармакологічну ефективність діючої речовини або проявляти токсичну, алергічну і подразливу дію на організм людини. Дотепер не знайдено ще жодної хімічної сполуки, яка повністю відповідала б цим вимогам. Кожен із консервантів при застосуванні має певні свої обмеження, тому їх використовують у тих випадках, коли запобігти контамінації лікарських засобів іншими способами неможливо. У наш час прийнята така класифікація антимікробних консервантів: 1. Неорганічні сполуки. 2. Металоорганічні сполуки. 3. Органічні сполуки: спирти, феноли, органічні кислоти, солі четвертинних амонієвих сполук, ефірні масла. Механізми впливу консервантів на мікроорганізми різноманітні й визначаються їх хімічною будовою. Основним результатом при цьому є порушення життєвих функцій клітини, зокрема, інактивація білкової частини клітинних ферментів. Залежно від ступеня інактивації наступає або загибель клітини, або уповільнення її життєвих функцій. Швидкість і глибина перетворень, що відбуваються при цьому, залежить як від фізичних (температури, концентрації, фазового стану, pH середовища тощо), так і від хімічних чинників. Не менш важливе значення має спосіб фіксації консервантів біологічними середовищами або об'єктами, які входять у систему лікарського засобу, зокрема, адсорбція на поверхні клітини, на молекулах органічних речовин (наприклад, крові) або на дрібно- дисперсних частинках суспензії. У двох перших випадках явища адсорбції корисні, оскільки являють собою початковий етап до досягнення антимікробного ефекту. В інших адсорбція призводить до зниження концентрації консерванту в лікарському препараті, тобто до ослаблення антимікробної активності. Адсорбція консервантів елементами упаковки має місце не лише в процесі виготовлення ліків, але й при їх зберіганні. Тому при визначенні ефективної для консервування концентрації антимікробних речовин мають враховуватися втрати їх активності в часі. Серед чинників, що послабляють антимікробну дію консервантів, слід зазначити наявність у лікарському засобі неіоногенних ПАР, що утворюють комплекси з багатьма консервантами, знижують їх вільну концентрацію і відповідно антимікробний ефект. Для консервування рідких лікарських препаратів можуть використовуватися: бензалконію хлорид, хлорбутол, спирт фенілетиловий, хлоргексидину діацетат або біглюконат, тіомерсал, кислота сорбінова, кислота борна, ронгаліт, ніпагін, ніпазол та ін. Лікарські засоби для внутрішньопорожнинних, внутрішньо-серцевих, внутрішньоочних або інших ін'єкцій з доступом до спинномозкової рідини, а також при разовій дозі, яка перевищує 15 мл, не повинні містити консервантів. Перспективним підходом до вирішення проблеми антимікробного захисту лікарських препаратів є застосування комбінації консервантів. Це дозволить розширити спектр антимікробної дії, застосовувати їх у більш низьких концентраціях, запобігти появі можливих мутантів мікроорганізмів. Ефективним виявилося застосування спирту фенілетилового (0,4 %), ЕТДА (0,05 %) у поєднанні з бензалконію хлоридом, хлорогексидину ацетатом, хло-робутолом; суміші бензалконію хлориду і хлорогексидину. Найчастіше використання консервантів поєднують з іншими методами стерилізації (газовою або стерилізувальною фільтрацією) для приготування в асептичних умовах розчинів, які не потребують теплової стерилізації. Таким чином, вибір консерванту визначається складом лікарського засобу, pH середовищем, режимом його застосування. Лише комплексний підхід і суворе дотримання вимог GMP до виробництва стерильної продукції буде сприяти вирішенню проблеми антимікробного захисту лікарських препаратів. Розчини цілої низки легкоокиснюваних речовин не можуть набути необхідної стійкості при використанні якоїсь однієї форми стабілізації. У цьому випадку необхідно використовувати поєднання стабілізувальних факторів комбінованого захисту. Серед парентеральних препаратів використовуються лікарські форми, що являють собою гетерогенні системи (емульсії, суспен-
зії) і містять дві і більше фаз. Стабільність таких систем пов'язана з двома типами стійкості: — седиментаційної, що характеризується швидкістю осідання або випливання дисперсної фази; — агрегативної, що виявляється в сталості розміру частинок дисперсної фази і характеру розподілення цих частинок в дисперсійному середовищі. Седиментаційна стійкість виражає стабільність дисперсної фази стосовно сили ваги і залежить від інтенсивності теплового руху частинок, впливу на них гравітаційного поля і в'язкості дисперсійного середовища. Седиментаційно нестійкі системи можуть бути агрегативно стійкими, тобто при осіданні твердих частинок не відбувається їх укрупнення за рахунок злипання або, навпаки, агрегативно нестійкими, якщо частинки, злипаються одна з одною, створюючи великі пластівці, що прискорює седиментацію. Якщо агрегативна стійкість утрачається, завислі частинки злипаються одна з одною, утворюючи великі агрегати, що приводить до коагуляції частинок твердої дисперсної фази. У разі рідкої дисперсної фази (емульсії, піни) крапельки або бульбашки її зливаються, і процес називається коалесценцією. При коагуляції або коалесценції втрачається седиментаційна стійкість системи, у результаті відбувається розділення фаз. Агрегативна стійкість залежить від властивостей поверхні або поверхневого шару на межі дисперсної фази і дисперсійного середовища, інакше кажучи, вона залежить від поверхневої енергії або сил, що мають місце в поверхневих шарах. На агрегативну стійкість впливають електростатичний бар'єр, зумовлений силами відштовхування, і абсорб-ційно-сольватний бар'єр, який оточує частинку і перешкоджає зближенню з іншими частинками. Щоб підвищити стабільність гетерогенних дисперсних систем, застосовують стабілізатори, здатні адсорбуватися на поверхні гідрофобних частинок або збільшувати в'язкість дисперсійного середовища. За принципом дії розрізняють стабілізатори-емульгатпори і стабілізатпори-загущувачі. До стабілізаторів лікарських форм гетерогенних дисперсних систем можна віднести похідні метилцелюлози, пектини, альгінати, бентонітові глини, аеросил, твіни, спени і низку інших речовин. Нерідко для зниження кількості цих речовин і підвищення їх активності використовують різні сполучення стабілізаторів природного, синтетичного і напівсинтетичного походження. Фізичні методи стабілізації парентеральних розчинів. Фізичні методи стабілізації також спрямовані на максимальне усунення чинників, що викликають або прискорюють негативні процеси в ін'єкційних розчинах. До технологічних прийомів підвищення стабільності розчинів в ампулах можна віднести:
— додаткову (спеціальну) очистку вихідних речовин або розчинників; — покриття внутрішньої поверхні ампул хімічно стійкими плівками; — використання оптимальних методів і режимів стерилізації; — виготовлення лікарських препаратів у вигляді стерильних порошків або таблеток, з яких готуються ін'єкційні розчини; — попереднє зв'язування (видалення) кисню в розчинниках; — ампулування із застосуванням газового захисту. Для видалення кисню з води можна використовувати електролітичні, хімічні та фізичні методи. Заслуговують на увагу деякі фізичні методи: видалення кисню кип'ятінням; барботажем інертними газами; розпиленням води у вакуумі; дистиляцією води в середовищі вуглекислого газу або азоту. У деяких випадках можливе використання органічних смол для зв'язування розчиненого кисню. В умовах промислового виробництва парентеральних розчинів попереднє зв'язування кисню в розчиннику нераціональне, бо на подальших технологічних стадіях виробництва розчинів в ампулах знову відбувається його насичення. Тому більш доцільним є його видалення безпосередньо перед заповненням ампул. Одним із способів видалення кисню є метод, побудований на зміні розчинності газів у рідинах при різних температурах (від 20 °С до 100 °С), а також використанні водяної пари як інертного середовища. Принцип ампулування розчинів у середовищі інертних газів. У газовому просторі й у розчині міститься достатня кількість кисню, що сприяє окисненню розчинів лікарської речовини. Для одержання стабільних розчинів необхідно максимально замінити повітря на інертний газ в ампулі й видалити кисень із розчину, тому що розчинність газу в рідині змінюється в широких межах у залежності від газу, розчинника, тиску та температури. При цьому розчин попередньо насичується газом, ампули безпосередньо перед заповненням і запайкою продуваються інертним газом. Як інертне середовище використовують вуглекислий газ, азот, аргон. На підставі досліджень під керівництвом професора Ф. A. Ko-нєва (ДНЦЛЗ) розроблена і впроваджена технологія ампулування ін'єкційних розчинів із газовим захистом при використанні вакуумного способу наповнення ампул. Таким чином, стійкість розчинів легкоокиснюваних речовин залежить від багатьох чинників, а їхня стабілізація здійснюється різними технологічними прийомами з дотриманням низки умов. Нижче наведені особливості стабілізації деяких ін'єкційних розчинів. 1. Стпабілізаціярозчинів глюкози. Ін'єкційні розчини глюкози при стерилізації, особливо в лужному склі, піддаються окисненню і карамелізації зі зміною забарвлення розчину.
При виборі стабілізатора для розчину глюкози потрібно враховувати поліфункціональний характер цієї речовини. Глюкоза нестійка в лужному середовищі, під впливом кисню утворюються оксикислоти й оксиметилфурфурол. Але вона нестійка й у кислому середовищі — утворюється D-глюконова кислота та її лактони. У результаті їх окиснення утворюється 5-оксиметилфурфурол, викликаючи пожовтіння розчину, що пов'язано з подальшою кара-мелізацією. Розчини глюкози відповідно до НТД стабілізують реактивом Вейбеля: NaCl — 5,2 г; кислоти HC1 розв. — 4,4 мл; води для ін'єкцій — до 1 л. Стабілізатор Вейбеля додають до розчинів глюкози в кількості 5 % від об'єму незалежно від її концентрації. Введення кислоти хлороводневої до розчинів глюкози запобігає процесам окиснення глюкози в лужному середовищі. Слід зазначити, що теоретичні питання процесу стабілізації глюкози складні і ще не досить вивчені. Останнім часом вважають, що натрію хлорид не сприяє циклізації глюкози, а в сполученні з кислотою хлороводневою створює буферну систему для глюкози, нестабільної в кислому і нейтральному середовищах. 2. Стабілізація розчину кислоти аскорбінової. До легко- При дії кисню вона перетворюється у 2,3-дикетогулонову кислоту, позбавлену С-вітамінної активності. У кислих розчинах при pH = l,0...4,0 кислота аскорбінова розпадається з утворенням альдегіду фурфуролу, що зумовлює жовте забарвлення. Для стабілізації застосовують антиоксидант натрію метабі-сульфіт в кількості 2,0 г на 1 л 5 %-вого розчину й ампулують у струмені вуглекислого газу. Стерилізують текучою парою при 100°С протягом 15 хв. 3. Стабілізація 5, 10 і 20 %-вих розчинів новокаїну. Для ста новокаїну — 50,0 або 100,0 мл; натрію метабісульфіту (або калію метабісульфіту)— 3,0 г; розчину 0,1 моль/л кислоти хлороводневої — 10 мл; Приготування 5 % -вого розчину новокаїну для спинномозкової анестезії готують асептично на цитратному буферному розчиннику з додаванням 1,5 %-вого полівінолу як стабілізатора. 4. Стабілізація 10 і 20 %-вих розчину кофеїн-бензоату на Стабілізують 4 мл розчином 0,1 моль/л натрію гідроксиду на 1 л розчину до pH = 6,8...8,5. 5. Стабілізація 30 %-вого розчину сульфацил-натрію для ін'єкцій. Стабілізують розчином 1 моль/л натрію гідроксиду до pH = 7,5...8,5 натрію метабісульфітом (3 г на 1 л розчину). 6. Стабілізація 10 %-вого суспензії метазіду. її готують в асептичних умовах диспергуванням в середовищі 0,5 %-вого розчину КМЦ і консервують 0,8 %-вим хлоробутанолом. Приготування ін'єкційних розчинів із речовин, що вимагають спеціального очищення. У разі відсутності ґатунку «для ін'єкцій» вихідні речовини піддають спеціальному очищенню від недопустимих домішок (хімічних, механічних і пірогенних речовин). 1. Розчин кальцію глюконату 10 %-вий для ін'єкцій (Solutio У кальцію глюконаті міститься домішка кальцію оксалату як побічний продукт при одержанні речовини, що під час розчинення утворює комплекс із кальцію глюконатом, а при стерилізації і зберіганні випадає в осад. Його видаляють додаванням кристаликів кальцію оксалату як приманки і для підвищення концентрації однойменних іонів. При охолодженні утвориться осад, тому розчин фільтрують у гарячому стані. Його аналізують, перевіряють значення pH, розфасовують і стерилізують парою під тиском при температурі 110°С. При більш високих температурах відбувається карамелізація. Перед уведенням розчину хворому необхідно переконатися, що шприц і голка не містять етанол, тому що в цьому випадку в момент уведення препарату випадає осад. Випускають в ампулах по 10 мл. 2. Розчин глюкози 5, 10, 25 і 40 %-вий для ін'єкцій (Solutio
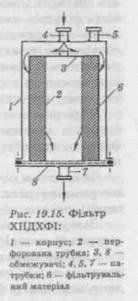
в глюкозі подвійною очисткою вугіллям активованим марки «А». Гідратну глюкозу розчиняють при температурі 50—60 °С і додають вугілля активоване, оброблене кислотою хлороводневою. Для видалення домішок і активування перемішують 10 хв і ще додають вугілля активоване, перемішують, фільтрують через бельтинг і бязь. Потім розчин доводять до кипіння, охолоджують до температури 60 °С, додають вугілля активоване, перемішують 10 хв і фільтрують. До розчину додають стабілізатор Вейбеля (натрію хлорид і розчин 0,1 моль/л кислоти хлороводневої), перемішують, аналізують і фільтрують через фільтр ХНДХФІ, ампулують і стерилізують у паровому стерилізаторі при температурі 100— 102 °С. У розчині перевіряється автентичність, кольоровість, значення pH середовища (3,0—4,0). 5 %-вий розчин при введенні 10 мл на 1 кг маси тварини має бути апірогенним. Перевіряється його стерильність. 3. Розчин желатину медичного 10 %-вого для ін'єкцій (Solutio Gelatinae medicinalis 10 % pro injectionibus) одержують із желатину медичного, перевіряють силу і міцність 10 %-вого геля, відносну в'язкість 14,82 %-вого розчину, проводять бактеріологічні дослідження. Желатин для ін'єкції в розчині 1: 10 не повинен бути каламутнішим від еталона № 3 і витримати випробування на пірогенність при введенні 10 мл його на 1 кг маси тварини. Желатин — це високомолекулярна сполука білкової природи, приготування котрого суттєво відрізняється від інших розчинів. Желатин у вигляді дрібних пластинок поміщають на 20 хв для набухання у воду, переносять у реактор і заливають киплячою водою для ін'єкцій. Після повного розчинення значення pH розчину доводять розчином 1,0 моль/л натрію гідроксиду до 9,0— 9,7 одиниць, а концентрацію речовини — до 10 %-вої, установлюють температуру 80 °С і витримують 40 хв для часткової руйнації домішок білкового характеру і пірогенних речовин. Розчин охолоджують до 60 °С, значення pH доводять до 6,8—7,0, додають 3 білки курячих яєць на 1 л, 3 % вугілля активованого, і перемішують. Температуру підвищують до 105 °С і витримують 15—20 хв. Білкові домішки коагулюють і адсорбують вугіллям. Розчин охолоджують до 90 °С, додають стабілізатор желатину NaCl із розрахунку 0,5 %, фільтрують на друк-фільтрі через 4 шари бязі і шар фільтрувального паперу, потім через фільтр ХНДХФІ з товщиною рівниці 3—4 см, ампулюють по 10 і 25 мл. Стерилізують при температурі 105 °С 30 хв, швидко підвищують її до 120 °С і витримують 15 хв. Після стерилізації ампули поміщають у термостат на 7 діб при 38—40 °С. Розчин не повинен каламутніти. Проводиться аналіз розчину за такими показниками: автентичність, відносна в'язкість, температура плавлення, значення pH, прозорість і кольоровість. Препарат випробовується на піроген- ність і стерильність. Мета технології розчину — максимально видалити пірогенні речовини і білки з антигенними властивостями й одночасно зберегти здатність желатинуватися (гелеутворен-ня). Перед уведенням розчин підігрівається до 37 °С. Натрію хлорид уводять для пониження температури плавлення і застигання желатину. Спеціальному очищенню піддаються ін'єкційні розчини магнію сульфату 20 або 25 %-вого, кальцію хлориду 10 %-вого, гексамети-лентетраміну 40 %-вого, еуфіліну 24 %-вого, кофеїн-бензоату натрію 10 %-вого, натрію цитрату, натрію гідрокарбонату та ін. 19.8.3. ФІЛЬТРАЦІЯ ІН'ЄКЦІЙНИХ РОЗЧИНІВ Джерела механічних забруднень ін'єкційних розчинів. На практиці забруднення ін'єкційних препаратів може відбуватися на всіх стадіях виробництва. Забруднення парентеральних препаратів поділяють на три типи: хімічні (розчинні), мікробні та механічні. Два останні типи забруднень тісно пов'язані між собою: однакові джерела їх походження; їх виявляє одночасно більшість сучасних приладів; аналогічні і методи боротьби з ними. Джерела можливих забруднень мають широкий діапазон. Основними із них є: повітря виробничого приміщення, вихідна сировина і розчинник, технологічне устаткування, комунікації, матеріали первинної упаковки (ампули, флакони, пробки), фільтрувальні перегородки, обслуговуючий персонал. 3 цих джерел в ін'єкційний розчин можуть потрапити частинки металу, скла, ґуми, пластмас, вугілля, волокна азбесту, целюлози і т. д. На всіх твердих частинках можуть бути адсорбовані мікроорганізми. Рівень тяжкості несприятливих наслідків потрапляння сторонніх частинок залежить від їх розміру, природи й кількості. Механічні включення, що знаходяться в ін'єкційному розчині, можуть призвести до утворення тромбів, гранулем, алергічних реакцій та інших патологічних явищ. Так, хризотил, що міститься в азбесті, може бути причиною злоякісних новоутворень. У великих об'ємах внутрішньовенних уливань можуть міститися механічні включення у вигляді волокон целюлози й частинок пластмас, що є причиною утворення мікротромбів у легенях. Із вищесказаного випливає, що введення в регламентні документи різних країн вимог, які обмежують кількість невидимих неозброєним оком механічних частинок, є важливою умовою, що забезпечує високу якість парентерального розчину. Інструментальний контроль вмісту механічних домішок в ін'єкційних розчинах став можливим завдяки використанню оптико-електронних приладів. Для кількісної оцінки вмісту механічних
включень у рідинах набув поширення метод фільтрації через мембранні фільтри, які використовуються і в нашій країні. Основною вадою цього методу є його трудомісткість і велика похибка суб'єктивного виміру. Цих вад позбавлений телевізійний метод завдяки системі PMS фірми «Millipore» для підрахунку й вимірювання частинок, побудований також на процесі фільтрування. Більш сучасним пристроєм для визначення вмісту кількості частинок у розчинах є прилади, робота яких ґрунтується на кон-дуктометричному та фотоелектричному методах реєстрації частинок. У нашій країні на основі фотоелектричного методу розроблений лічильник частинок у рідині типу ГЗ 1. Прилад дозволяє вимірювати частинки діаметром 5—100 мкм. ДФУ визначає механічні включення ін'єкційних і внутрішньовенних інфузійних розчинів як сторонні рухомі нерозчинні частинки, за винятком бульбашок газу, випадково присутні у розчинах і поділяє їх на видимі і невидимі частинки. Для контролю невидимих частинок механічних включень ДФУ пропонує використання приладу, дія якого ґрунтується на принципі світлоблокування і який дозволяє автоматично вимірювати кількість і розмір частинок. Для визначення видимих частинок призначене обладнання візуальної оцінки, яке складається з чорного та білого матового екрану та плафону світильника. Для встановлення природи частинок і їх характеристик застосовують метод мікроскопії, який може вказати на можливе джерело забруднення. Допускаються також інші валідовані методи визначення механічних частинок в розчинах для парентерального застосування, зазначені у відповідних нормативних документах. Отже, нормативно-технічна документація висуває високі вимоги до чистоти ін'єкційних розчинів, що досягається найчастіше їх фільтруванням. Найважливішою частиною будь-якого фільтра є фільтрувальна перегородка, яка має затримувати тверді частинки і легко відокремлювати їх, мати достатню механічну міцність, низький гідравлічний опір і хімічну стійкість. Вона не повинна змінювати фізико-хімічні властивості фільтрату. Забезпечувати можливість регенерації, бути доступною і дешевою. Вимоги, що висуваються до фільтрів і фільтрувальних матеріалів для ін'єкційних та інфузійних розчинів, значно вищі від уже перелічених. Фільтрувальні матеріали повинні максимально захищати розчин від контакту з повітрям; затримувати дуже дрібні частинки і мікроорганізми; мати високу механічну міцність, щоб запобігати виділенню волокон і механічних включень; протидіяти гідравлічним ударам і не змінювати функціональні характеристики; не змінювати фізико-хімічний склад і властивості фільтрату; не взаємодіяти з лікарськими, допоміжними речовинами і розчинниками; витримувати теплову стерилізацію. Фільтрувальні матеріали перед застосуванням повинні бути обов'язково промиті до повного видалення розчинних речовин, твердих частинок або волокон. Вибір фільтрувальних перегородок зумовлюється фізико-хіміч-ними властивостями фільтрованого розчину (розчинювальна здатність рідкої фази, леткість, в'язкість, pH середовища та ін.), концентрацією і дисперсністю твердої фази, вимогами до якості фільтрату, масштабами виробництва тощо. При виробництві розчинів для ін'єкцій та інфузій найчастіше використовують грубе і тонке фільтрування як основне або попереднє, що передує мікрофільтрації і ультрафільтрації. Фільтрувальні перегородки, використовувані для цієї мети, можуть затримувати частинки як на поверхні, так і вглибині фільтрувального матеріалу. У залежності від механізму затримування частинок розрізняють фільтри глибинні (пластинчасті) і поверхневі, або мембранні. Глибинне фільтрування. При глибинному фільтруванні частинки затримуються на поверхні і, головним чином, у товщі капілярно-пористого фільтру. Уловлювання частинок відбувається за рахунок механічного гальмування й утримання в місці перетину волокон фільтрувальної перегородки; у результаті адсорбції на фільтрувальному матеріалі або на ділянці капіляру, що має вигин або неправильну форму; за рахунок електрокінетичної взаємодії. Ефективність фільтра залежить від діаметра, товщини волокна і щільності структури фільтра. Цей спосіб фільтрації доцільно застосовувати для малоконцентрованих розчинів (з об'ємною часткою твердої фази менше 1 %, тому що поступово відбувається закупорювання пор і зростає опір перегородки). Глибинні фільтри виробляються з волокнистого і зернистого матеріалу, тканих, спресованих, спечених або іншим чином з'єднаних матеріалів, які утворюють пористу структуру. Прикладами волокнистих матеріалів натурального походження можуть служити шерсть, шовк, бавовняні тканини, вата, джут, лляна тканина, азбест, целюлозне волокно. Серед штучних волокон можна виділити: ацетатне, акрилове, фторовуглецеве, скловолокно, металеве і металокерамічне волокно, нейлон, капрон, лавсан. У фармацевтичній промисловості, крім того, використовують побутові і технічні тканини: мадаполам, бельтинг, фільтробельтинг, міткаль, фільтроміткаль, хлорин, тканина ФПП, целюлозна тканина типу «Фільтрак».
Із зернистих матеріалів найбільше поширені діатоміт, перліт, вугілля активоване та ін. Діатоміт одержують із кремнеземних панцирів водоростей — діатомей. Перліт — це склоподібна гірська порода вулканічного походження, використовується в основному для виготовлення патронних фільтрів. Зернисті матеріали знайшли своє застосування для фільтрування важкофільтрованих рідин (біологічні рідини, розчин желатину для ін'єкцій і т. д.). Глибинні фільтри і передфільтри, які містять азбестові й скляні волокна, не повинні застосовуватися для парентеральних розчинів із-за можливого виділення шкідливих для організму волокон. Велика поверхня адсорбції може призвести до втрат діючих речовин на фільтрі, а затримання в порах мікроорганізмів — до їх розмноження і забруднення фільтрату. Тому рекомендується такі фільтри експлуатувати не більше 8 год. Мембранне фільтрування. Поверхневе фільтрування відбувається з утворенням осаду на поверхні перегородки. Осад утворює додатковий фільтрувальний шар і поступово збільшує загальний гідравлічний опір просуванню рідини. Роль перегородки у цьому разі полягає в механічному затриманні частинок. До цієї групи належать мембранні фільтри. При мембранному, або ситовому фільтруванні, усі частинки, що мають розмір більший, ніж розмір пор фільтра, затримуються на поверхні. Мембранні фільтри виготовлені з полімерних матеріалів. Фторопластові мембрани стійкі в розведених і концентрованих розчинах кислот, лугів, спиртів, етерів, хлороформу та масел. Нейлонові й поліамідні — у сильних лугах та хлороформі. Поліамідні обмежено сумісні зі спиртами. Заводи-виробники вказують рідини, які не підлягають фільтруванню, і граничні значення pH, що витримують цей матеріал. Для ситового фільтрування використовують мембрани сітчастого типу, які називають ядерними, або капілярно-пористими. Такі мембрани виготовляють із міцних полімерних матеріалів (полікарбонат, лавсан та інших), які піддають бомбардуванню в ядерному реакторі. Товщина таких фільтрувальних перегородок складає 5—10 мкм. Нині у фармацевтичній промисловості за кордоном використовують мембрани сітчастого типу фірми «Нуклепоре» і «Джелман» (із кополімерів акрилонітрилу і вінілілденхлориду та ін.). Мікропористі мембрани використовуються для очищення розчинів, що містять не більше 0,1 % твердих частинок. Ситовий ефект мембранних фільтрів пояснює швидке їх засмічування по відношенню до глибинних. Тому для фільтрування ін'єкційних розчинів найбільш перспективним є поєднання обох типів фільтрувальних середовищ або використання системи серійної фільтрації, коли фільтрувальний розчин послідовно проходить через декілька мембранних фільтрів з розмірами пор, які зменшуються в прогресії. Причому мембранні перегородки мають застосовуватись в заключній стадії очищення, головним чином, для звільнення від дрібних частинок і мікроорганізмів. Конструкції фільтрувальних установок, що використовуються у виробництві ін'єкційних розчинів Серед конструкцій фільтрувальних установок знач При намотці смуги марлевого джгута мають щільно прилягати одна до одної до одержання потрібної товщини фільтрувального шару (40—50 мм). Рідина для фільтрування надходить у патрубок і через шар фільтрувального матеріалу проходить усередину катушки-труби, звідки видаляється через патрубок. Шар марлі затримує частинки розміром 10 мкм. Для затримання частинок розміром 5—7 мкм як фільтрувальний матеріал можуть використовуватися синтетичні волокна на основі полівінілхлориду, фторопласту, поліпропілену. Особливістю цього фільтра є направленість потоку фільтрації. Рідина, що фільтрується, проходить через фільтрувальний шар не перпендикулярно, а під кутом, що збільшує шлях розчину через фільтр і значно поліпшує якість фільтрату. У заводських умовах попереднє фільтрування великих об'ємів ін'єкційних розчинів здійснюють на установках ХНДХФІ, які послідовно містять два або декілька фільтрів ХНДХФІ і працюють під постійним тиском стовпа рідини (висотою не менше 1 м). Регенерацію фільтрувального шару проводять гострою парою протягом 20—30 хв, потім промивають гарячою водою. Серед передфільтрів, працюючих під тиском і вакуумуванням, використовуються друк- і нутч-фільтри. Принцип роботи й обладнання нутч-фільтра полягає в основі фільтра «грибка», який є однією з найпростіших конструкцій, що використовуються для фільтрації невеликих об'ємів ін'єкційних розчинів. Зараз ці фільтрувальні установки використовують для попереднього очищення. Остаточну фільтрацію проводять за допомогою стерильного фільтрування.
Стерильна фільтрація. Під стерильною фільтрацією розуміють звільнення розчинів термолабільних речовин від мікроорганізмів, їхніх спор, продуктів життєдіяльності (пірогенів) за допомогою глибинних і мембранних фільтрувальних перегородок. За конструкцією фільтрувального елемента розрізняють дискові та патронні фільтри. Товщина мембран — 50—120 мкм, діаметр пор — 0,002—1 мкм. Мембранні фільтри можуть працювати під вакуумом і тиском. Основна функція мікропористих перегородок, застосованих у цих випадках, складається з адсорбції мікроорганізмів на великій поверхні, утвореній стінками пор фільтра. Адсорбційна здатність фільтрів може залежати від виду мікроорганізмів, їх концентрації в розчині й умов фільтрування. Стерильній фільтрації обов'язково передує попереднє очищення розчину для ін'єкцій за допомогою глибинних або мембранних фільтрів із відносно великим діаметром пор. Передфільтри затримують механічні частинки і деякі «крупні» мікроорганізми. Фільтри для стерильної фільтрації розрізняють за матеріалом, способом одержання пористої перегородки і її геометричною формою, структурними особливостями пористого мембранного шару тощо. За способом одержання мембрани класифікують на ядерні (із макромономерних плівок), плівкові (із розчинів і розплавів полімерів), порошкові й волокнисті. Залежно від використаного матеріалу мембранні фільтри поділяються на такі види: 1. Мембранні фільтри з природних полімерів. Вихідною си 2. Мембранні фільтри із синтетичних полімерів. Попу із синтетичних полімерів широко використовуються для виробництва патронних фільтрувальних елементів із гофрованою фільтрувальною перегородкою. Виготовляють різноманітні модифікації таких мембран, розрахованих на широкий діапазон об'єктів для фільтрування. Так, фірма «МіШроге» випускає мембрани з полівініліденди-фториду як із гідрофобними, так і з гідрофільними властивостями, що дозволяє використовувати їх для фільтрації води, водних розчинів і органічних середовищ. Фірмою «Расе» випускаються двошарові мембрани з поліаміду, що мають таку унікальну властивість, як природний електрокінетичний потенціал, розмір якого залежить від pH середовища. Позитивний заряд мембран сприяє видаленню з фільтрованих рідин негативно заряджених частинок. Це важливо для звільнення середовищ, які фільтруються, від мікроорганізмів і деяких продуктів їх життєдіяльності, а також мікровключень органічної природи, тому що велика частина цих об'єктів характеризується негативним зарядом. Для фільтрації органічних розчинників використовуються також мікрофільтри з політетрафторетилену, що характеризується високою гідрофобністю. Однак широке їх застосування обмежується порівняно високою вартістю. До цієї групи належать так звані трекові, або ядерні мембрани, одержані опроміненням непористої плівки полімеру важкими металами, іонами або осколками розподілу з наступним хімічним травленням треків. Ці мембрани виготовляються Інститутом експериментальної і теоретичної фізики AH Росії і фірмою «Nuclepore» в США. Ядерні фільтри мають рівномірно розподілені на його поверхні циліндричні пори. Для того щоб запобігти можливості злиття двох сусідніх пор, фірма «Nuclepore» випускає мембрани, пори яких розташовані під кутом 34° одна до одної. Загальновідомо, що швидкість протікання в'язкої рідини через капіляр обернено пропорційна його довжині. Ядерні фільтри най-тонші з усіх і мають невелику довжину капіляра. Ядерні фільтри дозволені Міністерством охорони здоров'я для використання при фільтраційному очищенні крові, рідких лікарських препаратів, розчинів білків, вакцин. 3. Волокнисті мембранні фільтри виготовляють спіканням полімерних волокон і можуть лише умовно бути зараховані до мембранних мікрофільтрів, оскільки за своєю структурою вони наближаються до глибинних волокнистих фільтрів. їхня невелика товщина (-20 мкм), на жаль, не забезпечує необхідної ефективності фільтрації за показником «стерильність». До відносно нового типу мікрофільтрів належать мембрани, що виготовляються у вигляді порожнистих волокон. Фільтрувальні
елементи, які випускаються в таких системах, являють собою пучки параллельно покладених і змонтованих у торцевих фланцях пористих капілярів із розміром від 0,1 до 0,45 мкм, що приблизно в два рази перевищує товщину звичайних мембран. Але при цьому фільтрувальна поверхня патрона висотою 250 мм у 2—4 рази більша від поверхні традиційних гофрованих фільтр-патронів. Порожнисті волокна одержують продавлюванням розплаву або розчину полімеру через насадку певної форми. Цей тип мікрофільтрів може бути дуже перспективним для стерилізуваль-ної фільтрації, однак він потребує додаткового дослідження. 4. Найбільш розповсюджені є так звані плівкові мембрани гли Найпоширенішими матеріалами для виготовлення мембран глибинного типу є різноманітні похідні целюлози, поліаміди, полікарбонати, політетрафторетилен. Мембрани глибинного типу приблизно в 10 разів товстіші від сітчастих, тому кількість адсорбованої ними рідини буде більшою. Перевагою цих фільтрів є нижча швидкість забивання і, отже, більша економічність, ніж у трекових мембран. Мембрани цього типу випускаються практично всіма фірмами, що займаються розробкою і виробництвом мембранних фільтрів. Найбільш відомі фільтри «Владіпор», «Міфіл», «Міліпор», «Сарторіус». 5. Останніми роками розроблено велику кількість композитних керамічних мембран, одержаних методом порошкової металургії. Керамічні мембрани такого типу, як правило, мають вигляд труби з порами близько 15 мкм, виготовленої з чистого алюмінію оксиду, із внутрішньої сторони якої методом порошкової металургії або зольно-гелевим способом наноситься селективний шар алюмінію оксиду товщиною 1 мкм із порами від 10 до 0,1 мкм. Керамічні мембрани стійкі в органічних і водних середовищах при різних значеннях pH, температур, при перепаді тиску і підлягають регенерації. Однак одержання стерильних фільтратів обмежено через малу товщину селективного шару. 6. Металеві мембранні фільтри. До них належать мембрани із срібла, одержані методом порошкової металургії і які випускаються у формі дисків з розміром пор 5; 3,5; 0,8; 0,2 мкм. Перева- гою цих мембран є їх бактеріостатична дія. Срібні мембрани, на жаль, дорого коштують, тому використовуються лише у виняткових випадках. Останнім часом металокерамічні фільтри набули широкого розповсюдження. Вони мають ряд переваг: велику механічну міцність, теплостійкість, відносно високу фільтрувальну здатність. Загальною вадою всіх мембранних фільтрів є їх швидке забруднення мікроорганізмами і як наслідок зниження продуктивності процесу. Запропоновано декілька способів підвищення ефективності фільтрування: — флокуляція мікрочастинок; — застосування ультразвуку; — використання передфільтрів і фільтрів з анізотропною структурою. Флокуляція мікрочастинок відбувається завдяки присутності електричних зарядів на поверхні частинок. Збільшені флокули легко затримуються на поверхні мембрани; крім того, концентраційний шар, утворений із них, здатний затримувати частинки менших розмірів, ніж самі флокули. Подібна взаємодія відбувається між протилежно зарядженими частинками і матеріалом мембрани. Застосування ультразвуку руйнує концентраційний шар на поверхні мембрани, при цьому продуктивність мембран із часом знижується мало, а це підвищує ефективність процесу очищення. Перспективним напрямом боротьби із швидким забиванням пор вважають використання передфільтра, тобто серії послідовно розміщених мембран з поступовим зменшенням розмірів пор, а також застосування фільтрів з анізотропною структурою. Для запобігання утворенню осаду на мембрані і закупорюванню пор може бути використаний метод створення псевдозрідженого шару над поверхнею фільтра. Для цього пропонується використовувати полістирольні або скляні кульки з діаметром 0,3—0,7 мм, при цьому проникність фільтрату збільшується в два рази. Суттєво підвищити продуктивність процесу дозволяє створення тангенціального потоку в поверхні фільтра, як правило, за рахунок обертання фільтрувального елемента. Для стерилізаційної фільтрації рідких лікарських препаратів більш доцільно використовувати фільтрування під тиском, ніж вакуумне. Створення тиску дозволяє підвищити продуктивність процесу, запобігає патьокам всередині системи і направляє кінцевий стерильний продукт безпосередньо в приймач-збірник, оберігаючи розчинник від випарювання. До бактерійних фільтрів також належать так звані керамічні свічки, які мають вигляд порожнистих циліндрів із негла-зурованого фарфору, відкритих з одного кінця. їх одержують
спіканням керамічних порошків із додаванням в'яжучих речовин і пластифікаторів. Ці фільтри мають розмір пор 5—7 мкм. Фільтрування через них проводять двояко: або рідину вводять всередину фільтра і вона, просочуючись через пористі стінки, витікає в стерильну посудину (свічка Шамберлена), або, навпаки, рідина просочується через стінки всередину свічки, і звідти вона виводиться назовні (свічка Беркефельда). Свічка працює під вакуумом (так, як воронки Бюхнера). Вітчизняною промисловістю випускаються керамічні свічки-фільтри ДІКВ (розроблені в Державному інституті керамічних виробів) різної пористості. Для попереднього фільтрування застосовують фільтри Фг і Ф2 (розмір пор 4,5—7 мкм і 2,5—4,5 мкм відповідно); для стерилізації — Фп (0,9 мкм), який затримує мікроорганізми та бактеріальні спори. У зв'язку з проростанням фільтрів (засмоктування мікроорганізмів всередину свічки) необхідне їх періодичне очищення прожарюванням з одночасною стерилізацією сухою парою при температурі 160—170°С протягом 1 год. Скляні фільтри — це пластинки, зварені зі скляних зерен. Фільтри з більшим розміром пор використовуються для попередньої фільтрації. Скляний фільтр № 5 із розміром пор 0,7—1,5 мкм, діючи під вакуумом, використовується для стерильної фільтрації невеликих об'ємів розчинів. Чистота розчину для ін'єкцій та інфузій під час фільтрування може контролюватися за допомогою спеціальних лічильників частинок проточного або періодичного типу. Цей контроль у вітчизняній фармацевтичній промисловості здійснюється візуально. За кордоном випускаються автоматичні аналізатори якості розчинів для парентерального застосування. Після одержання задовільних результатів чистоти розчинів за всіма показниками він передається на стадію наповнення ампул або флаконів. 19.9. АМПУЛУВАННЯ Стадія складається з таких операцій: наповнення ампул (посудин) розчином, запайки ампул або укупорки посудин і перевірки її якості. Наповнення ампул розчином Операція наповнення проводиться в приміщеннях А/В або C класів чистоти з дотриманням усіх правил асептики. Фактичний об'єм наповнення ампул повинен бути більшим від номінального, щоб забезпечити потрібну дозу при наповненні шприца. ДФУ встановлює норми наповнення посудин (табл. 19.6.) Таблиця 19.6 Норми наповнення ампул і флаконів за ДФУ
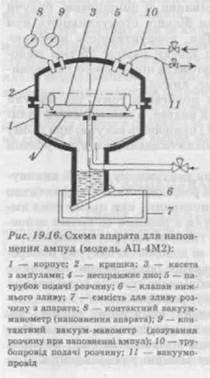
Устаткування для наповнення ампул У технологічному процесі ампулування застосовують два відомі способи наповнення ампул: вакуумний, шприцевий. Вакуумний спосіб набув найбільшого поширення у вітчизняній промисловості. Цей спосіб порівняно зі шприцевим, будучи груповим, має більш ніж у 2 рази більшу продуктивність при точності дозування ±10—15%. Так, продуктивність наповню-вального апарата Маріупольського заводу досягає 25 тис. маломістких ампул за годину, тоді як автомата шприцевого наповнення фірми «Штрунк» — лише 12 тис. ампул. Вакуумний спосіб наповнення полягає в тому, що ампули в касетах поміщають у герметичний апарат, в ємкість якого заливають розчин для наповнення ампул і створюють вакуум; при цьому повітря з ампул відсмоктується, і після скидання вакууму розчин заповнює ампули. Дозування розчину в ампули при вакуумному способі виконується за допомогою зміни величини розрідження, тобто фактично регулюється об'єм, що підлягає заповненню, при цьому сама ампула є дозувальною ємкістю. Ампули з різними об'ємами заповнюються при відповідно створеній глибині вакууму в апараті. Для точного наповнення ампул за допомогою вакууму попередньо визначають величину створюваного розрідження. Звичайно на заводах складаються таблиці необхідного ступеня розрідження в залежності від атмосферного тиску, розмірів ампул і необхідного об'єму наповнення. У тих випадках, коли таких таблиць немає, ампули наповнюють при робочому розрідженні, що дає об'єм наповнення дещо більший і менший від необхідного, і методом інтерполяції розраховують потрібну величину розріждення. При
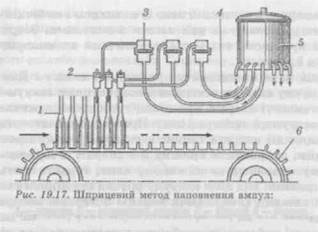
знайденому значенні проводять контрольне наповнення і вимірюють об'єм рідини за допомогою калібрувального шприца. Неспроможність точного дозування розчину — основна вада вакуумного способу наповнення. Серед вад, властивих цьому способові, можна віднести також те, що ампули при наповненні занурюються капілярами в дозований розчин, через який при створенні вакууму проходять бульбашки відсмоктуваного повітря і в ампули потрапляє тільки частина розчину, а решта — залишається в апараті і після циклу наповнення зливається з апарата на перефільтрацію; усе це призводить до додаткового забруднення і неекономної витрати розчину. Крім того, при наповненні забруднюються капіляри ампул, у результаті чого при запаюванні утворюються небажані «чорні» головки від пригару розчину на кінці капіляра. Вадою вакуумного способу наповнення є також і те, що після наповнення до проведення операції запайки ампул проходить значний, порівняно зі шприцевим методом наповнення, проміжок часу, що негативно позначається на чистоті розчину і потребує застосування спеціальних пристроїв для заповнення капіляра інертним газом. За вітчизняною технологією, яка застосовується на сьогодні, між наповненням і запайкою ампул проходить більше 3 хв. Великий проміжок часу створює додаткові умови для забруднення розчину в ампулах механічними частинками і мікрофлорою з навколишнього середовища. До переваг вакуумного способу наповнення ампул, крім високої продуктивності, можна віднести невибагливість цього процесу до розмірів і форми капілярів наповнюваних ампул. За кордоном вакуумний спосіб наповнення ампул застосовується тільки для недорогих препаратів і питних розчинів. Напівавтомат для наповнення ампул АП-4М2 (рис. 19.16) складається з корпусу із закріпленою в ньому ємкістю апарата, усередині якого є несправжнє дно, яке утримується на патрубку для подачі розчину. Патрубок оснащений насадкою з бічними щілинами безпосередньо над верхньою площиною несправжнього днища. Ємкість апарата має нижній злив із клапаном і на бічній стінці — упори для установки на них касети з ампулами. Зверху апарат закритий кришкою, яка має автоматичний пневмопривід для її відкриття і закриття. Нижній злив виведений у приймальну ємкість. Для вимірювання вакууму автомат оснащений контактними вакуум-манометрами. До ємкості апарата приєднані трубопроводи живлення розчином із вакуумної магістралі цеху. Процес роботи автоматизований. Принцип дії апарата такий: в ємкість установлюють касету з ампулами, закривають кришку й в апараті створюють вакуум, при цьому клапаном на нижньому зливі герметизують апарат. Подають розчин. Під дією вакууму розчин струминами надходить із щілин насадки і, омиваючи верхню поверхню несправжнього днища, стікає під нього, змиваючи туди механічні частинки. Потім в апараті створюють необхідне розрідження, що відповідає дозі розчину, який заповнює ампулу, і гасять вакуум. Розчин, що залишився в апараті, зливається в приймальну ємкість і йде на перефільтрацію. Продуктивність напівавтомата — 60 касет за годину. Тривалість циклу наповнення — 50 c. Після наповнення ампул вакуумним способом у капілярах ампул залишається розчин, що заважає якісній запайці і забруднює ін'єкційний розчин продуктами згорання. Розчини з капілярів ампул можна видалити багатьма різними способами: — відсмоктуванням розчину під вакуумом; — продавлюванням розчину стерильним повітрям або інертним газом (у напівавтоматі АП-5М2); — обробкою струменем пари або апірогенною водою. в ампулу типу АП-5М2. У корпусі напівавтомата встановлена ємкість із кришкою. До ємкості приєднані системи живлення стиснутим повітрям, інертним газом, вакуумом; вона також з'єднана з атмосферою. Ємкість має нижній злив. Кришка апарата має привід і запірні пристрої. Цикл роботи автоматизований. В ємкість установлюють касету з ампулами, потім заповнюють фільтрованим повітрям, а далі вакуумом закривають кришку апарата, створюють в апараті тиск. У напівавтоматі можна проводити продавлювання розчину з капілярів в ампули місткістю 1—20 мл. Продуктивність апарата (ампули 1—2 мл) складає 40 тис. ампул за годину. Тиск повітря при продавлюванні розчину становить 195—490 кПа. Шприцевий спосіб наповнення ампул (рис. 19.17) набув поширення за кордоном і здійснюється за допомогою установок із спеціальними дозаторами (поршневими, мембранними та іншими). Метод має більш складне апаратурне оформлення, ніж ваку-
") I I
1 — ампули; 2 — поршневий дозатор; 3 — фільтр; 4 — шланг; 5 — ємкість із розчином для заповнення ампул; в — транспортер умний, і більш жорсткі вимоги до розмірів і форми капілярів ампул, але завдяки ряду переваг він є найкращим для застосування в технології ампулування. Особливо ці переваги виявляються при проведенні операцій наповнення і запайки в одному автоматі. Дата добавления: 2016-03-26 | Просмотры: 946 | Нарушение авторских прав |