|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
РОЗЧИННИКИ ДЛЯ СТЕРИЛЬНИХI АСЕПТИЧНО ВИГОТОВЛЕНИХ ЛІКАРСЬКИХ ЗАСОБІВ Як розчинники лікарських речовин при одержанні ін'єкційних розчинів застосовують воду для ін'єкцій, ізотонічні розчини деяких лікарських речовин і неводні розчинники природного, синтетичного і напівсинтетичного походження, що відповідають вимогам НТД. До розчинників висуваються такі вимоги: висока розчинювальна здатність, необхідна хімічна чистота, фармакологічна індиферентність, хімічна сумісність із лікарськими речовинами, тобто відсутність хімічної взаємодії, стійкість при зберіганні, доступність і дешевизна. Вода — найбільш поширений розчинник для парентеральних препаратів. Вона є найзручнішим із фізіологічної точки зору розчинником, оскільки в кількісному відношенні — це головна складова всіх секретів організму й одночасно основний агент, що транспортує поживні речовини та продукти обміну речовин в організмі.
Відомо, що ряд препаратів через погану розчинність у воді або не можуть застосовуватися в медичній практиці, або значною мірою втрачають свій терапевтичний ефект. До них можна віднести стероїдні сполуки, антисептики, фуранохромони, алкалоїди, глікозиди та ін. Для покращання розчинності препаратів застосовують неводні розчинники: спирти, ефіри, масла (олії) і т. ін. Неводні розчинники поряд з іншими вимогами мають бути малотоксичними, прозорими, мати невелику в'язкість. 19.7.1. ОДЕРЖАННЯ ВОДИ ДЛЯ ІН'ЄКЦІЙ У ПРОМИСЛОВИХ УМОВАХ Згідно з ФС 42-2620—89 вода для ін'єкцій (Aqua pro ingectionibus) повинна задовольняти всі вимоги, висунуті до води очищеної, а також має бути стерильною й апірогенною. Стерильність і пірогенність води визначаються методами, викладеними в статтях «Стерильність», «Шрогени» ДФУ. Вода для ін'єкцій повинна бути вільною від механічних видимих включень, які визначають відповідно до РД 42У-001—93. Для виробництва імунобіологічних, бактерійних і деяких ін'єкційних препаратів не завжди придатна вода для ін'єкцій, отримана дистиляцією. Тому часто виникає необхідність у доочищенні води і одержанні «особливо чистої води для ін'єкцій», тобто висо-коочищеної стерильної, апірогенної, вільної від домішок органічних і неорганічних речовин. її одержують комбінованими методами мембранного розділення на спеціально сконструйованому обладнанні. Обладнання для одержання води очищеної і води для ін'єкцій У промислових умовах одержання води для ін'єкцій і води очищеної здійснюють за допомогою високопродуктивних корпусних апаратів, термокомпресійних дистиляторів різних конструкцій і установок зворотного осмосу. Одним із представників колонних багатокамерних апаратів є багатоступінчасті апарати. Установки подібного типу для одержання води очищеної бувають різної конструкції. Продуктивність великих моделей досягає 10 т/год. Найчастіше застосовуються триступінчасті колонні апарати з трьома корпусами (випарниками), розташованими вертикально або горизонтально. Особливістю колонних апаратів є те, що тільки перший випарник нагрівається парою, вторинна пара з першого корпусу надходить у другий як нагрівник, де конденсується й утворюється вода очищена. 3 другого корпусу вторинна пара надходить у третій як нагрівник, де також конденсується. Таким чином, воду очищену одержують з другого й третього кор- пусів. Продуктивність такої установки до 10 т/год дистиляту. Якість одержаного дистиляту задовільна, тому що в корпусах достатня висота парового простору і передбачене видалення краплинної фази з пари за допомогою сепараторів. Для забезпечення апірогенності отримуваної води необхідно створити умови, які запобігають потраплянню пірогенних речовин у дистилят. Ці речовини нелеткі і не переганяються з водяною парою. Забруднення ними дистиляту відбувається перекиданням крапельок води або виносом їх струменем пари в холодильник. Тому конструктивним вирішенням питання підвищення якості дистиляту є застосування дистиляційних апаратів відповідних конструкцій, в яких виключена можливість перекидання крапельно-рідкої фази через конденсатор у збірник. Це досягається улаштуванням спеціальних пасток і відбивачів, високим розташуванням паропроводів відносно поверхні паротворення. Доцільно також регулювати обігрів випарника, забезпечуючи рівномірне кипіння й оптимальну швидкість паротворення, тому що надмірне нагрівання веде до бурхливого кипіння і перекидання крапельної фази. Проведення водопідготовки знесолюванням також зменшує піно-утворення і, отже, виділення крапельок води в парову фазу. На деяких хіміко-фармацевтичних підприємствах воду для ін'єкцій одержують за допомогою дистилятора «Mascarini» — продуктивність цього апарата 1500 л/год. Він оснащений приладом контролю чистоти води, бактерицидними лампами, повітряними фільтрами, пристроєм для видалення пірогенних речовин, а також установкою подвійної дистиляції води продуктивністю 3000 л/год.
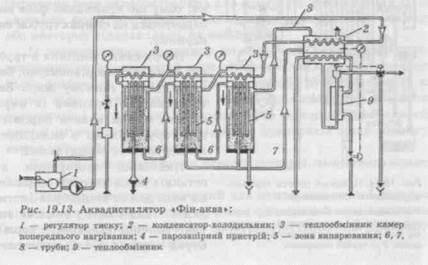
Трикорпусний аквадистилятор «Фін-аква» «Finnaqua-300-S-4» (Фінляндія) функціонує за рахунок використання демінералізованої води (рис. 19.13).
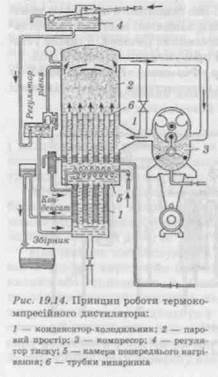
Вода надходить через регулятор тиску в конденсатор, проходить теплообмінники камер попереднього нагрівання, а після нагрівання надходить у зону випарювання, яка складається із системи трубок, що обігріваються всередині нагрівною парою. Нагріта вода подається на зовнішню поверхню трубок, що обігріваються, у вигляді плівки, стікає по них і нагрівається до кипіння. У випарнику за рахунок поверхні киплячих плівок утворюється інтенсивний потік пари, що рухається знизу нагору зі швидкістю 20—60 м/с. Відцентрова сила, що виникає при цьому, забезпечує стікання крапель у нижню частину корпусу, притискаючи їх до стінок. Найбільш досконалами нині є термокомпресійні дистилятори (рис. 19.14), конструкція яких розроблена італійською фірмою «Вопарасе». Ix перевага перед дистиляторами інших типів полягає в тому, що для одержання 1 л води для ін'єкцій необхідно витратити 1,1 л холодної водопровідної води. В інших апаратах це співвідношення складає 1: 9—1: 15. Принцип роботи апарата полягає в тому, що пара, яка утворюється в ньому, перед тим як надійти в конденсатор, проходить через компресор і стискується. При охолодженні і конденсації вона виділяє тепло, за величиною відповідне скритій теплоті пароутворення, що витрачається на нагрівання охолоджувальної води у верхній частині трубчастого конденсатора. Живлення апарата водою здійснюється в напрямку знизу нагору, вихід дистиляту — зверху вниз. Продуктивність дистилятора до 2,5 т/год. Якість одержаної апірогенної води висока, тому що краплинна фаза випаровується на стінках трубок випарника. Нагрівання і кипіння в трубках відбувається рівномірно, без перекидів, у тонкому шарі. Затримуванню крапель із пари сприяє також висота парового простору. Вадами є складність конструкції та експлуатації. Найбільш поширеним до останніх років методом одержання води для ін'єкцій була дистиляція. Такий метод вимагає витрат значної кількості енергії. Серед інших вад слід зазначити громіздкість устаткування і велику площу, що займається ним; можлива наявність у воді пірогенних речовин; складність обслуговування. Цих вад позбавлені методи мембранного розділення, які все більше впроваджуються у виробництво. Вони здійснюються без фазових перетворень і потребують для своєї реалізації значно менших витрат енергії, рівнозначних з мінімальною теоретично обумовленою енергією розділення. Мембранні методи очищення ґрунтуються на властивостях перегородки (мембрани), що має селективну проникність, за рахунок чого можливе розділення без хімічних і фазових перетворень. Завдяки розвитку мембранної технології з'явилася можливість одержати стерильну, апірогенну воду за допомогою ультрафільтра-ційних установок. Такі системи очищення мають стерилізаційну установку, ультрафільтраційні мембрани та установку для озонування води, також можуть бути використані УФ-випромінювачі. Ультрафільтраційні модулі випускають багато закордонних фірм, такі як «Asahi Chemical» (ЯпонДя), «Christ» (Німеччина), «Hoffmann La Roche» (Швейцарія), «Elga» (Великобританія) та ін. Для одержання води для ін'єкцій у практичному відношенні цікаві такі зворотноосмотичні апарати, як «Джерело-600», «СуперК'ю», «Шар'я-500М», «Osmocarb» (Великобританія)таін. В установці «Супер-К'ю» (продуктивністю 720 л/год) вода пропускається через вугільний фільтр, де відбувається звільнення від органічних речовин; потім — через змішаний шар іонітів; після чого надходить на патронний бактеріальний фільтр із розміром пор 0,22 нм (0,22 • 10~9 м). Далі вода надходить на зворотноосмо-тичний модуль, де відбувається видалення пірогенних речовин. Отриману воду використовують для приготування ін'єкційних лікарських форм, а концентрат використовують як технічну воду або повторно відправляють на очищення. Із застосуванням принципу мембранного очищення працює установка високоочищеної води «Шар'я-500М». Продуктивність цього апарата за живильною його водою 500 л/год; одержана на ньому вода — високоочищена, вільна від механічних домішок, органічних і неорганічних речовин. Вона застосовується у виробництві імунобіологічних бактерійних препаратів і для приготування ін'єкційних розчинів. Установка включає блоки передфільтрації, зворотного осмосу і фінішного очищення. Блок фільтрації призначений для очищення питної водопровідної води від механічних домішок розміром 5 мкм і включає один фільтр катіонітний і два фільтри вугільних, що працюють паралельно або взаємозамінно.
Блок зворотного осмосу працює при тискові не нижче 1,5 МПа (15 атм). Вода, що надходить на блок, розділяється після ср'ільт-рування на два потоки: один із яких проходить через зворотноос-мотичні мембрани, а другий потік, що проходить уздовж поверхні мембрани і містить підвищену кількість солей (концентрат), відводиться з установки. Для нормальної роботи цього блока необхідно, щоб співвідношення об'ємів води на подачі, зливі і тієї, що проходить через мембрану, становило 3: 2: 1 відповідно. Таким чином, для одержання 1 л води високоочищеної необхідно витратити приблизно 3 л води водопровідної. При цьому швидкість зливання досить висока, що запобігає шкідливому впливові концентрованої поляризації на роботу установки. У зворотноосмотичному блоці здійснюється очищення води від розчинних солей, органічних домішок, твердих суспензій і бактерій. Якість води контролюється за питомим опором за допомогою кондуктометра. Після блока зворотного осмосу вода надходить в блок фінішного очищення, який включає іонообмін і ультрафільтрацію. Іонообмінне очищення води здійснюється за допомогою послідовно з'єднаних фільтрів — катіонного й аніонного, за якими встановлений змішаний катіонно-аніонний фільтр, де відбувається очищення від катіонів і аніонів, що залишилися. Остаточна доочистка води проводиться в двох ультрафільтра-ційних апаратах із порожнистими волокнами AP-2,0, призначених для відділення органічних мікродомішок (колоїдних частинок і мікромолекул). Більш досконалою установкою є установка зворотного осмосу системи «Rochem» (Німеччина), яка дозволяє одержати воду трьох ступенів очищення: знесолену, очищену апірогенну та особливо чисту для ін'єкцій. Ця система одержання води дозволяє автоматично прокачувати кожні 4 год невикористану воду для збереження її апірогенності і стерильності. Мембранні методи одержання води високоочищенної для ін'єкцій широко застосовуються у світовій практиці і визнані економічно вигідними і перспективними. 19.7.2. ВІДОМОСТІ ПРО ШРОГЕННІСТЬ При парентеральному, особливо при внутрішньосу-динному введенні препаратів, іноді спостерігається швидке підвищення температури тіла до 40 °С. Це явище супроводжується частішанням пульсу, ознобом, потовиділенням, нудотою і головним болем. В особливо важких випадках ці явища призводять до летального кінця. Вони пов'язані з наявністю в розчині пірогенів. Пірогенність мають живі мікроорганізми і продукти їх життєді- яльності, тіла мертвих бактерій, які можуть перебувати в розчинах після стерилізації. Пірогенні речовини прийнято розділяти на екзогенні (в основному бактеріальні) і ендогенні (клітково-тканинні). Джерелом ендогенних пірогенів можуть бути лейкоцити і білки крові, що за певних умов утворюють і виділяють біологічно активні речовини з пірогенними властивостями (лейкопірогени). 3 хімічної точки зору, пірогени — це складні речовини з високою молекулярною масою і розміром частинок від 50 до 1 мкм, які складаються в основному із ліпополісахаридів, адсорбованих на білковому носії. Пірогени розчинні у воді, нерозчинні в спирті й ацетоні, стійкі до дії підвищеної температури. Нагрівання в автоклаві при 120 °С протягом 20 хв приводить до загибелі бактерій, але не знищує пірогени. Чутливість пірогенів до високої температури різна. Зміна pH водного розчину практично не впливає на термолабіль-ність пірогенів. У сухому стані їхнє повне розкладання відбувається лише при температурі 200 °С протягом 30 хв; стерилізація сухим повітрям при 160 °С протягом 2 год не гарантує повної апірогенності. Підвищення температури дозволяє скоротити час, необхідний для знищення пірогенів. При температурі 600 °С досить нагрівання 1 хв, при 450 °С — 2 хв, отже, звільнити від них воду й ін'єкційні розчини термічною стерилізацією практично неможливо. Пірогенні речовини чутливі до дії окисників, наприклад водню пероксиду або калію перманганату. Пірогени мають дуже малі розміри і проходять крізь самі найщільніші фільтри з розмірами пор від 0,005 до 0,001 мкм. Існують різні методи виявлення і видалення пірогенів із розчинів. Методи виявлення пірогенів Для практичних цілей поряд із методами видалення пірогенних компонентів велике значення мають і методи їх виявлення, що поділяються: на хімічні, фізичні і біологічні. Хімічні методи ґрунтуються на проведенні певних кольорових реакцій. Фізичні методи базуються на вимірюванні електропровідності і полярографічних максимумів. Через низку вад перших двох методів найчастіше застосовують методи біопроб, що введені у фармакопеї різних країн світу. Біологічні методи. Дотепер основним і офіційно прийнятим у всіх країнах методом дослідження лікарських засобів на наявність пірогенних домішок є метод, побудований на трикратному вимірюванні температури тіла кролика після внутрішньовенного введення досліджуваного препарату. Підвищення температури на
0,6 °С або більше, відповідно до вимоги фармакопей, вважається доведенням наявності пірогенів. Спеціальні статті фармакопей дають застереження про умови проведення цього дослідження, оскільки чинники — хімічний (корм), фізичний (зміна температури навколишнього середовища), фізіологічний (збудження тварин при анальному вимірюванні температури) — можуть вплинути на результат випробування. I навіть при найбільш суворому дотриманні вимог до проведення випробувань неможливо уникнути випадкових помилок, пов'язаних з індивідуальною чутливістю тварин до пірогену і препарату, різними кліматичними умовами, часу постановки досліду тощо. Все це може відбитися на показниках температури, яка вимірюється з точністю до ±0,1 °С. Відповідно до даних різних фармакопей, доза того самого препарату в ряді випадків коливається в широких межах. Дуже часто при рівних або дуже близьких дозах препаратів об'єми розчинів, які вводяться, відрізняються в п'ять разів. Відзначено, що спостерігається великий розрив між дозами для кроликів і людини. Нерідко ці дози відрізняються в 100—6000 разів. На думку вчених, що вивчали це питання, тест-доза препарату при дослідженні пірогенності повинна підбиратися індивідуально, ураховуючи фармакологію, переносимість кроликом, і орієнтовно повинна складати 1/10 максимальної добової дози для людини. Існує варіант умов визнання препарату пірогенним або апіро-генним: воду або розчин лікарського засобу вважають апіроген-ними, якщо сума максимальних підвищень температур у трьох кроликів не перевищує 1,2 °С; і пірогенним, якщо вона дорівнює або більша 2,2 °С. Якщо сума підвищень температури в трьох кроликів більша 1,2 °С, але менша 2,2 °С, то випробування повторюють на п'ятьох кроликах. Воду або розчин лікарського засобу вважають пірогенним, якщо сума підвищень температури у восьми кроликів дорівнює або більша 3,8 °С, у противному разі — апіро-генним. Бактеріальні ендотоксини. Крім зазначених пірогенних речовин, ДФУ виділяє бактеріальні ендотоксини, джерелом яких є грамнегативні мікроорганізми. Ендотоксини є найбільш розповсюдженою причиною пірогенних токсичних реакцій, їх активність набагато вища за активність більшості інших пірогенних речовин. За хімічною структурою ендотоксини є ліпополісахаридами. Незважаючи на те, що існує незначна кількість іншої хімічної природи, зазвичай саме відсутність бактеріальних ендотоксинів у лікарському засобі має на увазі відсутність пірогенних компонентів. Останнім часом помітного поширення одержує метод дослідження лікарських засобів на пірогенність in vitro з використанням лізату амебоцитів мечохвоста Лімулюс. Цей метод (ЛАЛ-тест) має ряд переваг: він чутливіший в 5—10 разів, результат отримується швидше, можливе кількісне визначення пірогену. Крім того, з його допомогою став можливим контроль препаратів, які не можна випробовувати на кроликах. Однією із вад цього методу є його специфічність по відношенню до ендотоксинів грамнегатив-них мікроорганізмів, тобто небезпека не виявити присутності у лікарських засобах пірогенів іншого походження. Дата добавления: 2016-03-26 | Просмотры: 661 | Нарушение авторских прав |