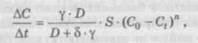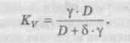|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ТЕОРЕТИЧНІ ОСНОВИ ПРОЦЕСУ РОЗЧИНЕННЯРозчинення — спонтанний дифузійно-кінетичний процес, який відбувається при зіткненні речовини, що розчиняється, з розчинником. У фармацевтичній практиці розчини одержують із твердих, порошкоподібних, рідких та газоподібних речовин. Як правило, одержання розчинів із рідких речовин, взаєморозчинних або таких, що змішуються між собою, відбувається без особливих труднощів, як просте змішування кількох рідин. А от розчинення твердих речовин, особливо тих, що розчиняються повільно і важко, є складним і трудомістким процесом. У процесі розчинення можна виділити умовно кілька стадій:
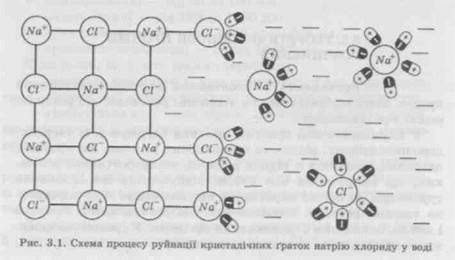
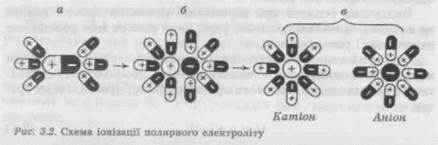
1. Поверхня твердого тіла контактує з розчинником. Контакт супроводжується змочуванням, адсорбцією і проникненням розчинника в мікропори частинок твердого тіла. 2. Молекули розчинника взаємодіють із шарами речовини на поверхні розділення фаз. При цьому відбувається сольватація молекул або іонів і відрив їх від поверхні розділення фаз. 3. Сольватовані молекули або іони переходять у рідку фазу. 4. Вирівнювання концентрацій в усіх шарах розчинника. швидкості дифузійних процесів. Друга й третя стадії часто відбуваються миттєво або досить швидко і мають кінетичний характер (механізм хімічних реакцій). Із цього випливає, що швидкість розчинення залежить переважно від характеру дифузійних процесів. 3.2.1. РОЗЧИНИ ТВЕРДИХ РЕЧОВИН Більшість твердих речовин є кристалічними. Розчинення кристалічної речовини складається з двох процесів, що відбуваються одночасно: сольватації (у даному випадку гідратації) частинок і руйнування кристалічних ґраток. На рис. 3.1 показано процес розчинення натрію хлориду (кристалічна іонна сполука) у воді (полярна рідина). Іон натрію хлориду взаємодіє з дипольними молекулами води: до позитивного іону Na+ диполі звернені своїми негативними полюсами, а до негативних іонів СГ — позитивними. Поступово диполі води проникають між іонами Na+ і СГ у твердій фазі, відриваючи їх від кристалу. Для ефективності розчинення важливо, щоб сили зчеплення між молекулами розчинника і частинками речовини, що розчиняється, були більшими за сили взаємного притягання цих частинок між собою. Вода порівняно з іншими розчинниками має велику полярність (найвище значення діелектричної сталої). Саме цією властивістю зумовлюються висока іонізаційна здатність води та її руйнівна дія на кристалічні ґратки багатьох полярних сполук. При розчиненні речовин спостерігається поглинання або виділення теплоти. Поглинання теплоти вказує на витрачання енергії. Пояснюється це тим, що для переходу речовини з твердого стану в рідкий, тобто для розчинення кристалічних ґраток, обов'язково потрібна енергія. Наприклад, іони натрію та хлору до розчинення натрію хлориду у воді фіксовані у вузлах кристалічних ґраток, мають при цьому тільки обертові й коливальні рухи. Після розчинення іони починають відносно вільно рухатися всередині розчину, а для цього необхідне збільшення їхньої кінетичної енергії. Саме це й відбувається за рахунок відбирання енергії в розчинника у формі теплоти, внаслідок чого відбувається охолодження розчину. Чим міцніші кристалічні ґратки, тим значніше охолодження розчину. Виділення теплоти при розчиненні речовини завжди вказує на активну сольватацію, тобто утворення сполук між розчинною речовиною і розчинником. Кінцевий тепловий ефект розчинення Q потрібно розглядати як суму двох складників — позитивного теплового ефекту сольватації q і негативного теплового ефекту руйнації кристалічних ґраток c: Q = q + (-c). (3.1) Знак теплового ефекту розчинення залежатиме від того, який складник переважає. Якщо кристалічні ґратки міцні, складник -c чисельно більший від q; у цьому разі розчинення речовини відбувається з поглинанням теплоти. I навпаки, у речовин зі слабкими кристалічними ґратками і сильно сольватованих (гідрато-ваних) превалює складник q; при цьому розчинення відбувається з виділенням теплоти. Часто позитивний і негативний теплові ефекти розчинення виявляються однаковими або дуже близькими; у таких випадках при розчиненні ми не спостерігаємо охолодження або розігрівання розчину. Тепловий ефект розчинення відносять до 1 моля речовини, що розчиняється в досить великій кількості розчинника. 3 поглинанням теплоти розчиняються KN03 [Q = -35,66 кДж/(г«моль)], KI (-21,39), NaCl (-5,02), NaBr (-0,79) і багато інших кристалічних речовин. 3 виділенням теплоти розчиняються AgNOg [Q = = +22,6 кДж/(г*моль)], NaOH (+41,86) та деякі інші речовини. При розчиненні кристалогідратів у воді спостерігається більш низький тепловий ефект, ніж при розчиненні безводної солі. Наприклад, теплота розчинення безводного СаС12 дорівнює +72,88 кДж/ (г'моль), а СаС12«6Н20 складає -18,04 кДж/(г«моль). Різниця (+72,88) - (-18,04) = 90,92 кДж є теплотою утворення кристалогідрату. 3.2.2. РОЗЧИНИ РІДКИХ РЕЧОВИН Рідини здатні по-різному змішуватись одна з одною — від повної нерозчинності до змішування в будь-яких кількісних співвідношеннях. У формі водних розчинів звичайно застосовують рідкі лікарські речовини, що мають повну взаємну розчинність, але можуть бути прописані й речовини з обмеженою розчинністю у воді. У разі розчинення полярних сполук відбуваються гідратація полярних молекул та дисоціація їх у розчині на вільні гідратовані іони (рис. 3.2). Наприклад, так поводяться молекули HC1, що дисоціюють у водних розчинах на вільні гідратовані іони Н+ і C1".
При розчиненні неорганічних кислот у воді спостерігається виділення теплоти. Наприклад, теплота розчинення H2S04 дорівнює +92,38 кДж/(г • моль), HC1 — +75,09 кДж/(г • моль), HN03 — +33,28 кДж/(г*моль). Очевидно, що у всіх цих випадках позитивний ефект гідратації значно вищий за негативний тепловий ефект руйнації асоціатів молекул. Аналогічна картина спостерігається і при розчиненні етилового спирту у воді. При розчиненні рідин у рідині помітніше, ніж при розчиненні твердих речовин у рідині, відбувається збільшення або зменшення сумарного об'єму. Збільшення сумарного об'єму звичайно залежить від руйнації асоціатів молекул. Зменшення сумарного об'єму (стиснення, концентрація) найчастіше спричиняється утворенням сполук між рідинами, що змішуються. Зміна об'єму розчину, якщо вона викликана його самоохоло-дженням або саморозігріванням, має тимчасовий характер, тому її слід враховувати під час готування розчинів заданого об'єму. Уперше дифузійний механізм розчинення описав A. M. Шу-карєв у 1896 році. За його рівнянням швидкість процесу залежить від різниці концентрацій і поверхні розділення фаз. Сучасна теорія про розчинення твердих тіл ґрунтується на уявленні про цей процес як про кінетику гетерогенних процесів, під час яких можуть проявлятися і дифузійні, і міжфазні процеси (хімічні). Ця теорія розвинута в наукових працях О. Б. Здановського, M. Товдіна, О. Брама та ін. Відправним положенням дифузійно-кінетичної теорії слід вважати наявність пограничного дифузійного шару і його вплив на зміну швидкості процесу. Кінетика процесу розчинення описується таким рівнянням:
де D — коефіцієнт дифузії; Y — коефіцієнт швидкості міжфазного процесу; 8 — ефективна товщина пограничного дифузійного шару, м; S — поверхня твердої фази, м2; С0 — концентрація насиченого розчину, кг/м3; Ct — концентрація розчину на даний момент, кг/м3;
— кількість речовини, яка розчинилася за одиницю часу (швидкість розчинення), кг/с; n — порядок реакції розчинення. У воді майже для всіх лікарських речовин дорівнює одиниці (кінетична область розчинення). Константа швидкості розчинення Kv при сталому об'ємі рідкої фази визначається за формулою
ТИПИ РОЗЧИНЕННЯ Залежно від співвідношення дифузійних і кінетичних (міжфазних) механізмів можливі три основні типи розчинення: 1. Дифузійний у» D/ 5, тобто Kv -^ D/ 5. 2. Кінетичний у «D/ 5, тобто Kv -^ у. 3. Дифузійно-кінетичний, якщо значення коефіцієнта швидкості міжфазного і дифузійного процесів порівнювані. На виробництві розчинення бажано проводити в кінетичній області, прискорюючи дифузійні процеси перемішуванням рідкої
фази. Однак для повільно- і важкорозчинних речовин міжфазний процес відбувається навіть при інтенсивному перемішуванні. Змочування твердого тіла залежить від полярності поверхні та розчинника. Гідрофільні і гідрофобні властивості поверхні можуть змінюватися внаслідок адсорбції повітря, вологи або домішок. На змочування і проникнення розчинника у пори впливають також пористість і шорсткість поверхні, наявність дефектів кристалічних ґраток й мікротріщин. Для кращого змочування і для запобігання адсорбції здрібнення доцільно проводити в середовищі розчинника, іноді з додаванням поверхнево-активних речовин. Вступаючи в контакт при змочуванні, молекули чи іони твердої фази і розчинника починають взаємодіяти, утворюючи відповідні сольвати або їх асоціати. У близьких за властивостями і структурою розчинних системах (наприклад сполуки гомологічного ряду або ізомери між собою майже не взаємодіють) властивості розчинених речовин і розчинника зберігаються, змінюється лише концентрація речовини в розчині і може змінитися агрегатний стан. Однак частіше між розчинником і поверхневими молекулами твердих тіл утворюються водневі зв'язки, відбувається міждипольна взаємодія. Це приводить до утворення сольватів, асоційованих комплексів із різним ступенем стійкості та до дисоціації комплексів і молекул на іони. У таких розчинах розчинна речовина і розчинник знаходяться в зміненому стані порівняно з початковим. ТЕОРІЯ ГІДРАТАЦІЇ За молекулярно-кінетичною теорією гідратації при розчиненні речовин, що дають частинки з досить високою густиною заряду (іони Li, Ca, Mg, F та ін.), молекули розчинника, які знаходяться навколо цих частинок, притягуються, їх рухливість зменшується, уповільнюється обмін з іншими молекулами. Це явище одержало назву позитивної гідратації. Деякі іони, такі як K, Na, Rb, Cs, Br, I, C1, неначе відштовхують молекули розчинника, що спричиняє збільшення обміну між найближчими молекулами у порівнянні з чистим розчинником, зростає невпорядкованість молекул розчинника. У цьому разі відбувається негативна гідратація. Встановлено, що вона можлива тільки у певному інтервалі температур. При досягненні граничних температур негативна гідратація переходить у позитивну. Наприклад, для іонів Na, Cs, C1,1 ці температури відповідно дорівнюють 11, 89, 27, 75 °С. Це пояснюється тим, що з підвищенням температури зростає тепловий рух молекул розчинника. Різноманітність взаємодій настільки велика, що досі немає єдиної теорії розчинів. Однак сучасні уявлення про процес розчинення дозволяють на наукових засадах трактувати біофармацевтичні закономірності в зміні біологічної доступності і терапевтичної активності лікарських речовин у розчинах залежно від діелектричної проникності, наявності постійних та індукованих дипольних моментів, по-ляризованості іонів та молекул розчиненої речовини. У технології розчинів стає зрозумілою роль вибору середовища або додавання електролітів, високомолекулярних сполук, поверхово-активних речовин тощо. При розчиненні руйнуються зв'язки між молекулами або іонами в розчинній речовині та розчиннику, що пов'язано із витрачанням енергії. Водночас починається процес комплексоутворен-ня, тобто виникають нові зв'язки між молекулами та іонами, утворюються сольвати. Процес супроводжується виділенням енергії. Загальна енергетична зміна в системі може бути позитивною або негативною. Так, при розчиненні спирту й води, багатьох лугів, кислот та інших речовин у воді виділяється теплота, тому додаткове нагрівання призводить до зменшення розчинності. Якщо розчинення супроводжується поглинанням теплоти, нагрівання збільшує розчинність. Іноді розчинність супроводжується зміною сумарного об'єму (явище контракції) при відмірюванні метанолу, етанолу, гліцерину та інших спиртів з водою. Очевидно, що цим процесом можна керувати, варіюючи різні технологічні фактори. Так, для збільшення швидкості розчинення (рівн. 3.1) можна змінити температурний режим, збільшити різницю концентрацій, зменшити в'язкість і товщину пограничного дифузійного шару шляхом зміни гідродинамічних умов, здрібнити вихідну речовину, збільшуючи таким чином поверхню контакту з розчинником. Для реалізації цих можливостей технологічний процесздійснюють у реакторах, які мають оболонку для обігрівання парою або для охолодження системи розсолом і перемішувальне обладнання. Інтенсивне перемішування зменшує товщину пограничного дифузійного шару. Дата добавления: 2016-03-26 | Просмотры: 1070 | Нарушение авторских прав |