|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СТВОРЕННЯ УМОВ ДЛЯ ВИРОБНИЦТВА СТЕРИЛЬНОЇ ПРОДУКЦІЇДля створення оптимальних умов, що забезпечують випуск високоякісних лікарських препаратів, останнім часом розроблені вимоги до виробництва стерильної продукції, що викладені в GMP Всесвітньої організації охорони здоров'я (ВООЗ) «Sterile pharmaceutical products» (1992), GMP Європейського Союзу (ЄС) «Manufacture of sterile medicinal products» (1997), методичних вказівках (MB) 64У-1—97 «Производство лекарственных средств. Надлежащие правила и контроль качества», галузевому нормативному документі (ГНД) 01.001.98 GMP «Належна виробнича практика GMP» (1998), книгах «Надлежащая производственная прак-тикалекарственных средств» (1999, 2001), Настанові 42—01—2001 тощо. Належна виробнича практика (НВП) — це частина системи забезпечення якості, яка гарантує, що продукція виробляється і контролюється за стандартами якості і відповідає її призначенню. В Україні схвалений до виконання варіант, основою якого є GMP ЄС, а перехід до виробництва лікарських засобів у відповідності з принципами і правилами GMP у нашій країні проходить поетапно. Для забезпечення всіх показників якості готової стерильної продукції мають створюватись спеціальні умови, рекомендовані для проведення технологічного процесу, чистоти виробничих приміщень, роботи технологічного устаткування, вентиляції і чистоти повітря, системи підготовки основної сировини і допоміжних матеріалів для зниження до мінімуму ризику контамінації мікроорганізмами, частинками або пірогенними речовинами. Висуваються також певні вимоги до персоналу, спецодягу і виробничої санітарії. Дотримання цих правил залежить, у першу чергу, від належної кваліфікації, освіти, рівня практичного досвіду і виробничої дисципліни всього персоналу. 19.2.1. ЗАГАЛЬНІ ВИМОГИ ДО ВИРОБНИЦТВА СТЕРИЛЬНОЇ ПРОДУКЦІЇ. КЛАСИ ЧИСТОТИ ВИРОБНИЧИХ ПРИМІЩЕНЬ Виробництво ПЛЗ здійснюють на спеціальних, тільки для цих цілей призначених ділянках. Обладнання цих приміщень має забезпечувати мінімум можливого забруднення готового продукту виробництва, тобто мінімум місць скупчення пилу, подачу повітря контрольованої чистоти, підтримку підвищеного
«Чисте» приміщення може містити одну або декілька «чистих» зон. «Чисті» зони можуть бути і поза «чистим» приміщенням. «Чисті» зони можуть створюватися в локальних об'ємах: ламінарні шафи, модулі, ізолятори, блоки та ін. Важливою характеристикою «чистого» приміщення є його клас. Клас «чистого» приміщення характеризується класифікаційним числом, що визначає максимально допустиму облікову концентрацію аерозольних частинок зазначеного розміру в 1 м3 повітря. Для одержання повітря з необхідними характеристиками повинні бути використані способи, що пройшли валідацію, унесені в технологічний регламент і дозволені в установленому порядку уповноваженим державним органом. Вологість і температура повітря можуть змінюватися залежно від вимог технологічного процесу. Однак при вологості вище 50 % починається корозія металевих деталей, тому що гігроскопічні частинки поглинають із повітря стільки вологи, що стають ініціаторами корозії. При низькій відносній вологості на діелектричних металах може накопичуватися статичні заряди, а отже, можуть утримуватися частинки пилу. Виробництво стерильних лікарських засобів має здійснюватися в «чистих» виробничих зонах, а доступ персоналу, обладнання і матеріалів до них може відбуватися лише через повітряні шлюзи. У цих зонах має підтримуватися належний ступінь чистоти, що регламентується правилами GMP, а вентиляційне повітря, яке надходить,— проходити очищення з використанням фільтрів відповідної ефективності. Різні операції з підготовки компонентів, готування продукту і наповнення посудин повинні виконуватися в окремих зонах усередині «чистого» приміщення. Для виробництва стерильних лікарських засобів відповідно до необхідних характеристик повітря у функціонуючому і оснащеному стані виділяють чотири класи (табл. 19.1). «Оснащений» стан — це стан, при якому система «чистого» приміщення виробничого обладнання повністю підготовлена до роботи, але персонал відсутній. «Функціонуючий» стан — це стан, при якому система «чистого» приміщення й обладнання функціонує в установленому режимі з певним числом працюючого персоналу. Таблиця 19.1 Класифікація чистих зон за максимально допустимою кількістю частинок в повітрі, шт./м3
КласА. Локальні зони для технологічних операцій, що потребують найменшого ризику контамінації, наприклад зони приготування лікарських форм, наповнення, закупорки, вскриття стерильних ампул і флаконів, змішування інґредієнтів в асептичних умовах. Умови класу А передбачають робоче місце з ламінарним потоком повітря (0,45±20 %) м/с. Клас В. Навколишнє середовище для зони А в разі приготування, наповнення первинної тари та герметизації її в асептичних умовах. Класи C і D. «Чисті» зони для ведення технологічних операцій, які допускають більш високий ризик контамінації при виробництві стерильної продукції, що доцускає стерилізацію в первинній упаковці. Допустима кількість частинок у 1 м3 повітря «чистого» приміщення в оснащеному стані повинна досягатися після короткого періоду санітарного прибирання протягом 15—20 хв після завершення технологічних операцій за відсутності персоналу. Допустима кількість частинок для «чистої» зони класу А у функціонуючому стані має підтримуватися в зоні, що безпосередньо оточує продукцію, і коли на продукцію або відкриту ємкість впливає навколишнє сереДовище. Виробництво стерильної продукції в залежності від c п о c о б у д о c я г н e н н я c т e p и л ь н о c т і поділяють (табл. 19.2): — на виробництво, що передбачає фінішну стерилізацію, при якому продукція остаточно стерилізується в герметичній первинній тарі; — виробництво, яке здійснюють в асептичних умовах на одному або всіх етапах приготування препарату. Для досягнення відповідних класів чистоти потрібна така кратність повітрообміну, яка враховує розмір приміщення, кількість наявного в ньому устаткування та чисельність персоналу. Для підтвердження класу чистоти зон у функціонуючому стані необхідно періодично здійснювати мікробіологічний контроль
Таблиця 19.2 Приклади операцій, які потрібно виконувати в зонах різних типів
із використанням методу седиментації на пластини, добору проб як повітря, так і з поверхонь обладнання (табл. 19.3). Таблиця 19.3 Рекомендовані межі для підтвердження класу чистоти при мікроскопічному контролі «чистих» зон у функціонуючому стані в колонієутворюючих одиницях (КУО),
19.2.2. ВИМОГИ ДО ВИРОБНИЧИХ ПРИМІЩЕНЬ Виробничі приміщення необхідно проектувати, розташовувати, пристосовувати, оснащувати, обслуговувати таким чином, щоб вони відповідали своєму призначенню, забезпечували можливість проведення ефективного прибирання й експлуатації для запобігання мікробної і перехресної контамінації, а також інших чинників, що можуть негативно вплинути на якість продукції. При проектуванні, будівництві й реконструкції виробничих приміщень їхнє об'ємно-планувальне вирішення і розташування устаткування мають відповідати вимогам державних будівельних норм (ДБН) та інших законодавчих актів України. Приміщення (у тому числі виробничі, склади для зберігання, санітарно-побутові) мають бути об'єднані в окремі функціонально-технологічні блоки, а за необхідності — з автономними системами інженерного забезпечення. Приміщення для виробництва мають використовуватися суворо за призначенням і бути досить просторими, щоб звести до мінімуму ризик змішування різних лікарських засобів, перехресне забруднення або пропуск однієї зі стадій технологічного процесу. Вони повинні містити мінімально необхідну для ведення виробничого процесу кількість устаткування. Приміщення слід розташовувати відповідно до послідовності технологічного процесу і класів чистоти. Не допускається прилягання приміщень класів чистоти А, В, C, D до зовнішніх огоро-джувальних конструкцій. Приміщення більш високого класу чистоти необхідно розташовувати всередині приміщень більш низького класу. «Чисті» зони треба проектувати так, щоб запобігти можливості вільного доступу до них персоналу, який спостерігає за процесом або його контролює. Доступ персоналу і (або) надходження вихідної сировини, матеріалів, напівпродуктів і устаткування в «чисті» приміщення дозволяється тільки через повітряні шлюзи, які забезпечуються подачею стерильного повітря в напрямку «вниз». Різні операції з підготовки компонентів, приготування продукту і наповнення посудин мають виконуватися в окремих зонах усередині «чистого» приміщення. Різні двері повітряних шлюзів не можна відчиняти одночасно. Щоб запобігти відчиненню більш ніж одних дверей установлюють системи блокування або звукової сигналізації. Суміжні приміщення з іншими класами чистоти повинні мати різницю в тискові 10—15 Па. У кожному «чистому» приміщенні має функціонувати сигнальна система, що попереджує про порушення або припинення процесу подачі стерильного повітря. Стіни, підлога, стеля мають бути гладкими, легко очищатися, а сполучення стін між собою і стін із підлогою повинні мати заокруглення радіусом 300 мм, а для надійної герметизації стиків усіх конструктивних елементів слід використовувати пружні прокладки і спеціальні будівельні герметики, що не виділяють пилу. Стіни «чистих» приміщень можуть покривати пластмасами або емалями. У «чистих» зонах усі відкриті поверхні повинні бути гладкими, непроникними і неушкодженими, щоб звести до мінімуму утворення і накопичення пилу і мікроорганізмів, а також забезпечити можливість багаторазового застосування очищувальних і дезінфі-кувальних засобів. Матеріали, які використовуються при оздобленні виробничих приміщень, мають бути такими, що не порошать,
не горять, легко миються і стійкі до впливу дезінфікувальних речовин. Після завершення технологічних робіт приміщення слід обробляти дезінфікувальними засобами й УФ-опроміненням. До систем комунікацій виробничих приміщень висуваються також певні вимоги: проектування систем внутрішнього водопостачання, каналізації тощо слід виконувати відповідно до діючих норм і правил. Так, трубопроводи мають бути виготовлені з нержавіючої сталі або інших корозійностійких матеріалів з урахуванням можливості їхньої стерилізації; мати нахил униз для повного стікання рідини і не містити ділянок, в яких може застоюватися рідина, що переміщається. Стаціонарні трубопроводи повинні бути чітко марковані з указівкою їхнього вмісту, а за необхідності має бути зазначений напрямок потоку. Заборонено встановлювати раковини і стоки в зонах класу А/В, в інших зонах між устаткуванням і раковиною або стоком повинні бути повітряні простори. Підлогові стоки мають бути обладнані сифонами або водяними затворами для запобігання зворотного потоку. Приміщення для підготовки до роботи персоналу повинні бути сконструйовані як повітряні шлюзи і використовуватись таким чином, щоб забезпечити розподіл різних етапів перевдягання і тим самим звести до мінімуму можливість забруднення технологічного одягу мікроорганізмами і механічними частинками. У таких санпропускниках мають знаходитися ємкості, що закриваються, для використаного технологічного одягу, а також мийні і дезінфі-кувальні засоби для миття й обробки рук. Остання частина кімнати для перевдягання в оснащеному стані повинна мати той же клас чистоти, що й зона, в яку вона веде. Підготовка виробничих приміщень — одне з найважливіших заходів щодо забезпечення чистоти і зведення до мінімуму механічних і мікробних забруднень. Під санітарною підготовкою виробничих приміщень мають на увазі комплекс заходів, що складається з вологого прибирання, дезінфекції й УФ-опромінення, спрямований на досягнення відповідного класу чистоти. Прибирання виробничих приміщень слід проводити щозміни, а генеральне прибирання — один раз у 5—6 днів або негайно на вимогу бактеріолога. Дезінфекція приміщень і поверхонь обладнання приводить, як правило, до зниження мікроорганізмів на 40—60 % від їх початкового вмісту. При виборі дезінфікувальної речовини необхідно враховувати не тільки її бактерицидні властивості і спектр дії, але й можливу токсичність для людини. Рекомендується під час прибирання застосовувати 2—6 % -вий розчин водню пероксиду, 1 %-вий розчин дегміну, 0,5 %-вий розчин хлорогексидину бі-глюконату, розчини рецептури «C4» і «Стериліум» або інші спеціальні дезінфектанти і детергенти. Однак тривале використання якогось дезінфікувального засобу призводить до утворення стійких штамів мікроорганізмів. Тому рекомендують дезінфікуваль-ний засіб змінювати кожні 10—14 днів або застосовувати декілька типів. Мийні та дезінфікувальні засоби, які використовуються в зонах А і В, мають бути стерильними, а для зниження мікробіологічної контамінації в недоступних місцях може бути використана фумігація «чистих» зон. 19.2.3. ЗАБЕЗПЕЧЕННЯ ВИРОБНИЧИХ ПРИМІЩЕНЬ ЧИСТИМ ПОВІТРЯМ Повітря виробничих приміщень — потенційне джерело забруднення ліків, тому його очищення є одним із ключових завдань підготовки виробництва. Рівень чистоти повітря, що знаходиться в приміщенні, визначає клас чистоти. Для одержання повітря з необхідними характеристиками мають використовуватись способи, які пройшли валідацію, унесені в технологічний і технічний регламенти і дозволені за встановленим порядком уповноваженим державним органом. Для забезпечення виробництва стерильних препаратів знепи-леним стерильним повітрям використовують як звичайні системи турбулентної вентиляції, які забезпечують стерильність повітря в приміщенні, так і системи з ламінарним потоком повітря по всій площі приміщення або в певних робочих зонах. При турбулентному потоці очищене повітря містить до 1000 частинок у 1 л, при подачі повітря ламінарним потоком по всьому об'єму приміщення вміст частинок у повітрі в 100 разів менше. Приміщення з ламінарним потоком — це такі приміщення, в яких повітря подається в напрямку до робочої зони через фільтри, що займають усю стіну або стелю, і видаляється через поверхню, протилежну входові повітря. Розрізняють дві системи: вертикальний ламінарний потік, при якому повітря рухається в приміщення крізь стелю й виходить через решітчасту підлогу, та горизонтальний ламінарний потік, при якому повітря надходить через одну, а виходить через протилежну перфоровану стінку. Ламінарний потік виносить із кімнати всі завислі в повітрі частинки, що надходять із будь-яких джерел (персонал, устаткування та ін.). У «чистих>> приміщеннях має створюватися ламінарний потік. Системи ламінарного повітряного потоку повинні забезпечувати рівномірну швидкість руху повітря: близько 0,30 м/с для вертикального і близько 0,45 м/с для горизонтального потоків. Більш точна швидкість повітря залежить від типу використаного на підприємстві устаткування.
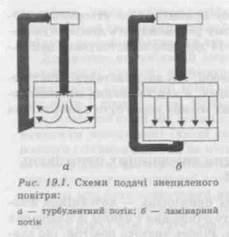
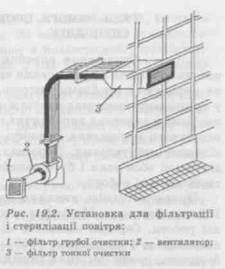
На рис. 19.1 наведені різні схеми подачі знепиленого повітря у виробниче приміщення. Очищення припливного повітря, яке подається в приміщення класу чистоти C, може бути двоступінчастим, а в приміщення А і В класу чистоти — лише триступінчастим. У приміщення класу D можуть подавати повітря, очищене фільтрами першого ступеня. На I ступені використовують, як правило, осередкові фільтри попереднього очищення типу ФЯП, ФЯВ або ФЯУБ, передфільтри «PREFIL» і «KOFIL», які очищають (звільняють) повітря від механічних частинок. їх установлюють на вході в кондиціонер або в припливну камеру. II ступінь підготовки повітря здійснюється фільтрами типу ФР5, ФПП, «Лайк», а також фільтрами типу «MULTISACK» і «MULTIGLAS» і т. ін., що встановлюються безпосередньо перед повітророздавальним пристроєм та призначені для тонкої фільтрації повітря від бактерій і твердих домішок при концентрації пилу 0,5 мг/м3. III ступінь здійснюється стерилізаційними повітряними фільтрами різних конструкцій, наприклад «ABSOFIL», «НЕРА», «SUPER-ULPA» (з ефективністю очищення 99,999 995 %), що встановлюють безпосередньо в місці подачі повітря в робочу зону. Для забезпечення необхідної чистоти повітря в системах «вертикальний ламінарний потік» і «горизонтальний ламінарний потік» у вітчизняній промисловості застосовують фільтрувальні установки, що складаються з фільтрів попередньої грубої очистки повітря та фільтра тонкої очистки (рис. 19.2.). Для остаточної очистки повітря від частинок, що містяться в ньому, і мікрофлори застосовують фільтр типу «Лаік». Як фільтрувальний матеріал у ньому використовується ультратонке волокно з перхлоровінілової смоли. Цей матеріал гідрофобний, стійкий до хімічно агресивних середовищ і може експлуатуватися при температурі не вище 60 °С і відносній вологості до 100 %. Останнім часом великого поширення набули високоефективні повітряні фільтри НЕРА, VERA, ULPA. Очистка витяжного повітря також має здійснюватися через фільтри тонкої очистки для захисту навколишнього середовища від можливих шкідливих викидів із виробничих приміщень. Системи забезпечення повітрям в приміщеннях виробництва бета- лактамних антибіотиків повинні бути цілком ізольованими від повітряних систем виробництва інших лікарських засобів. За необхідності будівля повинна мати систему забезпечення стиснутим повітрям, азотом тощо, а також технологічну схему їх розподілу по всіх виробничих приміщеннях, де це потрібно. Для очистки стиснутого повітря й інших газів можуть бути використані фільтри типу ФЕП із фторопластовою фільтрувальною перегородкою. Надійні й економічні в експлуатації фільтри Aervent 50 фірми «МіПіроге» призначені для стерильної фільтрації повітряних і газових потоків малого масштабу. Гідрофобна поліпропіленова мембрана Aervent фільтра Opticap 0,2 мкм призначена для сте-рильноїфільтрації газів або рідин, що не містять воду. Патронні фільтри Opticap із мембраною Durapore із полівініліденфториду видаляють забруднення частинками найменших розмірів (нижче 0,1 мкм), а фільтри типу Optiseal стерилізують повітряні або газові потоки у ферментерах, біореакторах, ліофілізаторах, стерилізаторах, стерильних газових процесах. Усередині приміщення додатково можуть установлюватися пересувні рециркуляційні повітроочисники ПОПР-0,9 і ПОПР-1,5, які забезпечують швидку й ефективну очистку повітря завдяки його механічній фільтрації через фільтр з ультратонких волокон і ультрафіолетової радіації. Повітроочисники можуть використовуватися під час роботи, тому що не впливають на персонал і не викликають неприємних відчуттів. Для створення «надчистих» приміщень або окремих зон усередині їх розміщується спеціальний блок, в який подається автономно ламінарний потік стерильного повітря. Вітчизняна промисловість випускає «чисті» камери типу M 825.000.000, призначені для виконання робіт у стерильному мікрокліматі. Конструктивні особливості камери дозволяють створювати з елементів камери блоки будь-якої довжини, можливе використання фільтрувальної комірки як самостійного пилозахи-сного пристрою, підвішеного над робочою зоною. Знепилений мікроклімат в камері досягається завдяки безперервному продуванню робочого об'єму камери вертикальним ламінарним потоком знепиленого повітря.
19.2.4. ВИМОГИ, ПОСТАВЛЕНІ ДО ПЕРСОНАЛУ I СПЕЦОДЯГУ Оснащення виробництва системами з ламінарним потоком і подача в приміщення чистого й стерильного повітря ще не вирішують проблеми чистого повітря, тому що працюючий у приміщенні персонал також є активним джерелом забруднення. Тому в «чистих» виробничих приміщеннях під час роботи має перебувати мінімальна кількість робітників, передбачена відповідними інструкціями. Персонал повинен чітко знати свої індивідуальні обов'язки і бути ознайомленим із правилами НВП на своїй ділянці роботи. Протягом однієї хвилини людина, не рухаючись, виділяє 100 тис. частинок. Ця цифра зростає до 10 млн під час інтенсивної роботи. Середня кількість мікроорганізмів, що виділяються людиною за 1 хв, досягає 1500—3000. Тому захист ліків від забруднень, джерелом яких служить людина, є однією з основних проблем технологічної гігієни; і вирішується вона, як правило, завдяки особистій гігієні співробітників і використанню технологічного одягу. Персонал, що входить у виробниче приміщення, повинен бути одягненим у спеціальний одяг, який відповідає виконуваній виробничій операцій. Технологічний одяг персоналу має відповідати класу чистоти тієї зони, в якій він працює, тобто максимально захищати продукт виробництва від частинок, що виділяються людиною. До персоналу і технологічного одягу, призначеного для зон різних типів, висуваються такі вимоги: Клас чистоти D. Голова має бути покритою. Слід одягти захисний костюм загального призначення з відповідним взуттям або бахілами. Клас чистоти C. Голова покрита. Костюм із штаньми (суцільний або із двох частин), що щільно облягає зап'ястя, із високим коміром і відповідним взуттям або бахілами. Одяг і взуття не повинні виділяти ворс або частинки. У приміщеннях класу чистоти А/В слід носити стерильний брючний костюм або комбінезон, головний убір, бахіли, маску, ґумові або пластикові рукавички. Якщо це можливо, то слід використовувати одноразовий або спеціалізований технологічний одяг і взуття з мінімальним ворсовиділенням і пилемісткістю. Нижня частина штанів має бути захованою всередину бахіл, а рукави — у рукавички. Головний убір повинен повністю закривати волосся і бути вставленим у комір костюма. Важливе значення має тканина, з якої виготовляється технологічний одяг. Вона повинна мати мінімальні ворсовиділення, пи-лемісткість, пилепроникність, а також повітропроникність — не нижче 300 м3/(м2 • c), гігроскопічність — не менше 7 %, не накопичувати електростатичний заряд. За кордоном для технологічного одягу використовують тканини з поліестерних, поліпропіленових або поліалкідних волокон, у нас — тканину з лавсану і бавовни (артикул 82138). Багато важить і частота зміни одягу, що залежить від кліматичних умов і пори року. За наявністю кондиційного повітря одяг рекомендується міняти не рідше 1 разу на день, а захисну маску — кожні 2 год. Ґумові рукавички міняють після кожного контакту зі шкірою обличчя, а також у будь-якому разі, коли виникла небезпека їх забруднення. До працівників у «чистих» зонах висуваються жорсткі вимоги відносно їх особистої гігієни та чистоти. У «чистих» приміщеннях забороняється носити наручні годинники, ювелірні вироби, косметику. Весь персонал (включаючи зайнятих складанням і технічним обслуговуванням), працюючий у «чистих» зонах, має проходити систематичне навчання щодо правильного виробництва стерильних продуктів, гігієни й основ мікробіології. 19.2.5. ВИМОГИ ДО ТЕХНОЛОГІЧНОГО ПРОЦЕСУ Виробництво стерильних лікарських засобів здійснюється за методиками, чітко викладеними у технологічних регламентах і виробничих інструкціях, з урахуванням принципів і правил належної виробничої практики, як необхідна умова для отримання готової продукції потрібної якості відповідно до реєстраційної та ліцензійної документації. Не допускається виготовляти різні лікарські засоби одночасно або послідовно в тому самому приміщенні за винятком тих випадків, коли відсутні ризик перехресної контамінації, а також можливість змішування та переплутування різних видів вихідної сировини, напівпродуктів, матеріалів, проміжної і готової продукції. Контроль у процесі виробництва, що здійснюється у виробничих приміщеннях, не повинен впливати негативно на технологічний процес і якість продукції. На всіх стадіях технологічного процесу, включаючи стадії, що передують стерилізації, необхідно проводити заходи, які зводять до мінімуму мікробну контамінацію. Проміжки часу між початком приготування розчинів і їх стерилізацією або стерилізаційною фільтрацією повинні бути мінімальними і мати обмеження (ліміти) у часі, установлені в процесі валідації. Препарати, що містять живі мікроорганізми, забороняється виготовляти і фасувати в приміщеннях, призначених для виробництва інших лікарських засобів.
Джерела води, устаткування для обробки води й оброблену воду потрібно регулярно контролювати на хімічну й мікробіологічну контамінацію, а також за необхідності на контамінацію ендотоксинами, щоб якість води відповідала вимогам нормативно-технічної документації. Будь-який газ, що контактує під час технологічного процесу з розчинами або іншою проміжною продукцією, має пройти стерилізаційне фільтрування. Матеріали, яким властиве утворення волокон з їхнім можливим викидом у навколишнє середовище, як правило, не повинні застосовуватися в «чистих» приміщеннях; а при здійсненні технологічного процесу в асептичних умовах їх використання повністю забороняється. Після стадій (операцій) остаточного очищення первинної упаковки й обладнання при подальшому проведенні технологічного процесу вони мають використовуватися таким чином, щоб не відбувалася їхня повторна контамінація. Ефективність будь-яких нових методик, заміни обладнання та способів проведення технологічного процесу повинна підтверджуватися при валідації, яку регулярно повторюють за розробленими графіками. При виробництві продукції, що стерилізується в первинній упаковці, підготовку вихідної сировини і первинної упаковки, а також готування багатьох видів лікарських засобів необхідно проводити в «чистих» зонах з класом чистоти не нижче D, щоб забезпечити досить низький рівень ризику контамінації частинками і мікроорганізмами, який вимагається для фільтрації і стерилізації. Якщо мікробна контамінація становить особливий ризик для продукції (наприклад, коли вона є прекрасним живильним середовищем для росту мікроорганізмів, або до стерилізації проходить досить тривалий період часу), то її виробництво має відбуватися в зоні з класом чистоти C. Фасовка продукції в первинну упаковку перед остаточною стерилізацією повинна здійснюватися в зоні з класом чистоти не менше C. Якщо існує підвищений ризик контамінації продукції з навколишнього середовища (наприклад, наповнення первинної упаковки відбувається повільно або первинна упаковка має широке горло, або заповнена первинна упаковка знаходиться відкритою більше декількох секунд перед герметизацією), фасування проводять в зоні з класом чистоти А і навколишнім середовищем не менше класу C. Суспензії, емульсії та мазі необхідно виготовляти і фасувати перед остаточною стерилізацією в приміщеннях з якістю повітря, що відповідає класу чистоти C. У виробництві продукції, отримуваної в асептичних умовах, вимита первинна упаковка повинна знаходитися в «чистій» зоні з навколишнім середовищем не менше класу чистоти D. Обробка стерильної вихідної сировини і первинної упаковки, якщо в подальшому не передбачена стерилізація або стерилізаційна фільтрація, мають здійснюватися в робочій зоні з класом чистоти А і навколишнім середовищем класу чистоти В. Приготування розчинів, що під час технологічного процесу підлягають стерилізаційній фільтрації, проводять в навколишньому середовищі з класом чистоти C. Якщо стерилізаційна фільтрація розчинів не передбачена, обробку вихідної сировини і продукції проводять в зоні з класом чистоти А при класі чистоти В навколишнього середовища. Технологічні операції з приготування і фасування продукції в асептичних умовах повинні здійснюватися на робочому місці з класом чистоти А при класі чистоти В навколишнього середовища. Передача (транспортування) не повністю закупорених первинних упаковок із продукцією, наприклад ліофілізованою, повинна до завершення процесу закупорювання проводитись або в зоні з класом чистоти А, або в герметичних передавальних пристроях у навколишньому середовищі з класом чистоти В. Приготування і фасування стерильних суспензій, емульсій, мазей і кремів мають проводитися в робочій зоні з класом чистоти А, коли їх приготування відбувається у відкритих ємкостях і не передбачена подальша стерилізаційна фільтрація. Останнім часом намітилася тенденція до створення локальних «чистих» зон завдяки використанню новітніх технологій і обладнання, що зводять до мінімуму або виключають присутність персоналу у виробничих приміщеннях (наприклад, повністю замкнуті й автоматизовані системи). Використання ізолюючих технологій зменшує потребу в присутності людини у виробничих зонах, у результаті чого значно снижується ризик мікробної контамінації продукції, виробленої в асептичних умовах, із навколишнього середовища. Ізолюючі технології передбачають використання різних типів герметизованих систем, модулів, ізоляторів тощо, що включають спеціальні передавальні пристрої і навіть устаткування для стерилізації. Ізолятор і навколишнє його середовище мають бути спроектовані таким чином, щоб у відповідних робочих зонах досягалася необхідна якість повітря. 19.2.6. ВИМОГИ ДО ТЕХНОЛОГІЧНОГО ОБЛАДНАННЯ Для створення умов, що запобігають можливому мікробному обсіменінню ПЛЗ, важливе значення має обладнання, яке реалізує технологічні процеси і визначає низку вимог до конструкції, вибору форм, матеріалів і покриття його деталей.
Виробниче обладнання не повинне негативно впливати на якість продукції. Частини або поверхні устаткування, що контактують з продукцією, виготовляються з матеріалів, які не вступають з нею в реакцію, не мають абсорбційних властивостей і не виділяють речовин в такій кількості, щоб це могло вплинути на якість продукції. Обладнання, яке використовується для роботи в «чистих» приміщеннях, має бути сконструйованим і розміщеним таким чином, щоб його експлуатацію, обслуговування та ремонт можна було б проводити за межами «чистих» зон. Воно також повинно мати реєструючі пристрої для контролю параметрів процесу. Для уникнення забруднення ін'єкційних препаратів у процесі їх виробництва необхідно, щоб використане обладнання мало гладкі обтічні поверхні без виступів, ґрат і щілин, де можливе скупчення пилу, з відповідними аеродинамічними властивостями, що виключають утворення турбулентних потоків повітря. Одним із шляхів вирішення цих завдань є застосування сучасних автоматичних ліній ампулування ін'єкційних препаратів. Такі потоково-автоматичні лінії мають очевидні переваги над устаткуванням, призначеним для виконання тільки однієї якоїсь операції. Використання автоматичних ліній дозволяє практично повністю виключити фізичну працю людини через застосування приладів, автоматів і машин, об'єднаних автоматичним засобом транспортування предметів праці й автоматизації всього виробничого процесу. Останнім часом у всьому світі намітилася тенденція до обмеженого об'єму зон з очищеним повітрям. Зменшення об'єму зон очищення не тільки підвищує якість оброблюваного повітря, але й найбільш доцільне з економічної точки зору. Тому проектанти обладнання пішли шляхом створення спеціальних умов у самому устаткуванні. Це дозволяє створити особливу чистоту в обмеженому об'ємі, безпосередньо в зоні обробки матеріалу, унаслідок чого зберігаються санітарно-гігієнічні умови у всьому виробничому приміщенні. Ізолювання зон розфасовки ін'єкційних розчинів від обслуговуючого персоналу, основного джерела механічних і мікробних забруднень, вирішується через застосування різних типів ізоляторів і спеціальних передавальних пристроїв. Передача вихідної сировини та матеріалів усередину і назовні виробничих зон є одним із найбільше серйозних джерел контамінації. Тому конструкції передавальних пристроїв можуть варіювати від пристроїв з одинарними або подвійними дверима до повністю герметизованних систем із зоною їх стерилізації (стерилізаційний тунель). Ізолятори можуть бути введені в роботу тільки після відповідної валідації, яка має враховувати всі критичні чинники ізолюючої технології (наприклад, якість повітря всередині і назовні ізолятора, технології передачі й цілісність ізолятора). 19.2.7. ВИМОГИ ДО КОНТРОЛЮ ЯКОСТІ Кожне підприємство-виробник повинне мати незалежну службу контролю якості і контрольну (дослідну) лабораторію, штат і оснащення якої дозволяють проводити всі необхідні дослідження. Така лабораторія має бути відокремленою від виробничих приміщень та інших лабораторій (біологічної, мікробіологічної тощо). Під час технологічного процесу виробництва ПЛЗ обов'язково проводять проміжний (постадійний) контроль якості, тобто після кожної технологічної стадії (операції) проводиться бракераж ампул, флаконів, гнучких контейнерів тощо, що не відповідають зазначеним вимогам. Так, після розчинення (ізотонізації, стабілізації і т. под.) лікарської речовини контролюється якісний і кількісний склад, pH розчину, густина і т. ін.; після операції наповнення перевіряється вибірково об'єм наповнення посудин тощо. Сировина, що надійшла, матеріали, напівпродукти, а також виготовлена проміжна або готова продукція відразу ж після надходження або закінчення технологічного процесу до ухвалення рішення про можливе подальше використання повинні перебувати в карантині. Готова продукція не допускається до реалізації доти, доки її якість не буде визнана задовільною. Рідкі лікарські засоби для парентерального застосування зазвичай контролюються за такими показниками якості: опис, ідентифікація, прозорість, забарвленість, pH, супутні домішки, об'єм, стерильність, пірогени, аномальна токсичність, механічні включення, кількісне визначення діючих речовин, антимікробних консервантів і органічних розчинників. Методи оцінки якості парентеральних лікарських засобів за перерахованими параметрами подані в ДФУ і будуть описані далі. Таким чином, важливими питаннями для всіх видів лікарських засобів парентерального призначення є якнайшвидше впровадження і точне дотримання належних правил виробництва, які забезпечують захист стерильної продукції від різного роду забруднень, що гарантує високу якість вітчизняної фармацевтичної про-дукції. Дата добавления: 2016-03-26 | Просмотры: 716 | Нарушение авторских прав |
 тиску повітря. За необхідністю в приміщенні підтримують певну температуру і вологість. Такі приміщення називають «чистими». «Чистим» приміщенням або «чистою» кімнатою називається приміщення, в якому облікова концентрація аерозольних частинок і число мікроорганізмів у повітрі підтримується в суворо визначених межах. Під частинкою розуміється твердий, рідкий або багатофазний об'єкт або мікроорганізм»із розмірами від 0,005 до 100 мкм. При класифікації «чистих» приміщень розглядаються частинки від 0,1 до 5 мкм.
тиску повітря. За необхідністю в приміщенні підтримують певну температуру і вологість. Такі приміщення називають «чистими». «Чистим» приміщенням або «чистою» кімнатою називається приміщення, в якому облікова концентрація аерозольних частинок і число мікроорганізмів у повітрі підтримується в суворо визначених межах. Під частинкою розуміється твердий, рідкий або багатофазний об'єкт або мікроорганізм»із розмірами від 0,005 до 100 мкм. При класифікації «чистих» приміщень розглядаються частинки від 0,1 до 5 мкм.