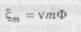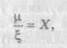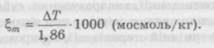|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Осмоляльність і осмолярність парентеральних розчинівДля запобігання таких небезпечних ускладнень парентерального введення лікарських засобів, як гіпо- і гіперосмо-лярні стани, порушення згортання крові, утворення тромбів і т. д., з недавнього часу в парентеральних розчинах стали визначати показники осмоляльності й осмолярності. Відповідно до визначення ДФУ, осмоляльність (£m) — це показник, що дозволяє оцінити сумарний внесок різних розчинених речовин в осмотичний тиск розчину. Осмоляльність виражають в осмолях на кілограм розчинника — осмоль/кг (на практиці, як правило, використовують міліосмоль на кілограм — мосмоль/кг). Наближений розрахунок осмоляльності водного розчину здійснюють за формулою:
де v — сумарне число іонів, які утворюються з однієї молекули розчиненої речовини в результаті дисоціації. Якщо розчинена речовина не дисоціює на іони, V= 1; m — моляльність розчину, тобто число молів розчиненої речовини на кілограм розчинника; Ф — моляльний осмотичний коефіцієнт, який враховує взаємодію між іонами протилежного знака у розчині й залежить від m. Поряд з поняттям осмоляльність у практиці використовується поняття осмолярності (ц) — як показника, що також дозволяє оцінити сумарний внесок різних розчинених речовин в осмотичний тиск розчину (зазвичай її виражають у мосмоль/л). Як бачимо, обидва показники аналогічні за змістом і відрізняються один від одного різним способом вираження концентрації розчинів на одиницю маси (моляльний) або на одиницю об'єму (молярний). Відношення величин осмолярності й осмоляльності можна представити як масо-об'ємну концентрацію розчинника в розчині, яка випливає з визначення цих понять:
де X — кількість розчинника, кг, в 1 л розчину; ц — осмолярність розчину, осмоль/л розчину; t, — осмоляльність розчину, осмоль/кг розчинника. Для розведених розчинів, близьких до ідеального, значення осмоляльності й осмолярності можуть бути розраховані теоретично. Однак при підвищенні концентрації розчину взаємодія між його частинками зростає і фактична осмоляльність (осмолярність) знижується порівняно з ідеальною. Тому теоретичний розрахунок осмоляльності (осмолярності) висококонцентрованих розчинів, а також розчинів речовин із великою молекулярною масою (наприклад білкових гідролізатів) неможливий. У таких випадках ці показники визначають експериментальним шляхом за допомогою осмометрів, принцип дії яких ґрунтується на вимірюванні зниження температури замерзання розчину або тиску пари над ним. Результати вважаються достовірними, якщо отримане значення не виходить за межі значень осмоляльності двох стандартних розчинів, використаних для калібрування осмометра. Як стандартні розчини використовують розчини натрію хлориду. Методика визначення наведена в ДФУ (п. 2.2.35). Зниження температури замерзання на 1,86 °С і зниження тиску пари на 40 Па (0,3 мм рт. ст.) при температурі 25 °С відповідає 1 осмолю на 1 кг води. Залежність між осмоляльністю і зниженням температури замерзання ЛТ виражають співвідношенням:
Визначення величини осмолярності розчинів важливе при застосуванні парентерального підживлення організму (вирівнювання грубих порушень водно-електролітного і кислотно-лужного балансу, боротьба із загрозливими для життя станами — шоком, набряком мозку і т. д.), коли необхідна інфузія протягом 24 год. Чинником обмеження при парентеральному годуванні є вводима кількість рідини, яка впливає на систему кровообігу і водно-електролітний баланс. 3 іншого боку, з огляду на визначені межі «витривалості» вен не можна використовувати розчини довільної концентрації. Осмолярність близько 1100 мосмоль/л (20 %-вий розчин цукру) у дорослої людини є верхньою межею для введення через периферичну вену. Осмолярність плазми крові складає близько 300 мосмоль/л, що відповідає тискові майже 780 кПа при 38 °С. Ця величина є вихідною точкою стабільності інфузійних розчинів. Для паренте-
ральних розчинів, використовуваних у практиці, величина осмо-лярності може коливатися в межах від 200 до 700 мосмоль/л. Значення осмоляльності (осмолярності) потрібно вказувати на етикетках інфузійних розчинів. 19.8.2. СТАБІЛІЗАЦІЯ РОЗЧИНІВ При виготовленні і зберіганні деяких лікарських препаратів нерідко спостерігається зміна їхніх властивостей, яка відбувається із різною швидкістю і ступенем прояву. Це пов'язано зі зменшенням вмісту лікарських речовин або зниженням їхньої фармакологічної активності, зміною властивостей лікарських форм тощо. Подібні зміни впливають на термін придатності (зберігання) препаратів, який може коливатися від декількох годин (розчини антибіотиків) або днів (розчини ферментів) до декількох років. Завданню підвищення стабільності лікарських засобів на сьогоднішній час приділяється особлива увага. Процеси, що відбуваються в препаратах, можна умовно класифікувати на фізичні, хімічні й біологічні. Умовність полягає в їхньому взаємозв'язку: хімічні перетворення можуть стати причиною зміни фізичних властивостей, у той час як фізичні зміни стають причиною небажаних хімічних процесів. Біологічні ж процеси супроводжуються як хімічними, так і фізичними перетвореннями. До фізичних процесів, що відбуваються переважно при зберіганні, слід віднести укрупнення частинок дисперсної фази, розшаровування, зміну консистенції, випаровування, сублімацію та ін. Хімічні процеси проходять нерідко при виготовленні препарату, особливо при термічній стерилізації, і супроводжуються різноманітними хімічними реакціями — гідроліз, омилення, окисно-відновні процеси, фотохімічні й ензиматичні перетворення, рідше спостерігаються полімеризація й ізомеризація та ін. Біологічні процеси, зумовлені життєдіяльністю мікроорганізмів, часто призводять до небажаних хімічних перетворень діючих речовин, іноді — до зміни зовнішнього вигляду лікарської форми. Стабільність лікарських препаратів залежить від багатьох чинників: температури зберігання, освітленості, складу навколишньої атмосфери, способу приготування, тобто технології лікарської форми, допоміжних речовин, виду лікарської форми, особливо її агрегатного стану, упаковки і т. ін. Використовувані в наш час методи стабілізації лікарських засобів — хімічний і фізичний — нерідко застосовуються в комплексі, доповнюючи один одного. Хімічні методи ґрунтуються на додаванні хімічних речовин — стабілізаторів, антиоксидантів і консервантів. Фізичні методи базуються на захисті лікарських речовин від несприятливих впливів зовнішнього середовища, застосуванні лікарських і допоміжних речовин високого ступеня очищення, використанні сучасного технологічного оснащення і результатів наукових досліджень у технології лікарських форм — застосування неводних розчинників, зневоднювання препаратів, ампулування в струмені інертних газів та ін. Таким чином, стабільність препарату — це здатність біологічно активної речовини зберігати фізико-хімічні властивості і фармакологічну активність протягом певного терміну зберігання, передбаченого нормативно-технічною документацією. Хімічні методи стабілізації. Стабілізація гомогенних дисперсних систем побудована на приглушенні процесу розкладання лікарських речовин за рахунок зв'язування або нейтралізації тих хімічних сполук, що активують деструкцію лікарської речовини. Такі сполуки знаходяться в розчині в незначних кількостях або переходять у розчин з упаковки (скла, полімерів) при його технологічній обробці (стерилізації) і зберіганні. Стабільність парентеральних препаратів, у першу чергу, залежить від якості вихідних розчинників і лікарських речовин, класу і марки скла ампул і флаконів, наявності кисню у воді і розчинах, pH розчинів, температури і часу стерилізації, наявності іонів важких металів, умов зберігання препаратів і т. д. Основний принцип стабілізації препаратів передбачає максимальне усунення чинників, що сприяють зміні лікарських речовин. Вплив якості скла на стабільність речовин. Медичне скло — це твердий розчин, отриманий у результаті охолодження розплавленої суміші силікатів, оксидів металів і деяких солей. Залежно від якісного та кількісного співвідношення оксидів металів у склі розрізняють класи і марки медичного скла, яке має різну хімічну стійкість. На поверхні скла ампул або флаконів при контакті з водними ін'єкційними розчинами під час зберігання й особливо при тепловій стерилізації в залежності від його марки і значення pH розчину може відбуватися процес вилужування або розчинення верхнього шару скла. Вилужування — це вихід із скла переважно оксидів лужних і лужноземельних металів завдяки високій рухливості іонів цих металів у порівнянні з високим зарядом чотиривалентного іона силіцію. 3 цієї причини іон натрію навіть при кімнатній температурі може заміщатися іншими іонами. При більш глибоких процесах вилужування іони лужних металів легко переміщаються з внутрішніх шарів скла на місце іонів, які вступили в реакцію. Вилужування зі скла компонентів і їх гідроліз ведуть до збільшення або зменшення величини pH розчину. Це призводить до змін властивостей лікарських речовин, в основі
яких лежать різні хімічні процеси: гідроліз, окиснення, відновлення, омилення, декарбоксилування, ізомеризація та ін. Оптимальна концентрація водневих іонів в ін'єкційних розчинах є суттєвим стабілізувальним чинником. Вона досягається через додавання стабілізаторів, які передбачені в нормативно-технічній документації, а також використанням комплексу технологічних прийомів до процесу приготування парентеральних розчинів. Стабілізатори можуть сповільнювати або прискорювати небажані хімічні реакції, створювати певні значення pH розчинів, підвищувати розчинність лікарських речовин або утримувати останні в завислому стані. Вибір стабілізатора, у першу чергу, залежить від природи лікарських речовин. Серед вимог, висунутих до стабілізаторів, можна відзначити: терапевтичну індиферентність, добру розчинність у розчиннику, ефективність у застосовуваних концентраціях, хімічну чистоту, доступність. Незважаючи на різноманіття і надзвичайну складність процесів, що проходять у розчинах, лікарські речовини, які потребують стабілізації, можна умовно розділити на три групи: 1) розчини солей, утворених слабкими основами і сильними кислотами; 2) розчини солей, утворених сильними основами і слабкими кислотами; 3) розчини легкоокиснюваних речовин. Дата добавления: 2016-03-26 | Просмотры: 1036 | Нарушение авторских прав |