|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
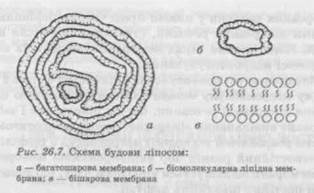
СИСТЕМИ 13 СПРЯМОВАНОЮ ДОСТАВКОЮ ЛІКАРСЬКИХ РЕЧОВИНВеликі перспективи у сфері лікарської терапії зараз пов'язують із спрямованою доставкою лікарських речовин (C-1) до органу, тканини або клітин. Серед цих систем добре зарекомендували себе мікрокапсуло-вані лікарські засоби (мікрокапсули, мікросфери, нанокапсули), призначені для внутрішньосудинного введення поблизу певного органу або тканини. Перспективними напрямами застосування мікрокапсулованих лікарських засобів вважається лікування ферментної недостатності, цілеспрямована доставка лікарських речовин в орган-мішень, радіоімуноаналіз. Мікрокапсулування лікарських речовин дозволяє пролонгувати дію гормонів, антигенів, пептидів, ферментів та інших лікарських речовин, які вивільняються з мікрокапсул за допомогою дифузії через пори полімерної оболонки, а також часткового її розчинення або руйнування. Дослідження у сфері мікрокапсулування привели до створення нових груп носіїв лікарських речовин: нанокапсул та мікро-сфер. Розміри нанокапсул складають від 10 до декількох сотень нанометрів. Один із способів їх отримання полягає в полімеризації мономерів, солюбілізованих деякими поверхнево-активними речовинами (ПАР), під дією гама-опромінювання у водних або неводних середовищах. Лікарські речовини вводять в нанокапсули перед полімеризацією або в пори після полімеризації. Викликають інтерес дослідження, направлені на створення мік-рокапсулованої форми інсуліну. Як носій лікарських речовин використали еритроцити бичачої крові. Удалося отримати мікрокапсули з вмістом інсуліну 4,8 %, активність якого залишалась сталою за рахунок добавок толбутаміду. Крім того, вивчена можливість мікрокапсулування кортизолу, метотриксату, циклофос-фаміду і a-1-антитрипсину інтактними еритроцитами. Помічення еритроцитів ізотіоціанатом флюоресцеїну показало, що клітини добре виживали після введення їх тваринам (щурам, кроликам, морським свинкам). Уведення мікрок'апсул з кортизолом і ме-тотриксатом дозволило значно підвищити терапевтичні концент- рації лікарських речовин у плазмі крові тварин порівняно з концентраціями лікарських речовин, створюваними після введення субстанцій. Електричний заряд мембрани еритроцитів не змінювався в процесі мікрокапсулування. Розроблена нова мікрокапсулована лікарська форма з теофіліном. Кожну мікрокапсулу можна назвати автономною системою вивільнення лікарської речовини, що діє рівномірно і забезпечує контрольоване вивільнення лікарської речовини протягом 12 год. Особливістю розробленої технології мікрокапсул з теофіліном вважається непостійний розмір пор напівпроникної мембрани. Діаметр пор мембрани збільшується упродовж часу, що дозволяє підтримувати постійну швидкість дифузії. Метод мікрокапсулування може бути використаний для отримання лікарської форми, що має кращу розчинність і біодоступ-ність. Так, запропонований новий метод мікрокапсулування, який заключається в адсорбції мікронізованої ЛР на поверхні носія — великих частинок інертного матеріалу (декстрози, лактози) з наступним нанесенням на них розпилення плівкового покриття. Однак технологія виробництва мікрокапсул не завжди дозволяє отримати стандартний, високоякісний продукт у результаті руйнування покриття капсулованої речовини, недостатньо рівномірної товщини покриття, занадто малої або дуже високої проникності полімерної мембрани, незадовільної репродукції і високої вартості мікрокапсулованих препаратів. Різновидністю мікрокапсулованих препаратів, що забезпечують цілеспрямовану доставку лікарських речовин в орган-мішень, слід назвати ліпосоми, що легко проникають крізь клітинні мембрани і тим самим забезпечують більш ефективне транспортування вміщених в них лікарських речовин всередину клітини, ніж при застосуванні традиційних лікарських форм — таблеток, капсул, ін'єкцій. Ліпосоми — це штучно отримані, замкнуті сферичні частинки, утворені біомолекулярними ліпідними шарами, найчастіше фосфоліпідами, в порожинах між якими міститься сфера формування (рис. 26.7). Сухі фосфоліпіди при контакті з водою зазнають низку молекулярних перегрупувань, у результаті чого утворюються смектич-ні мезофази — послідовності концентрично замкнутих мембран, кожна з яких являє собою безперервний біомолекулярний ліпідний шар і відокремлена від іншого шару водною фазою. Нині ліпосоми перетворились із предмета лабораторних досліджень в перспективний об'єкт практичного використання. Зараз можна отримати стабільні, стандартні за розміром і стерильні ліпосоми, які перетворюються в порошок (шляхом ліофілізації) і за необхідністю повертаються у вихідний стан.
Можна отримувати також «порожні» ліпосоми і завантажувати їх лікарськими речовинами безпосередньо перед використанням. Розроблено методи, які дозволяють контролювати розмір лі-посом і отримувати стандартні партії стерильних ліпосомальних препаратів Ліпосоми поділяють: — на мультиламелярні з діаметром 500—600 нм; — моноламелярні з діаметром 200—1000 нм; — малі моноламелярні з діаметром 25—50 нм; — ліпосоми, одержані шляхом диспергування водної фази в органічному розчині фосфоліпідів. При випаренні органічного розчинника отримують моно- і оліноламелярні ліпосоми. При обробці ультразвуком великі частинки розпадаються на малі, переважно двошарові. У процесі набухання водорозчинні діючі речовини накопичуються між двома шарами, у той час як жиророзчинні речовини локалізуються в ліпідному шарі ліпосом. Можна отримати й одношарові ліпосоми, наприклад, озвучуванням багатошарових ліпосом ультразвуком. Таким чином, в залежності від застосованих технологічних прийомів можливе отримання багатошарових або одношарових ліпосом. При цьому механізм доставки лікарських речовин в організм неоднаковий. Так, багатошарові ліпосоми проникають усередину клітини в незмінному вигляді і поглинаються лізосомами, в яких під дією ліпаз проходить руйнування ліпосом і вивільнення інкапсулованих у них лікарських речовин. Одношарові ліпосоми зливаються з плазматичними мембранами клітини і вивільняють лікарські речовини в цитоплазму. Ліпосоми зберігають інтактність інкапсулованих в них ЛР, оберігаючи їх від зв'язування білками плазми, руйнування ферментами, а також знижують можливість виникнення імунних та інших системних реакцій організму на введені з ліпосомами речовини, тому що вони не проникають через зовнішній ліпідний шар ліпосом у кров. При цьому дія лікарських речовин, замкнутих у ліпосоми, значно пролонгується внаслідок повільного їх вивільнення. Для введення ліпосом в організм можуть бути використані різні шляхи: внутрішньовенний, внутрішньочеревний, підшкірний, пероральний, внутрішньотрахеальний, внутрішньосуглобний, нашкірний. Ліпосоми — зручна система для доставки лікарських речовин до макрофагів печінки, селезінки, шкіри та легенів. У зв'язку з цим відкриваються більші можливості використання ліпосомальних препаратів для лікування ряду інфекційних захворювань, а також для активації макрофагів при лікуванні раку. Ліпосоми, уведені внутрішньовенно, як правило, зв'язуються з органами ретикулоендотеліальної системи, головним чином з печінкою і селезінкою. Використання ліпосомальних лікарських препаратів дозволяє знизити вірогідність побічних реакцій організму внаслідок біологічної інертності використаних допоміжних речовин, їх біоруйнів-ності, непоганої проникної здатності і органоспецифічності. Для доставки лікарських речовин в орган-мішень використовують також колоїдні частинки, які утримують набагато більшу кількість лікарської речовини порівняно з ліпосомальними лікарськими формами. Гідрофобні властивості поверхні колоїдних частинок є визначальним чинником в подоланні ретикулоендоте-ліального бар'єра. Заряд колоїдних частинок має значення для розподілення лікарських речовин в організмі та вибірковості його дії. Як правило, колоїдні частинки розміром 1—2 мкм локалізуються в печінці. Основним місцем накопичення лікарських речовин після внутрішньовенного введення колоїдних частинок слід назвати легені, в яких затримуються частинки розміром 7 мкм і більше. Отже, регулюючи розмір колоїдних частинок, можна досягти вибіркової дії лікарських речовин. 3 метою підвищення вибірковості дії лікарських речовин на організм, їх цілеспрямованої доставки в орган-мішень можуть бути використані дрібнодисперсні магнітні матеріали. Метод магніто-керованого транспортування лікарських речовин ґрунтується на здатності колоїдних частинок магнітного матеріалу перемішуватися і концентруватися в необхідній ділянці організму під дією магнітного поля. Це дозволяє вибірково концентрувати магнітні частинки з нанесеними на їхню поверхню лікарськими речовинами безпосередньо в тканинах ураженого органу, обмеженого фокусом зовнішнього джерела магнітного поля. У магнітокерованих системах спрямованої дії сироватковий альбумін виконує роль матриці — носія лікарських речовин і одночасно колоїдних частинок феруму (III) оксиду Fe203, що і зумов-
лює їх чутливість до дії магнітного поля. Пероральне введення цієї лікарської форми може бути неефективним через зв'язування альбуміну матриці в печінці або селезінці. Тому найбільш раціонально використовувати «магнітну» лікарську форму у вигляді внутрішньовенних ін'єкцій. Метод одержання «магнітних» лікарських форм полягає в денатуруванні навколо колоїдних частинок феруму оксидів альбумінової матриці, що містить лікарські речовини. Картина розподілення магнітних мікрочастинок після внутрішньовенного введення і динаміки їх елімінування підпорядковується загальним закономірностям, характерним для дисперсних і колоїдних речовин різної природи. Виведення магнітних мікрочастинок здійснюється головним чином нирками. Питання, пов'язані з вивченням токсичності магнітних мікрочастинок, потребують подальшої розробки. Нині «магнітні» лікарські форми проходять випробування на тваринах. Указані лікарські форми передбачається використовувати в клінічній медицині для лікування онкологічних захворювань, емболії легень, тромбофлебітів, хронічного артриту, абсцесів і остеомієліту. Збереження нативних властивостей, захист від несприятливої дії навколишнього середовища, вибірковість і пролонгування дії ЛР досягаються за допомогою іммобілізації. В «іммобілізованих» препаратах лікарські речовини фізично чи хімічно зв'язані з матрицею. Із синтетичних полімерів, які використовувались як матриці, найширше застосування знайшли полімери вінілового спирту, акрилових кислот, вінілпіролідону. На базі цих полімерів синтезовані кополімери, в яких як мономери використані вініламін, кислота вініламідобурштинова, малеїновий альдегід, кротоновий ангідрид, кислота кротонова тощо. При цьому кополімери повинні мати чітко визначену молекулярну масу і не містити залишкових мономерів, що характеризуються високою токсичністю. Вони також повинні мати вузьке молекулярно-масове розподілення й високий ступінь композиційної однорідності, тому що розподіл функціональних груп, які беруть участь в утворенні зв'язків при іммобілізації, може бути рівномірним. Технологічні аспекти цієї проблеми ретельно висвітлені в главі «Ферменти», розділ «Іммобілізовані ферменти». В Україні і за кордоном проводяться інтенсивні дослідження, направлені на створення іммобілізованих ферментних препаратів. Для лікування гіпертонічної хвороби, інфаркту міокарда і захворювань периферичних судин пропонується використовувати іммобілізовані калікреїни, а в терапії тромбозів з успіхом випробовуються іммобілізовані трипсин, хімотрипсин, плазмін, фібро-лізин, урокіназа, стрептокіназа. Іммобілізовані ферменти зберігають свою активність в десятки і сотні разів довше, при цьому їх терапевтична доза знижується в сотні разів. Іммобілізація дозволяє зменшити дози і частоту введення ЛР, захищає тканини від їх подразнювальної дії. Тепер в лікувальній практиці використовують іммобілізовані препарати ферментів, гормонів, амінокислот, полі- і моносахаридів, нуклеїнових кислот і основ, нуклеози-дів, антибіотиків, стероїдів. Питання створення твердих дисперсних систем (ТДС), які використовуються як пролонговані лікарські форми, висвітлені в главах «Таблетки» і «Капсули». Дата добавления: 2016-03-26 | Просмотры: 750 | Нарушение авторских прав |