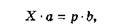|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ХАРАКТЕРИСТИКА РОЗЧИННИКІВУ процесі готування рідких лікарських форм завжди потрібен розчинник, який є відповідно дисперсійним середовищем. Розчинниками називають хімічні сполуки або суміші, здатні розчиняти різні речовини, тобто утворювати з ними однорідні системи — розчини, що складаються з двох або більше компонентів. Як розчинники для приготування розчинів у медичній практиці використовують: воду очищену, спирт етиловий, гліцерин, жирні олії та мінеральні масла, хлороформ, етер діетиловий. Тепер асортимент розчинників значно розширився за рахунок силі-ційорганічних сполук, етилен- і пропіленгліколів, поліетиленок-сидів, диметилсульфоксидів та інших речовин. До розчинників, які необхідні для приготування рідких лікарських форм, висуваються певні вимоги: — вони мають бути стійкими при зберіганні, хімічно і фармакологічно індиферентними; — повинні мати високу розчинювальну здатність; — не повинні мати неприємного смаку та запаху;
— мають бути доступними за вартістю; — не повинні бути середовищем для розвитку мікроорганізмів. Виходячи з хімічної класифікації, усі рідкі дисперсні системи розподіляють на неорганічні та органічні сполуки. Вода очищена (Aqua purificata). Серед неорганічних сполук вона є найпоширенішим розчинником. Вода фармакологічно індиферентна, доступна і добре розчиняє багато лікарських речовин, але водночас у ній дуже легко й швидко гідролізуються деякі речовини та розвиваються мікроорганізми. Воду очищену можна одержати дистиляцією, іонним обміном, електролізом, зворотним осмосом. Вона має бути безбарвною, прозорою, без смаку і запаху, з pH = 5,0...7,0, не повинна містити від-новлювальних речовин, нітратів, нітритів, хлоридів, сульфатів, слідів амоніаку та інших домішок. Спирт етиловий (Spiritus aethylicus). Прозора, безбарвна, рухлива рідина з характерним запахом і пекучим смаком, кипить при температурі 78 °С. У фармацевтичному виробництві застосовують етиловий спирт С2Н5ОН, одержаний шляхом зброджування сировини, що містить крохмаль, — переважно картоплі й зерна. Збро-джене сусло, яке містить 8—10 % спирту, зміцнюють простою перегонкою. Одержують спирт-сирець, що містить близько 88 % спирту. Спирт-сирець очищають від летких органічних кислот (переважно оцтової, молочної, масляної), сивушних масел (вищих спиртів одного гомологічного ряду з етиловим спиртом — пропіло-вого, ізобутилового, ізоамілового та інших), естерів (оцтово-етилового, масляно-етилового та інших), альдегідів (оцтового альдегіду та інших) і одночасно зміцнюють до 95—96 % багатократною перегонкою — ректифікацією. Етанол іншого походження для виробництва лікарських препаратів непридатний через присутність неприпустимих домішок (спирту метилового та інших сполук). Спирт етиловий можна віднести до неводних розчинників умовно, тому що використовується не абсолютний етанол, а водно-спиртові розчини різної концентрації. Спирт змішується в будь-яких співвідношеннях із водою, гліцерином, ефіром, хлороформом. Він нейтральний, не окиснюєть-ся киснем повітря, має бактеріостатичну й бактерицидну дію. До негативних властивостей спирту слід віднести його неінди-ферентність, смертельна доза 96 % -вого спирту етилового — приблизно 200—300 мл. Він сприяє осадженню білків, ферментів, легкозаймистий, має високу гігроскопічність, несумісний з окисниками, а з деякими солями утворює кристалічні сполуки. Етиловий спирт є одним із найбільш пріоритетних розчинників у виробництві фармацевтичних препаратів. На виробництво
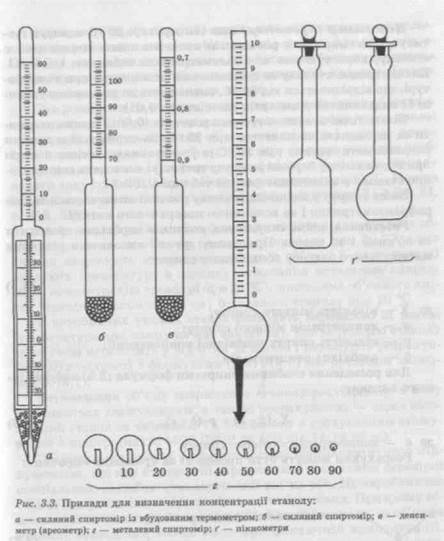
надходить 96,2—96,7 %-вий етанол, який розводять водою або слабким спиртом до необхідної концентрації. Вміст етанолу в розчині (концентрація) виражається у відсотках за об'ємом, тобто як об'ємна частка, % (об. ч.); і у відсотках за масою, тобто як масова частка, % (мас. ч.). Якщо немає.спеці-ального зазначення, мається на увазі об'ємна частка у відсотках. Вміст етанолу Cv в розчині у відсотках за об'ємом С^показує, яка кількість мілілітрів безводного етанолу міститься в 100 мл водно-спиртового розчину при 20 °С. Концентрація етанолу С в розчині у відсотках за масою показує, яка кількість грамів безводного етанолу міститься в 100 г водно-спиртового розчину. Співвідношення між відсотками за об'ємом і відсотками за масою наведені в таблиці 1 ДФ XI, складеної на підставі залежності Ск-Рб/в =Ст -Рр.ну> (3.4) де рб/в — густина безводного етанолу; Рр-ну — густина водно-спиртового розчину. Вміст етанолу у водно-спиртових розчинах визначають скляним і металевим спиртомірами, а також за густиною — денсиметром (ареометром) або пікнометром (рис. 3.3). За допомогою значення густини при 20 °С визначають Cv i Ст, користуючись таблицею 1 ДФ XI. За значеннями густини, які отримані при інших температурах, і показаннями скляного і металевого спиртомірів переведення в відсотки за об'ємом при 20 °С здійснюють за спеціальними таблицями видавництва стандартів1. Концентрацію етанолу визначають скляними спиртомірами класу 0,1 (ціна поділки — 0,1 %) або класу 0,5. Арбітражні визначення міцності спиртових розчинів проводять металевими або скляними спиртомірами класу 0,1. Для практичних цілей користуються спиртомірами класу 0,5 із вбудованим термометром. Комплект складається з двох або трьох спиртомірів (0—60, 60— 100 або 0—40, 40—70, 70—100 %). Скляний спиртомір при температурі 20 °С показує об'ємну частку етанолу у відсотках. Але в умовах великих фармацевтичних виробництв температура часто відхиляється від 20 °С. У цих випадках визначення проводять при фактичній температурі, а отримані значення скляного спиртоміра приводять до 20 °С за допомогою таблиці III видавництва стандартів. Точніше (із точністю 0,1 %) концентрацію спирту визначають металевим спиртоміром (рис. 3.3), що являє собою порожню кулю 1 Таблицы для определения содержания этилового спирта в водно-спиртовых растворах.— M.: Изд-во стандартов, 1979.
з припаяною шкалою зверху і конічним стержнем для навішення гирі знизу. На шкалі нанесені поділки від 0 до 10, кожна з яких розділена на п'ять частин. Під нульовою поділкою шкали нанесена поділка 100. До спиртоміра додаються 10 гирок у формі кульового сегмента з прорізом під номерами 0, 10, 20, 30, 40, 50, 60, 70, 80, 90. Найбільша гирка має нульовий номер, найлегша — номер 90. Показання металевого спиртоміра є умовними і складаються з показань гирки і шкали. При зануренні спиртоміра без гирки до показань шкали додають 100. Об'ємну частку етанолу Су в розчині за показаннями металевого спиртоміра визначають у відповідності з таблицею IV видавництва стандартів.
Денсиметр (ареометр) при температурі 20 °С показує густину водно-спиртового розчину, за якою знаходять концентрацію етанолу, користуючись алкоголеметричною таблицею 1 ДФ XI. Концентрацію етанолу за показниками денсиметра при температурі, що відрізняється від 20 °С, визначають за допомогою таблиці II видавництва стандартів (точність до 0,01). Більш точні значення густини розчинів (0,001) можна одержати за допомогою пікнометра при 20 °С. За отриманими даними розраховують густину при 20 °С (з урахуванням густини повітря при нормальному барометричному тискові) і знаходять концентрацію етанолу в алкоголеметричній таблиці 1 ДФ XI. Вміст спирту у водно-спиртовому розчині визначається також рефрактометрично і за величиною поверхневого натягу. Розведення водно-спиртових розчинів необхідно проводити за об'ємом і за масою. При цьому зручно виходити з рівняння матеріального балансу абсолютного спирту:
де X — кількість міцного спирту; а — концентрація міцного спирту; p — кількість спирту необхідної концентрації; b — необхідна концентрація. Для розведення слабкими спиртами формула (3.5) набуває іншого вигляду: X ■ (а - c) = p ■ (b - c), (3.6) де c — концентрація слабкого спирту. Розрахунки можуть бути проведені за правилом «зірочки»: Зліва вгорі записують концентрацію міцного розчину а; зліва внизу — концентрацію розріджувача, слабкого розчину c; у разі чистого розчинника c = 0. У центрі записується потрібна концентрація b. Цифри праворуч одержують відніманням по діагоналі — від більшого менше. Вони показують відповідну (по горизонталі) кількість міцного розчину (b - c) і розріджувача (а - b). При додаванні цих величин одержують кількість розчину (а - c) необхідної концентрації. Формули (3.5), (3.6) і (3.7) прийнятні для розрахунків розведення як у масових, так і в об'ємних відсотках. Але слід пам'ятати, що у випадках розведення об'ємів може бути використана тільки концентрація за об'ємом, при розведенні масових кількостей — тільки концентрація за масою. При розведенні за об'ємом розраховують необхідний об'єм міцного етанолу. Визначення кількості води утруднене через явище контракції, тобто зменшення об'єму суміші води і етанолу проти їхньої арифметичної суми. Тому простіше не розраховувати необхідну кількість води, а до розрахованої кількості міцного етанолу додати воду до необхідного об'єму при температурі 20 °С. Можна також скористатися алкоголеметричними таблицями 3 і 4 ДФ XI, c. 318, 319. Облік етанолу. На хіміко-фармацевтичних підприємствах облік здійснюють за об'ємом безводного етанолу при 20 °С, адже склади одержують етанол-ректифікат в об'ємі. У документації вказують температуру в мірнику, показання металевого спиртоміра, концентрацію етанолу (при 20 °С), множника об'ємного вмісту безводного етанолу, об'єму безводного етанолу при 20 °С. У виробничих умовах етанол розводять переважно за масою (температура при цьому не має значення). Концентрацію етанолу за об'ємом переводять у відсотки за масою і виконують розрахунки у відповідності з формулами (3.5) і (3.6) або правилом змішування (3.7). Переведення об'єму одержаного етанолу-ректифікату в масу здійснюється зважуванням, а також розрахунково — через абсолютний етанол за таблицею VI, складеною з урахуванням зважування в повітрі (наказ МОЗ CPCP № 580 від 14.12.62 p.). Зберігається спирт у спиртосховищі фармацевтичного підприємства, що має стандартні мірники, які підлягають перевірці спеціальною службою стандартизації раз на рік. На виробництво етанол відпускається в міру необхідності мірниками. При цьому облік ведуть за масою 96 % -вого (або 95 % -вого) етанолу, за об'ємом етанолу безводного або Об'ємом при фактичній концентрації. У зв'язку з цим кількість отриманого і витраченого етанолу перераховують на 96 % -вий етанол або ж об'єм безводного етанолу при 20 °С. Хлороформ (Chloroformium). Безбарвна, прозора, рухлива рідина з характерним запахом і солодким смаком. Змішується у всіх співвідношеннях зі спиртом етиловим, ефіром. У хлороформі добре розчиняються лікарські речовини, нерозчинні або малорозчинні у воді. Він справляє, як і всі галагенопохідні, наркотичну й дезінфікувальну дію, належить до сильнодіючих речовин. Хлороформ використовують здебільшого у лікарських формах для зовнішнього застосування, як правило, у комбінації з іншими розчинниками — спиртом етиловим, ефіром, жирними оліями.
Ефір медичний (Aether medicinalis). Хімічна назва — діетиловий етер. Безбарвна, прозора, легкозаймиста із своєрідним запахом, пекуча на смак рідина. Ефір медичний частіше називають просто ефіром. Він розчиняє багато лікарських речовин. Розчиняється в 12 частинах води, змішується в різних співвідношеннях зі спиртом етиловим, хлороформом, петролейним етером, жирними оліями та ефірними маслами. За здатністю розчиняти аналогічний хлороформові — у ньому розчиняються ті ж самі лікарські речовини і приблизно в такій же концентрації, що й у хлороформі. Пари ефіру отруйні, вони здатні осідати, дуже рухливі і можуть накопичуватися на далекій відстані від джерела випаровування. Температура займання ефіру — 40 °С. Він, як і хлороформ, має наркотичну дію, у неводних розчинах використовується рідко, тільки в комбінації з іншими розчинниками. Гліцерин (Glycerinum). Безбарвна, схожа на сироп, прозора, гігроскопічна рідина, солодка на смак, нейтральної реакції. Розчиняється у воді, спирті та в суміші спирту й ефіру, але не розчиняється в ефірі, хлороформі та жирних оліях. Гліцеринові розчини легко змиваються водою і мають меншу адсорбцію розчинених речовин. У фармацевтичній практиці використовують не абсолютний гліцерин, як і спирт етиловий, а розведений водою, із вмістом гліцерину 86—90 % і густиною 1,225—1,235, тобто із вмістом води 12—15 %. Це пов'язано з тим, що безводний гліцерин дуже гігроскопічний і має подразливі властивості. Жирні олії (Olea pinguia). Являють собою суміші естерів гліцерину і вищих жирних кислот. Зовні це — прозорі або ледь забарвлені маслянисті рідини без запаху або зі слабким характерним запахом. У медичній практиці використовують олії, отримані тільки методом холодного пресування. Як і всі жири, рослинні олії не змішуються з водою, малорозчинні в спирті етиловому, але легко — в ефірі та хлороформі. Для приготування лікарських препаратів найчастіше використовують мигдалеву, персикову, маслинову, соняшникову та інші олії. Якість їх регламентована відповідними фармакопейними статтями за певними показниками: в'язкістю, числом омилення, йодним, кислотним, ефірним числами тощо. Розчинення лікарських речовин у них, як і в гліцерині, доцільно проводити при нагріванні. Як біологічно нешкідливі та фармакологічно індиферентні, рослинні олії мають невисоку хімічну стабільність. Наявність в їх складі ненасичених жирних кислот є причиною згіркнення. При цьому в результаті окиснення й гідролізу жирів утворюються пе-роксидні сполуки, альдегіди та інші продукти. Олії набувають неприємного смаку і запаху. Світло, кисень повітря, волога та різні мікроорганізми підсилюють ці процеси. Масло вазелінове (Oleum Vaselini). Це, власне, фракція нафти. Безбарвна, прозора, масляниста рідина без смаку і запаху, є сумішшю насичених вуглеводнів С10Н22—С15Н32. Змішується у будь-яких співвідношеннях з ефіром, хлороформом, бензином, оліями, крім рицинової, не розчиняється у воді й спирті. За розчинювальною активністю його можна порівняти з рослинними оліями. Масло вазелінове не всмоктується шкірою і слизовими оболонками, зменшує резорбцію лікарських речовин. Вадою слід вважати те, що при нанесенні на шкіру воно значною мірою перешкоджає її газо- і теплообміну. 3 цієї причини, а також через обмежену розчинювальну здатність використовується рідше, ніж рослинні олії. Більше застосування знаходить у технології м'яких лікарських форм. Димексид (Dimexidum) — диметилсульфоксид. Сіркоорганічна сполука, похідна сульфату діоксиду. Безбарвна, прозора рідина або безбарвні кристали зі специфічним запахом, дуже гігроскопічні. Змішується у всіх співвідношеннях із водою, спиртом, ацетоном, гліцерином, хлороформом, ефіром, рициновою олією. Є розчинником лікарських речовин різної хімічної природи. Інтерес до цього розчинника пов'язаний не лише з його високою розчинювальною здатністю, але і з властивістю легко проникати крізь неушкоджені тканини, проводячи із собою розчинені речовини. Крім того, димексид має знеболювальну, протизапальну і жарознижувальну дію, а також антимікробний ефект. Ці властивості димексиду оцінені в технології рідких та м'яких лікарських форм. У виробництві рідких лікарських форм як розчинники також використовують поліетиленоксид-400, есилон-4, есилон-5 та ряд інших речовин. ВОДНІ РОЗЧИНИ Водні розчини нестійкі при зберіганні через можливі гідроліз, мікробну контамінацію, окиснення тощо. Тому номенклатура розчинів обмежена і включає лише препарати масового виробництва, придатні для тривалого зберігання. Зараз у фармакопейних статтях встановлено норми мікробного забруднення — не більше 1000 мікроорганізмів і 100 грибків у 1 мл розчину за повної відсутності патогенної мікрофлори. Терапевтичний ефект при лікуванні водними розчинами можна регулювати, змінюючи ступінь дисоціації та сольватації лікар-
ських речовин додаванням електролітів, ПАР, зміною значення pH і в'язкості. Технологія їх приготування зводиться до простих операцій розчинення або змішування, очищення і фасування. Розчин алюмінію ацетату основного (Solutio Aluminii subacetatis). Розчин одержують завдяки хімічній взаємодії речовин за дві стадії. На першій стадії синтезують алюмінію гідроксид із галунів алюмокалієвих і кальцію карбонату; або галунів і натрію карбонату; або алюмінію сульфату і кальцію карбонату; а також алюмінію сульфату і натрію карбонату. На другій стадії алюмінію гідроксид промивають від електролітів і обробляють 30 %-вою оцтовою кислотою. Препарат також одержують електрохімічним способом, який базується на узагальненій реакції. Анодом служить листовий алюміній марки A-1, електролітом — 8 % -вий розчин оцтової кислоти. Цим способом одержують чистіший розчин, його густина дорівнює 1,040 — 1,046. СПИРТОВІ РОЗЧИНИ Номенклатура спиртових розчинів широка і включає: розчини йоду, камфори, ментолу, брильянтового зеленого, метиленового синього; кислоти мурашину, саліцилову, борну; нашатирно-анісові краплі і т. ін. Розчин йоду 5%-вий. Для приготування розчину беруть 20 масових частин калію йодиду, 50 масових частин йоду кристалічного, води і спирту 95 %-вого порівну до 1000 об'ємних частин. В емальований реактор завантажують кристалічний йод, калію йодид і подвійну кількість відносно калію йодиду води очищеної. У концентрованому розчині калію йодиду розчиняється значна кількість йоду. Потім додають приблизно 1/5 спирту етилового і перемішують 15 хв до повного розчинення всіх компонентів. Доливають спирт, що залишився, і потім невеликими порціями — воду, при постійному перемішуванні. Розчин відстоюють і фільтрують. Дата добавления: 2016-03-26 | Просмотры: 1023 | Нарушение авторских прав |